桃核承气汤通过JAK2/STAT1信号通路干预急性盆腔炎模型大鼠的研究Δ
2019-10-16杨伟娜杨军娜
杨伟娜,杨军娜,姚 伊
(1.山东中医药大学第二附属医院生殖科,山东 济南 250001; 2.烟台市牟平区第二人民医院急诊科,山东 烟台 264100; 3.山东中医药大学第二附属医院生殖中心,山东 济南 250001)
盆腔炎性疾病(pelvic infammatory disease,PID)多见于有月经、性活跃的妇女,是发生于女性生殖道的感染性疾病[1]。该病临床发病率较高,不及时治疗可引起弥漫性腹膜炎、败血症及感染性休克,严重者可危及生命。目前,中医药在PID的治疗上具有一定优势。桃核承气汤是中医经典名方,具有逐瘀泻热之功效。研究结果表明,桃核承气汤对盆腔炎的疗效明显[2]。本研究通过观察桃核承气汤对PID模型大鼠JAK2/STAT1信号通路的干预调节,探讨桃核承气汤治疗PID的作用机制。
1 材料
1.1 实验动物
选取SPF级Wistar雌性大鼠72只,体质量(200±15)g,由山东中医药大学实验动物中心提供,实验室普通清洁环境饲养,适应性喂养1周后开始实验造模。
1.2 药品与试剂
桃核承气汤[组成:桃仁12 g,大黄12 g,桂枝6 g,甘草(炙)12 g,芒硝6 g],置于凉水中浸泡1 h,蒸煮30 min后浓缩至质量浓度为2 g/ml;妇科千金片(株洲千金药业股份有限公司,批准文号:国药准字Z43020027)。解脲支原体、大肠杆菌(菌种号:336902)及金黄色葡萄球菌(菌种号:186335)购于北纳生物科技有限公司。兔抗大鼠p-JAK2抗体(批号:11670-1-AP)、山羊抗大鼠p-STAT1抗体(批号:9145-1-CB)、兔抗大鼠SOCS1(批号:3950P)和PIAS3(批号:9042P)抗体均购自上海万疆生物技术有限公司;兔抗羊IgG抗体(批号:111004)和羊抗兔IgG抗体(批号:112586)购自北京索莱宝科技有限公司;肿瘤坏死因子α(TNF-α)酶联免疫吸附检测试剂盒(批号:E201901)、白细胞介素17(IL-17)酶联免疫吸附检测试剂盒(批号:P201802)和C反应蛋白(CRP)酶联免疫吸附检测试剂盒(批号:P201811)由北京方程生物有限公司生产。
2 方法
2.1 分组与给药
2.1.1 分组与造模:72大鼠随机分空白对照组、模型对照组、阳性对照组和核桃承气汤低剂量组、中剂量组及高剂量组,每组12只。参照相关文献[3]制备PID大鼠模型:用质量分数为0.4%戊巴比妥钠按照50 mg/kg麻醉大鼠,在无菌条件下取大鼠下腹正中切口约0.8~1 cm,开腹后暴露并固定子宫,用1 ml注射器抽取混合菌液0.2 ml,在注入混合菌液之前,用注射器机械损伤大鼠子宫内膜组织,然后注入混合菌液至双侧子宫内,缝合切口。空白对照组大鼠只需向右侧子宫注射0.9%氯化钠溶液0.1 ml/只,不损伤子宫内膜。
2.1.2 菌液制备:将大肠杆菌、乙型溶血性链球菌和金黄色葡萄球菌按2∶1∶1混合成感染用菌液。
2.1.3 给药:造模后5 d开始给药,空白对照组、模型对照组大鼠灌胃给予蒸馏水5 ml/只;低剂量组、中剂量组及高剂量组大鼠分别灌胃给予桃核承气汤4、8及16 g/(kg·d),1日1次,连续3周。阳性对照组大鼠给予妇科千金片0.2 g/(kg·d),1日1次,连续3周。
2.2 标本采集与检测
2.2.1 苏木精-伊红染色法(hematoxylin-eosin staining,HE)观察组织学变化:给药结束24 h后,给予乌拉坦7.5 ml/kg麻醉并处死大鼠,开腹取子宫组织,分两部分存放,一部分置于-80 ℃冰箱中进行保存,一部分置于10%多聚甲醛中固定。将固定后的子宫组织进行石蜡包埋、切片及HE染色,显微镜下观察并记录组织病理学改变。组织病理学评分:0分为子宫组织正常,无血管充血,无水肿,无炎症细胞浸润等;1分为子宫组织结构模糊,血管轻度水肿,并出现炎性细胞浸润;2分为子宫组织界限不清晰,血管充血水肿,炎症细胞浸润明显;3分为子宫组织结构模糊,破坏明显,血管不清晰,炎症细胞大量浸润。
2.2.2 酶联免疫吸附法测定外周血炎性因子含量:大鼠处死后,断头取血10 ml,分组置于离心机中,转速3 000 r/min,离心10 min,取上清液,采用酶联免疫吸附法检测血清中TNF-α、IL-17及CRP含量。
2.2.3 免疫印迹(Western Blot,WB)法测定JAK2/STAT1信号通路蛋白表达:将子宫组织加入IP细胞裂解液,冰上放置30 min,采取蛋白提取试剂盒提取组织中总蛋白,采用BCA法测定蛋白质浓度。采用聚丙烯酰胺凝胶电泳法分离等量蛋白质,并转移至聚偏氟乙烯(PDVF)膜上,置于4 ℃下添加一抗与β-肌动蛋白(β-actin,1∶500)孵育过夜。洗涤后添加辣根过氧化物酶缀合的二抗(1∶500)常温(25 ℃)下孵育2 h。采用ECL发光试剂显影后,使用Quantity One软件分析蛋白相对表达水平。
2.3 统计学方法

3 结果
3.1 六组大鼠卵巢、子宫组织病理评分比较
空白对照组大鼠的子宫组织细胞界限清晰,组织细胞排列整齐,血管无充血,无炎症浸润;模型对照组大鼠子宫组织界限出现模糊,组织上皮细胞出现脱落坏死,血管充血,炎症浸润明显,经桃核承气汤汤、妇科千金片治疗后,上述症状均得到缓解,见图1。与空白对照组比较,低剂量组、中剂量组及高剂量组大鼠子宫病理评分均明显升高,差异均有统计学意义(P<0.05);与模型对照组比较,低剂量组、中剂量组及高剂量组大鼠子宫病理评分均明显降低,差异均有统计学意义(P<0.05),且桃核承气汤的治疗作用具有明显剂量依赖性,见表1。
3.2 六组大鼠子宫组织中TNF-α、IL-17及CRP含量比较
与空白对照组比较,模型对照组大鼠子宫中TNF-α、IL-17及CRP含量明显升高,差异均有统计学意义(P<0.05);与模型对照组比较,低剂量组、中剂量组及高剂量组大鼠子宫中TNF-α、IL-17及CRP含量明显降低,差异均有统计学意义(P<0.05),且桃核承气汤作用具有剂量依赖性,见表2。

A.空白对照组;B.模型对照组;C.阳性对照组;D.低剂量组;E.中剂量组;F.高剂量组A.blank control group; B.model control group; C.positive control group; D.low dose group; E.middle dose group; F.high dose group图1 子宫组织病理检测结果(HE染色,200倍)Fig 1 Results of pathological examination of uterine tissue (HE, 200x)

组别子宫病理评分空白对照组(n=12)0.08±0.21模型对照组(n=12)2.74±0.43∗阳性对照组(n=12)1.22±0.19∗#低剂量组(n=12)2.11±0.76∗#中剂量组(n=12)1.76±0.54∗#△高剂量组(n=12)1.31±0.49∗#△◇
注:与空白对照组比较,*P<0.05;与模型对照组比较,#P<0.05;与低剂量组比较,△P<0.05;与中剂量组比较,◇P<0.05
Note: vs. blank control group,*P<0.05; vs. model control group,#P<0.05; vs. low dose group,△P<0.05; vs. middle dose group,◇P<0.05

表2 六组大鼠子宫组织中TNF-α、IL-17及CRP含量比较Tab 2 Comparison of the contents of TNF- α, IL-17 and CRP in uterine tissues among 6 group
注:与空白对照组比较,*P<0.05;与模型对照组比较,#P<0.05;与低剂量组比较,△P<0.05;与中剂量组比较,◇P<0.05
Note: vs. blank control group,*P<0.05; vs. model control group,#P<0.05; vs. low dose group,△P<0.05; vs. middle dose group,◇P<0.05
3.3 六组大鼠子宫组织中JAK2/STAT1信号通路蛋白表达水平比较
与空白对照组比较,模型对照组大鼠p-JAK2、p-STAT1、SOCS1及PIAS3蛋白表达明显升高,差异均有统计学意义(P<0.05);与模型对照组比较,低剂量组、中剂量组及高剂量组大鼠JNK/p38信号蛋白表达明显降低,差异均有统计学意义(P<0.05),且桃核承气汤药物作用具有剂量依赖性,见图2、表3。
4 讨论
急性盆腔炎是妇科常见疾病,发病时常出现下腹痛伴发热,其病理改变主要以细菌感染后引发的组织变性、增生和粘连为主,病理改变后导致机体刺激继而引发免疫反应。盆腔炎类疾病属中医学“带下”“腹痛”范畴,其病机主要是湿热下注、热郁血瘀等,治疗原则当属清热利湿、活血化瘀等[4]。桃核承气汤出自《伤寒论》,该方主要有桃仁、大黄、桂枝、甘草(炙)及芒硝等五味药,是经典的理血剂,具有逐瘀泻热之功效,主治下焦蓄血证[5]。目前,该药在临床上常被用于治疗急性盆腔炎、附件炎及子宫内膜异位症等属瘀热互结下焦者。方中桃仁甘平苦,活血逐瘀;大黄苦寒,祛瘀泻热,二者共用瘀热并治,共为君药。桂枝甘辛温,通行血脉;芒硝咸苦寒,泻热软坚,二者合为臣药,既助大黄下瘀泻热,又助桃仁活血祛瘀。炙甘草护胃安中,缓和诸药之峻烈,为佐使药。

A.空白对照组;B.模型对照组;C.阳性对照组;D.低剂量组;E.中剂量组;F.高剂量组A.blank control group; B.model control group; C.positive control group; D.low dose group; E.middle dose group; F.high dose group图2 子宫组织中JAK2/STAT1信号通路蛋白表达Fig 2 Expression of JAK2/STAT1 signal pathway protein in uterine tissue
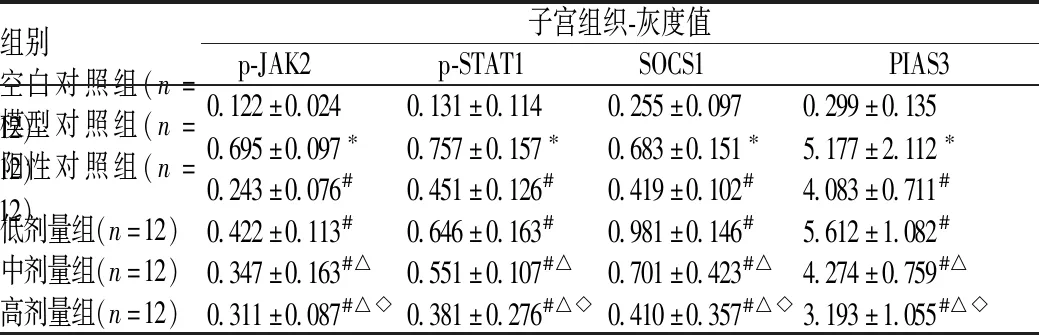
组别子宫组织-灰度值p-JAK2p-STAT1SOCS1PIAS3空白对照组(n=12)0.122±0.0240.131±0.1140.255±0.0970.299±0.135模型对照组(n=12)0.695±0.097∗0.757±0.157∗0.683±0.151∗5.177±2.112∗阳性对照组(n=12)0.243±0.076#0.451±0.126#0.419±0.102#4.083±0.711#低剂量组(n=12)0.422±0.113#0.646±0.163#0.981±0.146#5.612±1.082#中剂量组(n=12)0.347±0.163#△0.551±0.107#△0.701±0.423#△4.274±0.759#△高剂量组(n=12)0.311±0.087#△◇0.381±0.276#△◇0.410±0.357#△◇3.193±1.055#△◇
注:与空白对照组比较,*P<0.05;与模型对照组比较,#P<0.05;与低剂量组比较,△P<0.05;与中剂量组比较,◇P<0.05
Note: vs.blank control group,*P<0.05; vs. model control group,#P<0.05; vs. low dose group,△P<0.05; vs.middle dose group,◇P<0.05
研究结果显示,当机体发生急慢性炎症时,外周血中炎性因子的种类和比例会发生变化[6]。TNF-α、IL-17及CRP是对机体免疫反应发生和发展起重要作用的炎性因子,其通过调控多种细胞信号通路来放大炎症反应,促使机体发挥致炎调控作用[7-9]。而JAK/STAT信号通路在PID发病过程中有着重要的作用,该信号通路蛋白在机体内广泛参与细胞增殖、分化及免疫反应调节,由此推测桃核承气汤可能通过调节JAK/STAT信号通路来干预PID发病机制[10]。
本研究主要是通过探讨桃核承气汤对JAK2/STAT1信号通路蛋白的干预机制来验证桃核承气汤治疗PID的作用机制。本研究结果显示,造模后,除空白对照组外,其他各组大鼠的子宫组织均出现不同程度的炎症细胞浸润现象,且均存在血管充血、组织模糊等,提示PID大鼠模型制备成功;通过对各组大鼠外周血中炎性因子的测定,模型对照组大鼠的TNF-α、IL-17及CRP含量均明显高于其他组。治疗后,阳性对照组、低剂量组、中剂量组及高剂量组大鼠组织学结果提示,大鼠的子宫组织炎症反应情况均得到明显改善,其中外周血TNF-α、IL-17及CRP等炎性因子含量均出现降低,说明桃核承气汤可能通过调控PID大鼠的炎症反应,促使其机体进行免疫反应,发挥抗炎作用,与李洪兵[11]的研究结果一致。
JAK/STAT信号通路是一类非受体酪氨酸激酶信号通路,主要由细胞因子刺激控制的信号转导通路,该信号通路在机体内主要参与多种免疫细胞的表达,尤其在免疫调节等方面起重要作用。JAK家族主要包括JAK1、JAK2、JAK3及TYK2,是胞质内非受体型可溶性酪氨酸蛋白激酶[12];STAT共7个家族成员,包括STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b及STAT6,STAT可与靶基因合作,调控DNA胞浆蛋白家族[13]。JAK/STAT信号通路表达主要分为3个过程,包括酪氨酸激酶相关受体、酪氨酸激酶JAK和转录因子STAT。研究结果显示,JAK-STATs信号传导通路在急性盆腔炎免疫发病过程中起关键作用[14]。当机体稳态发生变化时,胞外信号调节蛋白(ESPs)就会与胞膜上的特应性受体相结合,激活JAK2并发生趋化反应与受体结合,人磷酸化信号传导子及转录激活子在p-JAK2促使下发生(异)二聚体化,最终介导目的基因转录并控制炎性因子的表达[15]。炎性因子表达后,继续刺激JAK-STATs信号传导激化,加剧机体炎症免疫反应。SOCS1能通过调控JAK-STATs信号通路,改变信号传导的强度来控制炎症反应。研究结果显示,SOCS1蛋白在细胞中参与了多种激酶(如JAK1、JAK2、JAK3及TYK2)的结合反应,调控信号通路的磷酸化及接触性活化,进而改变炎性因子的信号传导,达到控制炎症反应的目的[16]。此外,PLAS3作为PLAS蛋白家族主要成员,其在激活后,可与活化后的p-STAT结合,阻止(异)二聚体化,从而有效抑制STAT指导DNA转录[17]。SOCS1和PLAS3作为重要的负反馈调节蛋白激酶,其与JAK-STATS共同参与该通路信号的负反馈调节机制,对机体炎症反应发生和发展有着重要的调节作用[18-19]。本研究结果发现,造模后,PID各造模组大鼠的子宫组织炎症反应明显,炎性因子(TNF-α、IL-17及CRP)含量明显升高,子宫组织中p-JAK2、p-STAT1、SOCS1和PIAS3蛋白表达水平明显升高,这说明JAK2/STAT1信号通路传导炎症信号增强,也证实JAK2/STAT1信号通路及其调节机制与盆腔炎的发病具有相关性,与国内外报道基本一致[20-22]。低剂量组、中剂量组及高剂量组大鼠子宫组织p-JAK2、p-STAT1、SOCS1和PLAS3表达水平出现下降,说明桃核承气汤可有效降低盆腔炎模型大鼠子宫组织p-STAT1和p-JAK2的表达,并调节JAK2/STAT1信号通路中SOCS1和PLAS3等2种负反馈蛋白的表达,从而有效控制炎症信号通路的传导,控制炎症程度,与Liu等[23]的研究结果一致。本研究过程中发现,高剂量组大鼠的症状改善更为显著,说明桃核承气汤治疗PID的作用具有剂量依赖性。
综上所述,桃核承气汤可通过调控JAK2/STAT1信号通路、控制负反馈机制的方法有效改善PID大鼠子宫组织的炎症反应程度,这与该药调控p-JAK2、p-STAT1、SOCS1和PLAS3作用密不可分。下一步可从基因等角度深入探究桃核承气汤对PID的干预机制。
