冠心病EAT中miR-455b-3p调控脂肪细胞分化及炎症因子
2019-10-15杜雅彦怀施涛吕作利魏育涛
杜雅彦,刘 洋,卢 沐,怀施涛,吕作利,魏育涛
冠状动脉粥样硬化性心脏病(coronary artery disease,CAD)是欧洲发达国家导致死亡的主要因素[1]。随着经济增长,发展中国家的心血管疾病数量也在增加。心外膜脂肪组织(epicardial adipose tissue,EAT)是一种沉积在心肌表面独特的内脏脂肪组织[2],能分泌脂联素(adiponectin,APN,ADIPOQ)等脂肪细胞因子,可能会对心脏功能产生影响,但EAT启动炎症发生的机制并不十分明确。微小RNA(microRNA, miRNA)是一类大小约22个核苷酸的单链非编码RNA[3],通过与靶基因互补位点结合的方式来调控基因表达,调控多种疾病发生和发展。miRNAs在CAD发病机制的各个环节中都有作用,但其对CAD发生发展的具体机制尚不明确。该实验通过芯片筛选结果显示,在CAD 患者EAT中,miR-455b-3p高表达。生物信息学预测,miR-455b-3p与APN靶向结合。该研究以miR-455b-3p为切入点,探讨miR-455b-3p对脂肪细胞分化及脂肪细胞因子表达的影响。
1 材料与方法
1.1 病例资料收集2016年3月~2017年6月在石河子大学医学院附属第一医院心胸外二科行冠状动脉旁路移植术的CAD患者34例作为实验组,对照组为行瓣膜置换术的非冠心病(non-CAD)患者16例。手术前收集所有研究对象的一般资料和化验检查资料。实验组符合CAD的诊断标准及纳入标准。对照组冠状动脉造影阴性,需行瓣膜置换手术(瓣膜为退行性变)且符合纳入标准。本研究通过新疆石河子大学医学院附属第一医院伦理委员会批准(编号:2014-072-01),所有研究对象签署知情同意书。
1.2 主要试剂3T3-L1前体脂肪细胞(中科院上海细胞库);引物及内参(上海生工公司);miRNA模拟物及抑制物(上海吉玛制药公司);RNA提取试剂和 qRT-PCR反应试剂盒(日本TaKaRa公司);胎牛血清(美国Gibco公司);DMEM培养基及胰蛋白酶(美国Hyclone公司);TRIzol、LipofectamineTM2000转染试剂(美国Invitrogen公司);miRNeasy miRNA提取试剂盒(德国Qiagen公司);Thermo Scientific miRNA cDNA第一链合成试剂盒、miRNA荧光定量检测试剂盒(北京天根生化科技有限公司)。
1.3 方法
1.3.1诊断标准 参照我国卫生部发布的《冠状动脉粥样硬化性心脏病的诊断标准》(2010年版)以及2011年美国心脏联合会(American Heart Association,AHA)冠心病诊疗指南。
1.3.2纳入标准 实验组:① 年龄40~75(63.8±4.2)岁;② 符合CAD的诊断标准需行冠状动脉旁路移植术患者;③ 民族为汉族。对照组:① 年龄40~75(66.5±7.3)岁;② 冠状动脉造影阴性且需行瓣膜置换手术(瓣膜为退行性变)患者;③ 民族为汉族。
1.3.3排除标准 ① 合并有糖尿病或糖耐量异常者;② 其他类型心脏病,如风湿性心脏病患者;③ 患有恶性肿瘤者;④ 近期有创伤、外科手术者;⑤ 急、慢性感染者;⑥ 长期肝、肾等脏器疾病及其他内分泌疾病。
1.3.4收集临床资料 包括患者年龄、性别、身高、体质量、病程、大生化、心肌酶、超敏C反应蛋白、心脏彩超及颈动脉彩超等。
1.3.5标本采集 留取手术当天空腹卧位肘静脉血5 ml,留取血清-80 ℃冰箱保存。开胸后获取右室表面EAT约1 g,0.9%氯化钠溶液清洗并去除结缔组织后置于液氮中保存。在所有收集实验组及对照组标本中各挑选5例患者的EAT用于miRNA芯片检测,由上海伯豪生物芯片技术有限公司技术人员完成Agilent miRNA芯片检测。[Agilent human miRNA(8*60 K)V18.0 Design ID:70156]同步取患者循环血约5 ml,3 000 r/min离心10 min,取上层血浆至无酶EP管中,并置于-80 ℃冰箱中暂时冻存。
1.3.6EAT标本基因芯片检测 ① RNA抽提和纯化:采用mirVanaTMPARISTM标准操作流程进行样品总RNA抽提,抽提所得total RNA经电泳质检合格后备用;② RNA的标记:标本RNA按照 miRNA Complete Labeling and Hyb Kit标准操作流程对miRNA分子进行荧光标记;③ 芯片杂交:按照miRNA Complete Labeling and Hyb Kit进行标本杂交实验。在滚动杂交炉中,55 ℃,20 r/min,滚动杂交20 h之后在洗缸中洗片;④ 芯片扫描:芯片结果采用Agilent Microarray Scanner进行扫描,软件设置Scan resolution=5 μm,PMT 100%,5%最后采用 Gene Spring Software 11.0 进行归一化处理,所用的算法为Quantile;⑤ 差异表达:CAD组和non-CAD组间差异表达的miRNAs采用SAS 系统进行筛选[设定筛选阈值P<0.05,差异倍数值(fold change)>2且Flag值/Call值为至少一组内不出现A(Absent:表示差异无统计学意义) ]。
1.3.7细胞培养与诱导分化 在6孔板中将3T3-L1前脂肪细胞接种于含有10%FBS的高糖DMEM培养液,于37 ℃、5% CO2培养箱中培养,待细胞生长至80%~90%并接触抑制2 d退出对数增长期后,更换为终浓度为0.5 mmol/L 3-异丁基-1-甲基黄嘌呤(IBMX)、5 μg/ml胰岛素(INS)和1 μmol/L地塞米松(DEX)的细胞分化诱导液诱导2 d后,再更换含有55 μg/ml INS的维持培养基继续培养2 d,隔2 d更换含10%FBS的DMEM培养液。分化 8 d 后使用油红O染色鉴定诱导效率。
1.3.8细胞的转染 诱导成功的细胞待细胞密度达70%~80%时进行转染。用Opti-MEM稀释模拟物、抑制剂以及阴性对照组,并分别与转染试剂脂质体Lipofectmine 2000按2 ∶1混合均匀,室温放置20 min,使其形成稳定的复合物。再将复合物加入6孔板中,混匀,将6孔板置于37 ℃、5% CO2细胞培养箱中继续培养,24 h后收取细胞,空白处理作阴性对照。实验分为3组:上调组、下调组和NC组。脂肪细胞因子脂联素(adiponectin,APN,ADIPOQ)、Krüppel样因子4(Krüppel-like factors, KLF4)、白细胞介素-6(interleukin-6,IL-6)、单核细胞趋化因子1 (monocyte chemoattractant protein-1,MCP-1)、CCAAT /增强子结合蛋白α(C/EBPα)和过氧化物酶体增殖物激活受体-γ(PPARγ)总RNA提取后使用核酸定量分析仪分析RNA纯度。合格的RNA反转录为cDNA。使用Step One荧光定量PCR仪(美国ABI公司)进行PCR反应。
1.3.9RNA提取及实时荧光PCR检测 提取总RNA、反转录按照TaKaRa MiniBEST Universal RNA Extraction Kit细胞及组织RNA提取试剂盒及PrimeScriptTMRT reagent Kit with Gdna Eraser试剂盒说明书进行操作。Real-time PCR按照TB GreenTMPremic Ex TaqTMⅡ说明书操作。以U6为内参基因,用2-ΔΔCt的方法表示miR-455b-3p相对于内参基因的定量。引物序列见表1。

表1 实验相关引物序列
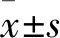
2 结果
2.1 患者的基本信息34例患者的基本临床信息见表2。其中,与对照组比较,实验组患者低密度脂蛋白和超敏C反应蛋白升高,高密度脂蛋白和APN降低,差异有统计学意义。

表2 患者的基本信息
2.2 实验组与对照组配对比较图1为使用散点图显示两组之间倍数变化和显著性之间的关系。Y轴是-log10(P值)(较高的值表示较大的显著性),并且X轴是倍数变化,即log2(miRNAs的表达量)。确定为显著的探针在polt上标记(FDRt检验<0.05)。图中的红点表示差异有统计学意义的miRNA。
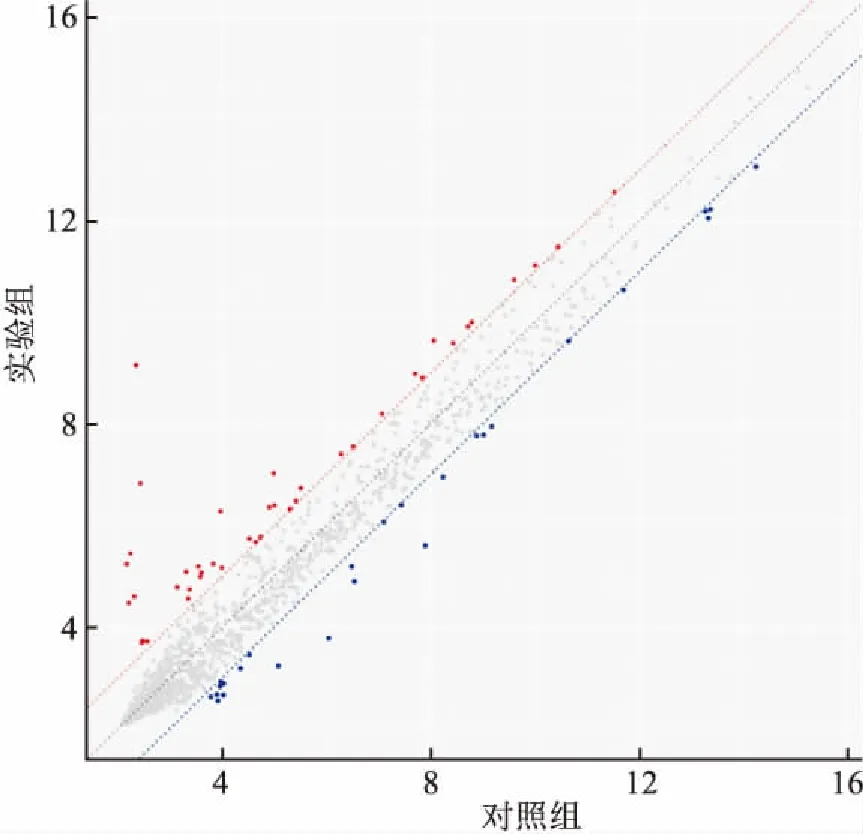
图1 实验组与对照组配对比较的散点图
2.3 miRNA芯片筛选出的DE-miRNAs热图结果图2为CAD(n=4)与对照(n=3)中差异表达的miRNA的分层聚类(差异有统计学意义,P<0.05和差异倍数>2倍)。Columns显示EAT样品的聚类,行显示基因的聚类。每个样品中每种miRNA的表达强度从红色变为绿色,这分别表示相对高或低的表达。在图的侧面描绘了代表上调至下调的不同模式的表达簇。
2.4 实验组和对照组EAT及血清中miR-455b-3p表达水平qRT-PCR验证结果显示,与对照组比较,miR-455b-3p在实验组EAT组织和血清中表达均上调,差异有统计学意义,见图3。
2.5 miR-455b-3p与APN和FABP4 3′非翻译区(3′-UTR)互补结合位点选取PicTar(http://pictar.org/)、miRGen(http://www.diana.pcbi.upenn.edu/miRGen.html)、TargetScan(http://www.targetscan.org/vert_50//)、miRWalk(http://www.microrna.org/microrna/)和miRDB(http:// mirdb.org / miRDB /)四个预测网站进行。为了减少软件预测的假阳性,取至少同时满足2个预测软件的基因才能作为靶基因。图4为预测出的结合位点。
2.6 miR-455b-3p表达谱3T3-L1前脂肪细胞诱导8 d后使用油红O染色鉴定诱导效率(图5)。3T3-L1前脂肪细胞经过鸡尾酒法诱导后分别于诱导0、2、4、6、8 d检测miR-455b-3p的表达(图6A)。
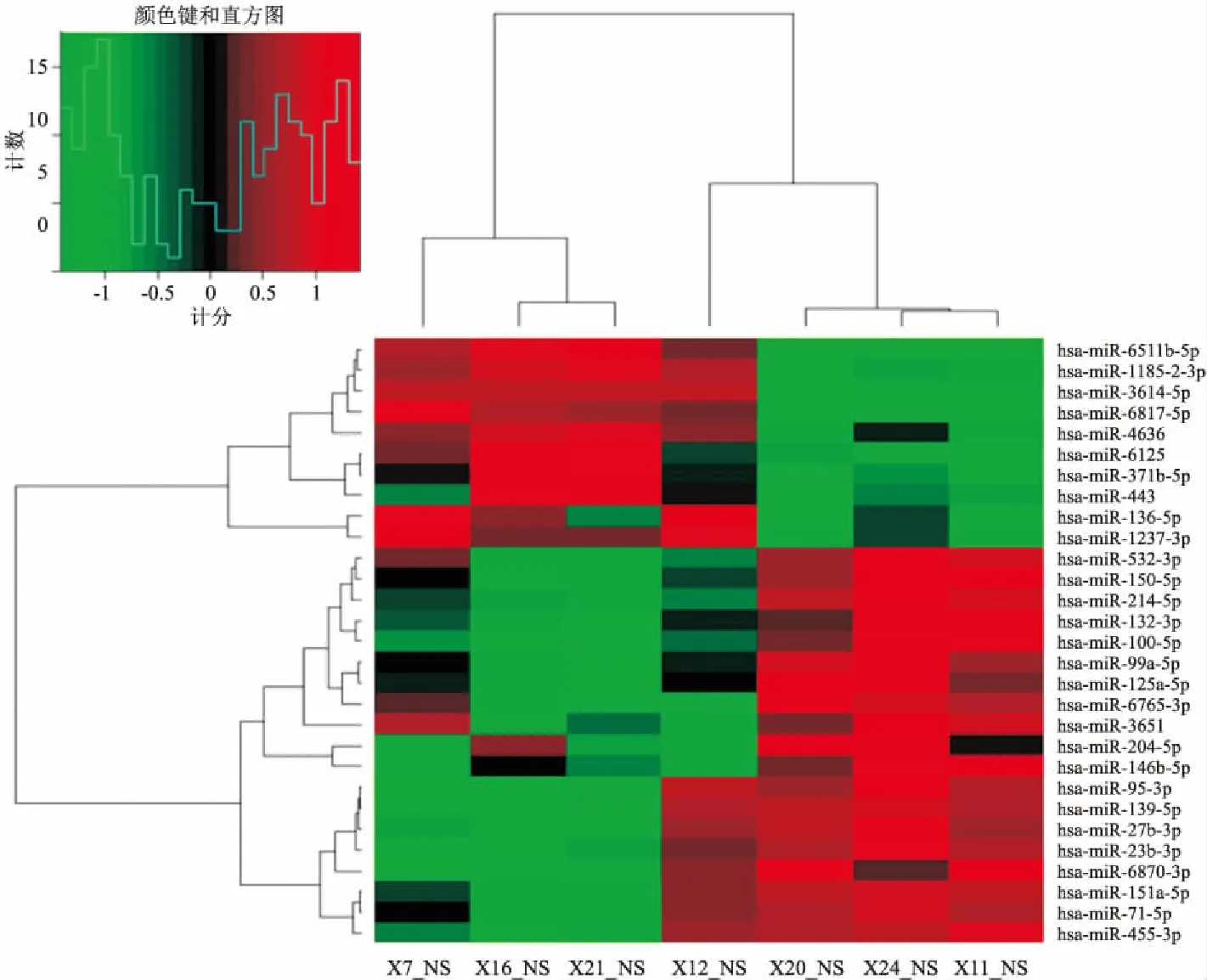
图2 差异miRNA分层聚类热图
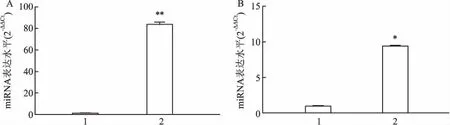
图3 实验组与对照组EAT和血清中miR-455b-3p表达水平A:EAT中miR-455b-3p表达水平;B:血清中miR-455b-3p表达水平;1:实验组; 2:对照组;与对照组比较:*P<0.05,**P<0.01

图4 miR-455b-3p与APN 3′-UTR结合位点

图5 诱导8 d后油红O染色 ×200A: 3T3-L1前脂肪细胞;B:油红O染色结果
2.7 miR-455b-3p对APN及脂肪细胞因子表达影响分别在脂肪细胞诱导分化成熟0、2、4、6、8 d时检测miR-455b-3p在3T3-L1细胞中的表达,结果显示miR-455b-3p呈先增多后减少并在8 d时达到最高的趋势(图6A);miR-455b-3p转染的3T3-L1细胞在转染后2 d通过qRT-PCR检测,结果显示,miR-455b-3p表达为转染前约15倍(图6B)。对已诱导成熟的3T3-L1脂肪细胞转染miR-455b-3p模拟物,与NC组比较,上调组3T3-L1脂肪细胞中APN、KLF4 mRNA表达减少,IL-6、MCP-1 mRNA表达增多,差异有统计学意义(图7A);下调组3T3-L1脂肪细胞中APN、KLF4 mRNA表达水平升高,IL-6、MCP-1 mRNA表达减少,差异有统计学意义(图7B)。

图6 miR-455b-3p表达谱及转染效率
A:miR-455b-3p在脂肪细胞分化过程中表达谱;B:miR-455b-3p转染效率;1:NC组;2:上调组;3:下调组
2.8 miR-455b-3p促进脂肪细胞分化成熟如油红O染色(图8)所示,与NC组比较,上调组分化第8天时在脂滴积累较对照组增多,脂肪形成标记基因PPARγ、C/EBPα的mRNA表达水平升高(图9)。
3 讨论
21世纪以来,冠心病是欧洲、美国以及亚洲国家导致死亡的最主要原因,占世界死亡人数的近三分之一。CAD的发生发展与脂代谢紊乱密切相关。EAT是一种位于心肌和心包脏层之间独特的内脏脂肪组织,EAT和心肌具有相同的微循环,这表明这两种结构之间有紧密的相互作用[4]。研究[5]表明EAT厚度是CAD独立危险因素,其厚度和代谢活性与CAD的严重程度呈正相关性,在CAD患者中,增厚的EAT可能通过分泌促炎性细胞因子和其他机制促进斑块的发展。

图7 miR-455b-3p对脂肪细胞因子表达影响
A:上调组脂肪细胞因子的表达量;B:下调组脂肪细胞因子的表达量; 1:APN;2:KLF4;3:IL-6;4:MCP-1;与NC组比较:*P<0.05

图8 鸡尾酒法诱导3T3-L1前脂肪细胞8 d后油红O染色鉴定 ×100A:3T3-L1前脂肪细胞;B:上调组油红O染色结果
APN是一种脂肪细胞因子,对不同类型细胞具有提高胰岛素敏感性、抗脂毒性、抗凋亡和抗炎作用,被认为是具有保护作用的生物活性蛋白质[6]。APN通过直接影响血管成分细胞(包括巨噬细胞、内皮细胞和平滑肌细胞)的行为来预防动脉粥样硬化进展。本研究显示,CAD患者EAT中高表达的miR-455b-3p靶向调控APN表达。因此以miR-455b-3p为切入点,观察其对APN的调控、对脂肪细胞因子表达以及对脂肪细胞分化的影响。

图9 miR-455b-3p对脂肪标志基因影响
A:上调组脂肪分化标志物的表达量;B:下调组脂肪分化标志物的表达量;1:PPARγ;2:C/EBPα;3:FABP4;与NC组比较:*P<0.05
miRNAs是一种具有调节功能的RNA,通过与对应的靶信使RNA(mRNA)特异性结合来直接降解靶mRNA,从而抑制靶mRNA的翻译,进行基因的转录后水平调控[7]。miRNAs在脂肪组织中表达有差异,因此被认为是代谢紊乱、CAD、2型糖尿病的诊断和治疗潜在生物学标志物[8]。近年来,人们对miRNA在脂肪细胞发育和肥胖的研究越来越深入[9]。研究[10]显示miR-183通过靶向Smad4级联调节PPARγ、C/EBPα、SREBP-1c和FAS,从而促进脂肪细胞分化。最近研究[11]表明,将miR-17-5p抑制剂尾静脉注入动脉粥样硬化小鼠体内后,动脉血管组织中的炎症反应和氧化应激水平有所降低。本研究显示,CAD患者的EAT和血清中miR-455b-3p高表达,高表达的miR-455b-3p可能通过调控APN和FABP4,从而引起脂代谢紊乱和炎症,并且促进脂肪细胞分化成熟。
肥胖既是心血管疾病的独立危险因素,也与其他几种危险因素密切相关。脂肪细胞分化与人体肥胖的发生密切相关。脂肪分化过程由几种转录因子组成的调控网络进行高度程序化调控,包括CCAAT /增强子结合蛋白(C / EBP)基因家族和过氧化物酶体增殖物激活受体-γ(PPARγ)[12], 在这些因子中,最主要的是PPARγ和C/EBPα。
动脉粥样硬化是动脉血流中内皮层紊乱、单核细胞迁移至血管壁并分化为巨噬细胞及泡沫细胞的炎性反应[13]。KLF4是一类具有锌指结构的转录因子,KLF4能够激活IL-10基因的表达,起到抗炎作用[14]。IL-6主要通过其介导的信号通路促进炎症反应,是一种目前已知的炎症因子[15]。MCP-1也称为趋化因子(CC基序)配体2(CCL2),参与炎症、伤口愈合、纤维化和血管形成过程。
综上,在冠心病心外膜脂肪组织中,脂代谢紊乱可能间接上调miR-455b-3p表达,而miR-455b-3p靶向调控APN表达,从而影响KLF4、IL-6和MCP-1等脂肪细胞因子分泌,导致其表达紊乱。同时miR-455b-3p能够促进脂肪细胞分化成熟,促进EAT在心外膜沉积及体积增多,从而引起CAD的发生发展,但其具体机制尚待进一步探究。
