背根神经节内GABA重摄取改变在神经痛发生发展中的作用
2019-10-15谢晓芳唐俊明
让 凌,谢晓芳,冉 然,薛 锐,肖 昀,郑 飞,唐俊明
神经痛在临床上很常见,如糖尿病性神经痛、带状疱疹后神经痛等,因发生机制尚不清楚,尚缺乏有效的治疗手段[1]。神经系统的敏感性升高是神经痛的重要发生机制[2-3]。γ-氨基丁酸(γ-aninobutyrate,GABA)重摄取是释放入突触内的GABA作用被终止的主要方式,其通过GABA转运蛋白(GABA transporter,GAT)将释放入突触内的GABA转运入神经元胞体或胶质细胞内,从而终止GABA的作用,改变神经系统的兴奋性[4]。研究[5]已经证实,背根神经节(dorsal root ganglion,DRG)内有GAT3的表达,但神经损伤后GAT3是否发生改变,这些改变是否和神经痛的发生有关,目前还没有研究涉及。该研究探讨了大鼠坐骨神经慢性束缚损伤(chronic constriction injury,CCI)模型上GAT3的改变,并且运用DRG局部注射技术,将GAT3抑制剂注射在DRG局部,探讨其对神经痛症状的影响,旨在为神经痛的发病机制和治疗寻找新的方法。
1 材料与方法
1.1 实验动物成年雄性SD大鼠36只,SPF级,体质量170~220 g,由湖北医药学院实验动物中心提供,动物饲养室温为(22±2)℃,湿度40%~70%,12 h昼夜交替,自由进食水。所有实验方案经湖北医药学院动物保护和使用委员会批准,按照国际疼痛研究协会的指导原则进行。
1.2 CCI模型参照以往文献[6-7],动物水合氯醛(30~40 mg/kg)腹腔注射后在右大腿中部切开皮肤,钝性分离股二头肌,暴露坐骨神经干,于坐骨神经分支近端处用4/0#羊肠线在坐骨神经上间隔1 mm做4个松结扎,结扎强度以大腿产生1个小的短暂性抽搐为宜,然后逐层缝合。术后单独饲养,12 h明暗交替光照,行为学测定确定神经痛造模成功。
1.3 Western blot动物用水合氯醛(30~40 mg/kg)腹腔注射麻醉后,冰上快速取出L4、L5DRG,置于液氮中保存,经RIPA裂解液(武汉Antgene公司)裂解,离心收集蛋白,用BCA试剂盒测蛋白浓度。每个加样孔30 μg蛋白样品,10% SDS-PAGE凝胶电泳后, 转移到PVDF膜上。用TBS配制的5%脱脂奶粉低速摇床封闭1 h。4 ℃下一抗孵育过夜,TBST洗膜,二抗室温孵育2 h,TBST洗膜后加入辣根过氧化酶显色剂显色,Bio Rad蛋白成像仪成像, 用Image J软件测灰度值进行半定量分析。所使用的抗体包括: α-Tubulin(小鼠抗大鼠,抗体稀释比1 ∶1 000,美国Sigma公司)、GAT3一抗(兔抗大鼠,抗体稀释比1 ∶750,美国Abcam公司);GAT3二抗(山羊抗兔,抗体稀释比1 ∶10 000)、内参二抗(山羊抗小鼠,抗体稀释比1 ∶10 000,美国Jackson公司)。
1.4 RT-PCR动物用水合氯醛(30~40 mg/kg,ip)麻醉后,冰上快速取出L4、L5DRG,置于液氮中研磨, TRIzol法提取总RNA,采用1%琼脂糖凝胶电泳检测RNA完整性,行分光光度计检测RNA浓度,并逆转录为cDNA,按SYBR PremixEx Ⅱ法行实时定量PCR反应,检测GAT3的表达。引物序列见表1。以GAPDH为内参,使用公式2-ΔΔCt计算mRNA的差异倍数。

表1 引物序列
1.5 L5DRG局部置管参照文献[8]方法,动物经水合氯醛(30~40 mg/kg)腹腔注射麻醉后,在大鼠背部L4-L6右侧旁开0.5 cm处,切开背部皮肤,钝性分离皮下组织和椎旁肌肉,暴露L5椎板,在椎间孔内2 mm处钻1个0.8 mm的孔,将预制的套管插入孔内2 mm,骨水泥固定,连接PE 10聚丙烯管,切口缝合。术后将大鼠分别安置在装有木屑地板的塑料笼子中,自由摄食和饮水,每次实验前动物适应环境至少24 h。
1.6 大鼠后爪热痛阈测定参照文献[8]方法,用大鼠爪痛觉检测仪(意大利UGO公司)测定大鼠后爪热痛阈。将大鼠放在玻璃笼器内,待大鼠适应安静后,将光源对准大鼠后足掌心,打开光源开关并自动开始计时,直到大鼠因疼痛出现缩足反射,计时结束,此时记录的时间为后爪热痛缩退反应潜伏期(paw withdrawal lantency, PWL)。为防止皮肤灼伤,设置最大强度55%,保护时间为25 s。测量5次,每次间隔10 min,取均值,即为大鼠热痛阈值。
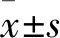
2 结果
2.1 CCI对大鼠痛阈的影响SD大鼠分为假手术组(Sham组,n=6)和CCI组(n=6),CCI组动物实施坐骨神经结扎,Sham组动物暴露坐骨神经,但不做结扎;与Sham组比较,术后第1天开始,CCI组大鼠PWL出现显著降低(F=57.296,P<0.05),这个改变持续到术后7 d。见图1。

图1 CCI对大鼠痛阈的影响与Sham组比较:*P<0.05
2.2 CCI对大鼠DRG内GAT3蛋白和mRNA表达的影响与Sham组比较,CCI组DRG 内GAT3蛋白在术后第3天有所增加(t=3.719,P<0.05),见图2。与Sham组比较,CCI术后DRG内GAT3 mRNA表达明显增加(t=5.369,P<0.05),见图3。
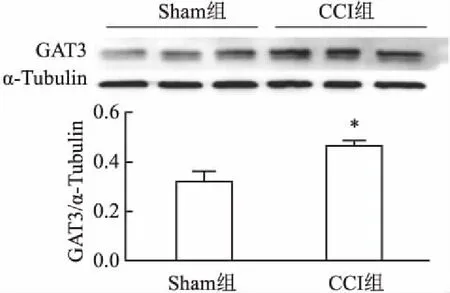
图2 CCI术后第3天DRG内GAT3的表达变化与Sham组比较:*P<0.05

图3 DRG内GAT3 mRNA表达变化与Sham组比较:*P<0.05
2.3 L5DRG局部注射GAT3抑制剂SNAP5114对大鼠痛阈的影响SD大鼠12只,预先置入导管并实施CCI手术,随机分为CCI组(n=6)和SNAP5114治疗组(SNAP组,n=6),在第3天分别通过导管给CCI组大鼠注射溶剂DMSO(10 μl),给SNAP组大鼠GAT3抑制剂[(S)-1-[2-[三(4-甲氧基苯基)甲氧基]乙基]-3-哌啶甲酸((S)-1-[2-[tris(4-methoxyphenyl)methoxy] ethyl]-3-piperidinecarboxylic acid,SNAP5114)(200 μg, 10 μl),分别于注射前、注射后30、60、120 min、24 h、48 h测双侧后爪热痛阈值PWL,对比双侧后爪PWL。CCI组注射DMSO后大鼠后爪痛阈值没有明显改变(P>0.05)。与CCI组(0.369±0.151)比较,SNAP组(0.779±0.095)DRG局部注射SNAP5114 120 min后,患侧后爪热痛阈值明显上升(F=10.822,P<0.05),持续至注射后24 h[CCI组:(0.616±0.0501),SNAP组:(0.859±0.017);F=42.939,P<0.05]。见图4。DRG局部注射SNAP5114后120 min,患侧后爪热痛阈值明显上升,持续至注射后24 h;箭头表示注射时间。
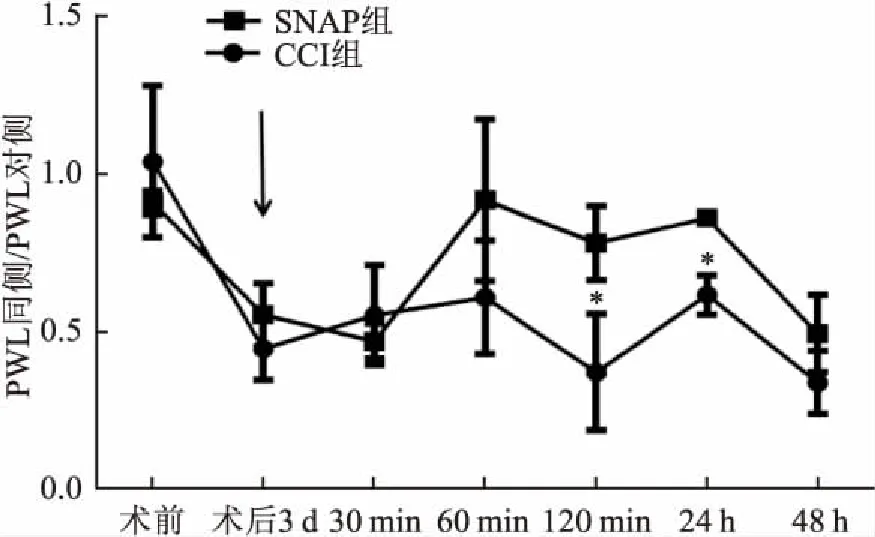
图4 L5 DRG局部注射GAT3抑制剂SNAP5114对大鼠痛阈的影响与CCI组比较:*P<0.05
3 讨论
本研究采用CCI神经痛模型,CCI 损伤后大鼠表现为自发痛(自发抬起损伤肢体,时而舔足、咬足或甩足,避免损伤侧的负重)、痛觉过敏(机械痛敏和热痛敏)[6-9]。本研究中,与Sham组比较,CCI模型组的大鼠在术后1 d热痛阈值明显下降,表现为热痛敏,并持续到术后7 d,说明造模成功。
因为突触间隙中GABA不能被酶分解,所以突触中GABA清除需要GAT的再摄取[10-11],GAT位于神经元和星形胶质细胞的质膜上,这些转运蛋白将胞外GABA转运到细胞内。在中枢神经系统中,与疼痛有关的主要有GAT1和GAT3[10]。先前研究[12]显示用角叉菜胶注射诱发神经痛后,三叉神经脊束核的三叉神经元GAT3表达增加,并认为这种GAT3表达增加减少了脊髓三叉神经元突触内GABA的作用时间,导致GABA作用的减弱,从而引起神经系统致敏。但也有研究[5]报道神经痛动物GAT3表达下降,在紫杉醇诱发的神经痛模型中,脊髓背角星形胶质细胞中GAT3的表达是减少的。还有研究[13-15]表明,GAT3在病理状态下后功能发生改变,出现逆转运,介导了GABA从神经突触末梢向突触内的逆向释放,这种逆向释放代偿了神经损伤后GABA作用的减弱,因此GAT3表达减少会导致神经痛的发生。总之,神经痛动物中GAT3的改变还存在争议。而本研究结果显示,与Sham组比较,术后第3天DRG内GAT3蛋白以及GAT3 mRNA均有所增加,进一步在DRG局部使用GAT3抑制剂后,CCI大鼠的痛阈值明显升高,出现神经痛的症状的缓解。这可能是神经损伤后GAT3的表达增加加速了神经突触中GABA清除,从而使突触中GABA浓度降低,作用时间缩短,GABA能抑制信号减弱,导致机体痛觉过敏,是神经痛的发生机制。本研究只探讨了GAT3量的改变,GAT3的功能是否在神经损伤后发生改变需要进一步的研究证实。
为特异性的研究L5DRG局部GAT3在神经病理性疼痛发生发展中的作用,术前给予大鼠L5DRG局部置管,排除管子脱落、麻醉等因素影响,在术后第3天通过导管将GAT3抑制剂SNAP5114局部注射在DRG附近,减少了SNAP5114吸收入血或入脑脊液产生副作用。结果表明,注射后24 h大鼠的疼痛有所缓解,提示抑制GAT3对大鼠神经病理痛有一定的镇痛作用。但连续测定显示,疼痛缓解的持续时间不长,注射后48 h和对照组痛阈无明显差异,说明L5DRG内GAT3表达的升高可能并非神经痛发病的主要因素,GAT3升高可能是神经痛其他原发病因导致的结果,需要进一步探讨。
综上所述,神经损伤后DRG内GAT3表达明显升高,DRG局部给予GAT3抑制剂可短暂缓解神经痛的症状,L5DRG内GAT3表达升高并非神经痛发病的主要因素。
