PTSD样大鼠记忆损害与海马区JNK3/ERK5差异性表达的相关研究
2019-10-15刘超猛李浩浩王梅子张桂青
刘超猛,李浩浩,王梅子,张桂青
创伤后应激障碍(post-traumatic stress disorder, PTSD)是人们经历创伤性应激事件后延迟出现和持续存在的精神障碍[1],PTSD患者常常伴有记忆损害,可能与其记忆加工过程受阻有关[2]。作为丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号传导通路的重要组成部分,氨基末端激酶(jun N-terminal kinase, JNK)与压力应激反应关系密切,JNK3信号通路可能介导了海马神经元的凋亡进程[3],研究[4]表明,作为MAPK家族的成员,海马区细胞外信号调节激酶5 (extracellular signal-regulated kinase 5, ERK5)的激活对慢性压力下大鼠的记忆损害起保护作用,目前有关PTSD样大鼠记忆损害分子生物学方面的研究较少,该研究借助单次延长应激刺激(single prolonged stress, SPS)建立PTSD样大鼠模型,对其记忆损害表现和不同时间点海马区JNK3/ERK5的差异性表达做初步观察,以进一步探讨PTSD记忆损害的分子生物学机制。
1 材料与方法
1.1 实验动物32只健康清洁级雄性SD大鼠,180~220 g,由新疆疾病控制动物中心[许可证号:SCXK(新)2018-0001]提供,饲养条件:室温(25±1)℃,相对湿度50%~60%,严格12 h/12 h光控时间,通风良好,自由进食、饮水,无噪音环境适应性喂养5 d,实验动物的处理遵守本单位有关开展动物实验研究的规定。
1.2 主要试剂Anti-ERK5兔多克隆抗体、Anti-JNK3兔多克隆抗体(英国abcam公司,货号ab196609、ab126591);β-actin内参抗体、HPR标记羊抗小鼠二抗(武汉博士德生物工程有限公司,货号BM0627、BA1051);HE染色试剂盒(上海碧云天生物技术公司,货号C0105);定量即时聚合酶链反应(qRT-PCR)合成引物(北京擎科生物技术有限公司)。
1.3 模型制备按照随机数字表法将SD大鼠分为2组:Control组8只,PTSD组24只(PTSD2 d组、PTSD5 d组和PTSD8 d组,各8只),借鉴本课题组前期造模方法[5],通过3个步骤建立PTSD动物模型:① 用高强度聚乙烯薄膜将大鼠完全包裹,仅在口鼻处留几个透气孔,2 h后去除薄膜;② 将大鼠放入25 ℃左右游泳箱中,一阵挣扎后大鼠悬停在水面,取出后用毛巾擦干;③ 将大鼠放入99.5%的无水乙醚麻醉箱中,10 s左右大鼠出现呼吸抑制,不能站立,后将其放置通风处。
1.4 模型评估建立PTSD动物模型第2天,依次通过拒缚反射测试、旷场实验和Morris水迷宫实验来评价两组大鼠的恐惧反应、焦虑水平和空间记忆能力。① 拒缚反射测试:实验人员佩戴专业手套抓取大鼠(脊柱和腹部),观察其行为表现(抓取不反抗0分;尖叫或回避1分;尖叫并回避2分;挣脱3分;挣脱并尖叫4分;撕咬行为5分;主动跃起攻击6分);② 旷场实验:箱体(900 mm×900 mm×500 mm)底部设有16个等大方格,旷场上方连接红外摄像仪,记录大鼠5 min内在旷场中的站立与跨格次数;③ Morris水迷宫实验:将大鼠置于平台上熟悉周边环境15 s,随后从非靶象限面壁将其放入池内,若大鼠找到平台则停止实验,时间为60 s,若不能找到,引导大鼠游至水下平台适应10 s,共重复4次,测定平均上台潜伏期。
1.5 海马组织提取与HE染色分别于制备PTSD大鼠模型后第2、5和8天,对PTSD2 d、5 d、8 d和Control组(第8天剥离)大鼠采用3%水合氯醛30 mg/kg行腹腔麻醉,固定大鼠剪开胸腔,从右心耳处剪开放血,随后向大鼠心脏推注30 ml生理盐水灌洗液,同时观察从右心流出的液体是否清亮,后断头取脑,迅速剥离海马组织,两侧海马组织分开,一侧置液氮24 h后于-80 ℃冰箱保存,另一侧经10%甲醛溶液固定、酒精脱水、浸蜡包埋和切片,常规HE染色后光学显微镜下观察Control组和PTSD8 d 组大鼠海马CA1、CA3区及齿状回(dentate gyrus, DG)组织形态变化。
1.6 qRT-PCR检测大鼠海马组织JNK3和ERK5 mRNA表达采用TRIzol法提取总RNA(取样本约100 mg),采用紫外分光光度计测量总RNA的浓度与纯度,当260 nm/280 nm在1.8~2.0范围内时,将总RNA逆转录成cDNA,反应条件:25 ℃,5 min;50 ℃,15 min;85 ℃,5 min;4 ℃,10 min,β-actin上游引物:5′-CACGATGGAGGGGCCGGACTCATC-3′,下游引物:5′-TAAAGACCTCTATGCCAACACAGT-3′;JNK3上游引物:5′-TGAAGAAATTGCAGCCCACC-3′,下游引物:5′-TCTTCGCTGGGTCAATCACT-3′;ERK5上游引物:5′-CTGACGATGAGCCTGATTGC-3′,下游引物:5′-TGGACACACAGGCTCACTAG-3′。将cDNA稀释10倍行PCR检测,反应条件:50 ℃,2 min;95 ℃,10 min;95 ℃,30 s;60 ℃,30 s,40个循环后,借助定量PCR仪(ABI7500)得出每个样本的Ct值,实验组JNK3和ERK5 mRNA 相对于Control组基因表达倍数采用2-ΔΔCt进行数据处理。
1.7 Western blot法检测JNK3和ERK5蛋白表达取海马标本100 mg,用研钵研碎,加400 μl单去污剂裂解液(含PMSF)于匀浆器中进行匀浆,然后置于冰上,裂解30 min后,将裂解液移至1.5 ml离心管中,4 ℃、12 000 r/min离心15 min后,取上清液分装于0.5 ml离心管中,后稀释、孵育,利用OD值测定样本蛋白浓度,煮沸冷却备用;制备5%的浓缩胶和12%的分离胶,上样电泳,电泳结束,将蛋白转膜至 PVDF 膜上,用5% 脱脂牛奶封闭2 h,孵一抗,洗膜孵二抗(HPR标记羊抗小鼠,稀释比例为1 ∶50 000)2 h,曝光显色,用BandScan软件得出胶片灰度值。
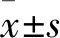
2 结果
2.1 拒缚反射评分比较与Control组比较,PTSD组大鼠拒缚反射评分升高,差异有统计学意义(P<0.05)。见表1。

表1 Control组和PTSD组大鼠拒缚反射评分、 站立次数、跨格次数和上台潜伏期的比较
P25表示第1四分位数,P50表示第2四分位数,P75表示第3四分位数
2.2 旷场实验站立与跨格次数比较与Control组比较,PTSD组大鼠站立次数与跨格次数均减少,差异有统计学意义(P<0.05)。见表1。
2.3 水迷宫定位航行能力比较在Morris水迷宫中行定位航行测试时,Control组大鼠经过短暂的调整,很快就能找到隐藏在水下20 mm的平台,典型航行轨迹见图1A;PTSD组大鼠更多的是围绕着迷宫内壁打转,见图1B;与Control组比较,PTSD组大鼠平均上台潜伏期延长,差异有统计学意义(P<0.05),见表1。

图1 Control组和PTSD组大鼠在水迷宫中航行示意图A: Control组; B:PTSD组
2.4 海马组织HE染色结果与Control组大鼠海马组织CA1区和CA3区比较,PTSD8 d组CA1区和CA3区海马神经元排列紊乱,结构异常,染色不均,且胞核和胞质界限较模糊,见图2A、2B、2D、2E;与Control组大鼠海马组织DG区相比,PTSD8 d组DG区海马神经元排列紊乱,结构异常,神经元数量大量减少,胞核和胞质界限模糊,见图2C、2F。
2.5 大鼠海马组织JNK3/ERK5 mRNA水平表达4组大鼠海马组织JNK3/ERK5 mRNA 水平表达存在差异(F=7.42,P<0.05;F=16.33,P<0.05)。与Control组(0.123±0.016)相比,PTSD2 d组(0.212±0.056)、PTSD5 d组(0.188±0.033)大鼠海马组织JNK3 mRNA表达升高,差异有统计学意义(P<0.05),PTSD8 d组(0.134±0.025)与Control组相比,JNK3 mRNA表达差异无统计学意义(P>0.05),PTSD2 d、5 d和8 d组JNK3 mRNA表达量呈下降趋势,各组间差异均有统计学意义(P<0.05);与Control组(0.135±0.033)比较,PTSD2 d组(0.204±0.048)、PTSD5 d组(0.290±0.045)和PTSD8 d组(0.377±0.059)大鼠海马组织ERK5 mRNA的表达升高,且依次增多,各组间差异均有统计学意义(P<0.05)。
2.6 大鼠海马组织JNK3/ERK5蛋白水平表达Western blot实验结果表明, PTSD2 d组、PTSD5 d组JNK3蛋白表达较Control组升高,差异有统计学意义(P<0.05),PTSD8 d组与Control组相比,JNK3 蛋白表达差异无统计学意义(P>0.05);PTSD2 d、5 d和8 d组ERK5蛋白表达较Control组升高,差异有统计学意义(P<0.05)。见图3。
3 讨论
PTSD的一个重要特征在于其对学习记忆能力的破坏,学习记忆能力受损又加重了其恐惧和焦虑样表现[6]。在本次研究中,与Control组大鼠比较,PTSD组大鼠拒缚反射评分增高,表明其恐惧反应明显;在旷场实验中的站立和跨格次数减少,表明其自主探索欲望减退,意志活动减弱,情绪唤醒水平降低,而情绪唤醒水平的高低与记忆的效果密切相关[7];在Morris水迷宫中平均上台潜伏期延长,表明其空间记忆能力减退;HE染色后PTSD组大鼠海马组织CA1、CA3和DG区神经元排列紊乱,结构异常,特别是DG区,神经元数量大量减少,表明经历复合应激后,PTSD大鼠海马神经元排列已经偏离了其独特的高度有序的板层构筑结构。本研究通过束缚、强制游泳和乙醚麻醉等方式成功制备了具有恐惧、焦虑等情绪记忆和空间记忆能力受损类似临床上PTSD患者核心症状的大鼠模型,达到了以往课题组有关PTSD大鼠模型制备标准[5]。
图2 大鼠海马组织HE染色情况 ×400
A~C:分别为Control组大鼠海马组织CA1、CA3和DG区示意图;D~F:分别为PTSD8 d 组大鼠海马组织CA1、CA3和DG区示意图
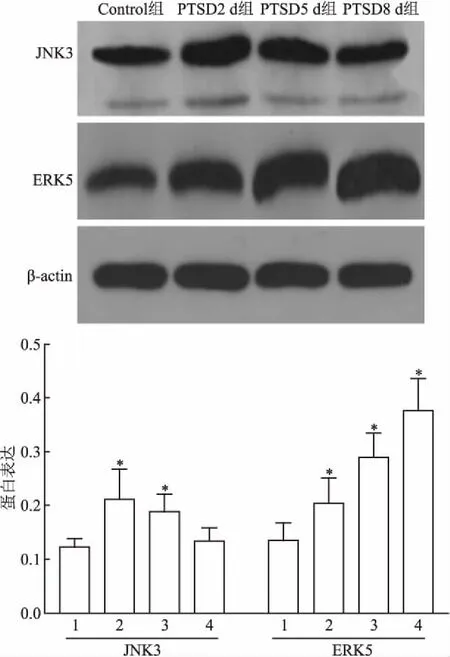
图3 大鼠海马组织 JNK3和ERK5的表达
1:Control组;2:PTSD2 d组;3:PTSD5 d组;4:PTSD8 d组;与Control组比较:*P<0.05
海马体是学习与记忆的枢纽,主要负责长时程记忆的存储与转换。学习记忆又与神经系统蛋白质受体、神经递质代谢水平密切相关[8],JNK信号通路,由JNK1、JNK2和JNK3组成,而JNK3仅在中枢神经系统特异性表达,激活后的JNK借助Bcl-2、Caspase-3等信号通路介导神经细胞的凋亡进程[9],Kuan et al[10]研究表明,抑制JNK3基因的活化转录能有效提高神经细胞的生存率。本次研究观察了建立PTSD模型后大鼠1周内3个时间点海马组织中JNK3 mRNA及蛋白的动态变化,相比于Control组,PTSD2 d 组和5 d 组JNK3 mRNA及蛋白表达均升高,这与田和平 等[11]研究结果类似,可能是创伤早期大鼠海马区JNK3的大量表达介导了神经细胞的损伤和凋亡过程;值得注意的是,从PTSD第2、5和8天整个时间轴来看,JNK3 mRNA及蛋白表达呈现了一个增多渐缓的趋势,与Control组比较,PTSD8 d组大鼠海马组织JNK3 mRNA及蛋白的表达差异已无统计学意义,可能是海马区神经细胞的大量损伤与凋亡激活了大鼠相关脑区的神经保护通路,减少了JNK3 mRNA及蛋白的表达。
Su et al[12]研究表明,ERK5可通过调控过氧化氢和神经生长因子的表达来介导神经细胞的“预处理”保护机制,Akyol et al[13]研究显示,ERK5可通过激活原肌球蛋白受体激酶C(TRKC)来介导神经营养因子3(NT-3)对脑损伤大鼠神经功能的改善作用,以上均说明ERK5在神经系统损伤进程中起介导保护作用。在本次研究中,相比于Control组,PTSD2 d、5 d和8 d 组大鼠海马组织ERK5 mRNA及蛋白表达水平逐步升高,而神经细胞凋亡介导因子JNK3的表达逐渐减少,故ERK5可能是通过抑制JNK3的表达来发挥神经细胞损伤保护作用的。
由于雌鼠在其性周期内激素水平变化会对JNK3/ERK5的表达产生影响,所以本研究全部选用雄性SD大鼠,但限于条件,未能观察到JNK3与ERK5在各自上下游调控通路中是如何发挥作用的,较小的样本量可能对研究结论也有一定影响,这也为下一步的研究提供了方向。
