Marc-145细胞微载体模化培养PRRSV
2019-10-15刘鑫莹
赵 刚,闫 冰,刘鑫莹
(哈药集团生物疫苗有限公司,哈尔滨 150000)
猪繁殖与呼吸综合征病毒(PRRSV)主要侵害繁殖母猪和仔猪,引起母猪繁殖障碍、仔猪的呼吸道疾病和较高的死亡率。PRRS 的暴发蔓延,给世界各国养猪业造成巨大的经济损失,在中国每年有200 万头猪感染,近40 万头猪死亡。目前尚无针对该病的有效治疗药物,开发高效、安全、廉价的病毒疫苗是预防、控制PRRSV 感染的唯一可行办法。目前国内Marc-145 细胞制备猪繁殖与呼吸系统综合征病毒均采用转瓶生产工艺,由于受到转瓶表面积和培养条件的限制,生产细胞密度低,劳动强度大,操作过程易污染,疫苗质量难以得到保证。本研究采用细胞生物反应器技术生产PRRSV 抗原,并对培养过程中的各项技术条件进行优化,从而总结出一套较为合理的生产工艺,为PRRSV的大规模培养提供可靠的参考数据。
1 试验材料
1.1 细胞及病毒
Marc-145 细胞(购自中国兽医药品监察所),PRRSV HuN4-F112株(购自中国兽医药品监察所)。
1.2 主要试剂
MEM 培养基(购自GIBCO 公司);新生牛血清(购自济南劲牛生物科技有限公司);微载体Cytodex-1(购自德国GE 公司);胰蛋白酶(购自美国Sigma 公司);结晶紫细胞裂解液(哈药集团生物疫苗有限公司研发中心配制)。
2 试验方法
2.1 Marc-145细胞复苏培养
将细胞冻存管自液氮罐中取出,置于37 ℃水浴,使管内冻存液迅速融化。常温1 000 r·min-1离心5 min。弃去上清,用少量细胞生长液将细胞重悬后移入细胞培养瓶中,加入10 mL 细胞生长液,于37 ℃、5%CO2培养箱中静置培养。待细胞长成单层后,用胰酶-EDTA 消化液消化,并按1:3进行扩增培养。
2.2 PRRSV在Marc-145细胞上的增值
Marc-145 细胞是PRRSV 的敏感细胞,病毒液不用激活。取已长成致密单层的细胞,弃掉其中的生长液,用不含血清的DMEM 洗细胞面3 次。吸净残余的维持液,加入PRRSV 病毒液0.2 mL,37 ℃吸附60 min,其间摇晃1 次·20 min-1,使病毒均匀、充分地吸附到细胞上。加入10 mL 的维持液,于37 ℃、5%CO2培养箱中培养,观察细胞病变,当80%的细胞出现病变时收获病毒。将收获的病毒液于-20~37 ℃反复冻融3 次,保存于-80℃冰箱。
2.3 微载体预处理
称取所需质量的微载体Cytodex-1,按100 mL:1 g 的比例用PBS 浸泡微载体,轻微搅拌使微载体均匀浸泡3 h,121 ℃、灭菌30 min;倒掉PBS,以30 mL:1 g 的比例用培养基将微载体洗涤2 次,将微载体放置在4 ℃冰箱内平衡过夜,待用。
2.4 微载体细胞计数
取1 mL 含微载体的培养液,900 r·min-1离心5 min,后弃掉上清液,加入与上清液相同体积的0.1%结晶紫溶液,混匀后于37 ℃中孵育1 h,然后用血球计数板计数释放出来的细胞核,即为1 mL培养液中的细胞数。
2.5 病毒含量测定
将病毒液作连续10倍稀释,取1×10-4、1×10-5、1×10-6、1×10-7和1×10-85 个稀释度,分别接种已长成良好单层Marc-145 细胞、弃去细胞培养液的96孔细胞板中,每个稀释度接种6 孔,100 μL·孔-1,同时设正常细胞对照,于37 ℃、5% CO2培养箱中培养5 d,逐日观察细胞病变情况,并记录细胞病变的孔数,按Reed-Muench法计算TCID50。
2.6 微载体培养PRRSV试验条件的优化
2.6.1 病毒维持液中血清浓度的确定
以4.0×105cells·mL-1的密度接种Marc-145 细胞,微载体Cytodex-1 的用量为4 g·L-1,待细胞培养72 h后,停止搅拌,静置使微载体沉淀,吸出上清液,用DMEM 洗涤3 次,按感染复数为0.1 的量加入PRRSV 病毒液,然后分别加入血清浓度为1%、2%、3%的病毒维持液,于不同时间取样测定病毒含量。确定病毒维持液中血清浓度。
2.6.2 病毒接毒时间的确定
以4×105cells·mL-1的密度接种细胞,微载体Cytodex-1 的用量为4 g·L-1,分别在细胞培养24、48 和72 h 后,停止搅拌,静置使微载体沉淀,吸出上清液,用DMEM 洗涤3 次,按感染复数为0.1的量加入PRRSV 病毒液,最后加入血清浓度为2%的病毒维持液,于不同时间取样测定病毒含量。确定最适的接毒时间。
2.6.3 感染复数(MOI)及最佳收获时间的确定
以4×105cells·mL-1的密度接种细胞,微载体Cytodex-1 的用量为4 g·L-1,细胞培养72 h 后,停止搅拌,静置后吸出上清液,用DMEM 洗涤3 次,分别按感染复数为0.20、0.05 和0.01 的量加入PRRSV,最后加入血清含量为2%的病毒维持液,于不同时间取样测定病毒含量。确定感染复数及最适收毒时间。
2.7 转瓶培养Marc145细胞增殖PRRSV
将Marc145 细胞扩大培养,增殖至10 L 转瓶中,培养72 h 后,细胞汇合度>90%,按每个转瓶细胞数为2.6×108个·mL-1、MOI 为0.05 进行PRRSV接种培养。病毒接种后48 h收获,并进行病毒含量的测定。
3 结果与分析
3.1 PRRSV在Marc-145细胞上的增殖
PRRSV感染Marc-145细胞见图1。
由图1 可知,正常的Marc-145 细胞于传代后3 d 即可长成致密单层,透光性好、立体感强、界限清晰;接种PRRSV 后12 h,出现细胞病变,细胞界限模糊、透光性变差、细胞融合拉网、圆缩脱落。
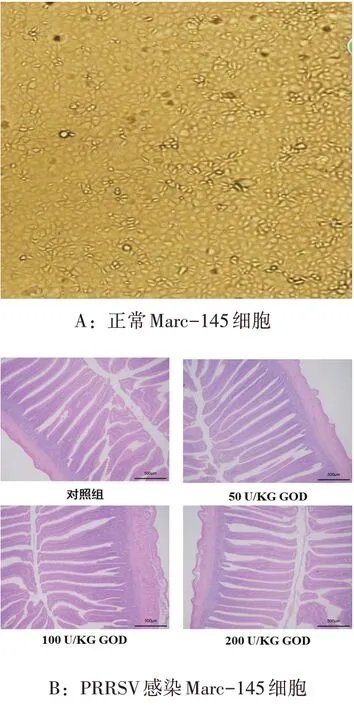
图1 PRRSV感染Marc-145细胞
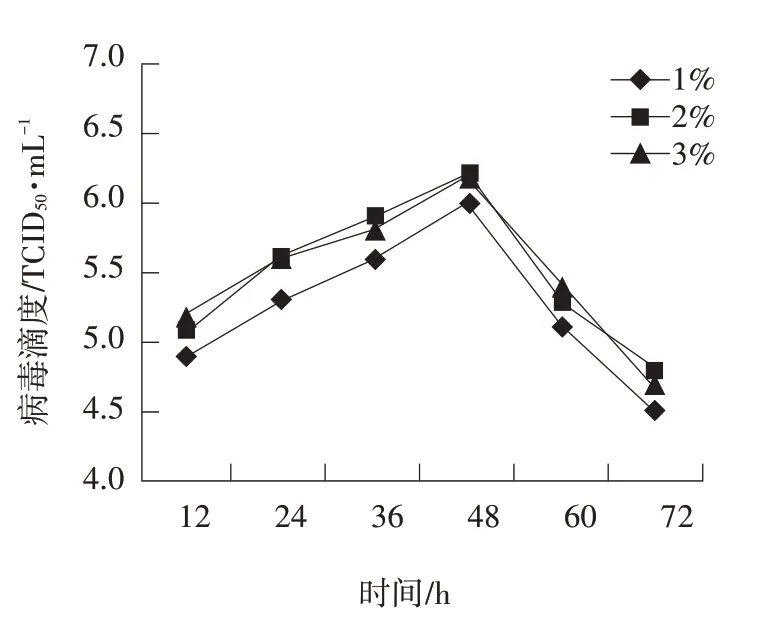
图2 维持液中血清浓度对病毒增殖的影响
3.2 病毒维持液中血清浓度的确定
当病毒维持液中血清浓度分别为1%、2%、3%时,于不同时间取样测定病毒含量结果见图2。
由图2 可知,用血清浓度为1%的病毒维持液培养时病毒滴度较低;维持液血清浓度为2%、3%,对病毒滴度影响不明显,病毒滴度均较高。综合考虑本试验维持液中血清浓度采用2%。
3.3 接毒时间的确定
分别在细胞培养24、48、72 h 后接毒,于不同时间取样测定病毒含量结果见图3。
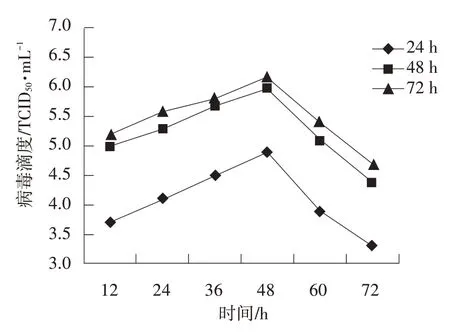
图3 感染时间对病毒增殖的影响
由图3 可知,在细胞培养24 h 时细胞贴球率为40%,病毒滴度最低;在细胞生长最高峰72 h 时,细胞贴球率>90%,接毒后病毒滴度最高为106.2TCID50·mL-1。由此可见PRRSV 增殖的效果与接毒时的细胞生长情况有关,接毒时细胞数量愈大,病毒滴度愈高,反之则较低。
3.4 感染复数(MOI)和收毒时间的确定
不同感染复数对PRRSV 增殖的影响结果见图4。
图4 感染复数对病毒增殖的影响
由图4 可知,过高或过低的感染复数(0.50 和0.01)均导致较低的病毒滴度,说明接毒剂量直接影响病毒的增殖效率。感染复数为0.05 时可获得最高的PRRSV 增殖效价,达到106.4TCID50·mL-1。此外各组试验结果均显示,接毒后48 h 的病毒效价均高于接毒后72 h的病毒效价,说明接毒后48 h可以作为收获病毒的最适时间。
3.5 不同培养系统中病毒含量的比较
试验结果可知,反应器生产病毒含量为106.6TCID50·mL-1、转瓶生产病毒含量为106.3TCID50·mL-1。表明用反应器生产病毒毒价比转瓶高。
4 讨论
病毒维持液中血清浓度的比较试验表明,使用维持液中血清含量1%不利于细胞的生长和繁殖,因此收获的病毒滴度也较低;血清含量2%、3%的对细胞生长最为有利,获得的毒价较高,但毒价差别不大。血清浓度也不能过高,血清浓度过高血清掩蔽了病毒与细胞的结合位点,导致病毒与细胞结合受阻,从而影响病毒的增殖。本试验选择最适的血清浓度为2%,因为此浓度下即保证细胞生长繁殖所需的营养,利于病毒毒价的提高,又可降低成本。
接毒时间过早,细胞处于生长早期,细胞数量较少,产生的病毒滴度也较少;如果接毒过晚,微载体上细胞数减少,细胞处于衰老阶段,同样影响病毒的增殖。在细胞生长到72 h时细胞数达到最大,接毒时产生的病毒含量最高。由此可见PRRSV增殖的效果与接毒时的细胞生长情况有关,接毒时细胞数量愈大,病毒滴度愈高,反之则较低。
感染复数(MOI)即单个细胞感染病毒的颗粒数,由此可确定接种病毒的剂量。MOI值可通过测定病毒感染性滴度和接种细胞的个数获得。本研究以不同MOI 感染Marc-145 细胞,分析其对病毒滴度的影响。本研究中0.05 的感染复数最为匹配PRRSV 感染及增殖过程的要求,试验结果表明,过高或过低的接毒量均不利于PRRSV 的增殖,其具体内在机理可能与Marc-145 细胞上PRRSV 的受体蛋白质表达丰度存在显著相关,有待深入研究。
试验研究了反应器、转瓶不同培养系统生产PRRSV。结果表明,用转瓶与反应器生产病毒毒价相近,病毒含量分别为106.7和106.3TCID50·mL-1。由于本文所研究的工艺是要适合于大规模工业生产,因此必须从操作的便利、成本以及最终效果来确定。
