PCV2感染的血管内皮细胞RIG-I样信号通路的变化
2019-10-14刘士瑜谷可伟李焕荣
刘士瑜,谷可伟,王 莹,何 乐,李焕荣
(北京农学院动物科学技术学院,北京,102206)
断奶仔猪多系统衰竭征(PMWS)的主要病原是猪圆环病毒2型(PCV2),该病以淋巴细胞衰竭、炎性细胞浸润为特征[1],抑制机体的免疫功能,导致其他细菌或病毒的继发感染[2]。研究表明除PCV2对免疫系统造成影响外,内皮细胞的功能及血管系统的紊乱也是造成PCVD的主要原因[3]。血管内皮细胞可通过调节白细胞运输、炎性因子产生和与MHCⅡ分子相关的抗原递呈,使其在宿主免疫应答中发挥重要作用,而这些功能的发挥需要内皮细胞信号通路的精准调控[4]。PCV2感染猪血管内皮细胞后会造成IL-8、IL-6和黏附分子(ICAM-1)等表达异常,导致内皮细胞免疫调节功能异常[5-6]。然而,PCV2感染血管内皮细胞后,其模式识别受体通路的变化及调控这些因子产生的机理目前尚未有研究。
本研究拟通过PCV2感染猪髋动脉内皮细胞(PIEC),利用基因芯片技术筛选与模式识别受体通路相关的差异基因,并利用荧光定量PCR及Western Blot检测关键蛋白,以期阐述PCV2感染内皮细胞后参与免疫模式受体识别的信号通路,为该病的发生发展提供基础数据。
1 材料与方法
1.1 材料与试剂
猪髋动脉内皮细胞系(PIEC),购自上海生命科学研究院细胞资源中心,目录号GN015。PCV2病毒株PCV2-SD/2008(GQ174519),经PK-15细胞系传代3次获得病毒液,TCID50为10-5.5/mL,由北京农学院动物科学技术学院动物疫病研究实验室鉴定与保存。
RPMI 1640培养基购自GIBICO公司;胎牛血清(FBS)购自Biological公司;TRIzol LS Reagent购自Invitrogen公司;Poly(I:C)购自InvivoGen公司;鼠抗人RIG-I、兔抗人MAVS、鼠抗猪β-actin、山羊抗鼠IgG、山羊抗兔IgG均购自Cell Signaling Technology公司;兔抗人MDA-5抗体购自AVIVA公司;RNA提取试剂盒、反转录试剂盒、Ultra SYBR Mixture购自江苏康为世纪有限公司;细胞总蛋白提取试剂盒、BCA蛋白定量试剂盒购自凯基生物有限公司;基因芯片为Agilent猪全基因4*44K芯片(design ID:026440)。
1.2 试验方法
1.2.1 PCV2感染PIEC 将对数生长期的PIEC以5×105接种到6孔板,待细胞长到70%左右时,用PCV2(MOI=0.5)病毒液感染1 h,同时设RPMI 1640阴性对照组,在37 ℃、5%的CO2培养箱中吸附1 h,弃去病毒液,用PBS洗涤3次,每孔加入2 mL含10%胎牛血清的RPMI 1640继续培养,以备后用。
1.2.2 Poly(I:C)刺激PIEC 过程与方法1.2.1相似,待细胞长到70%左右时,用Poly(I:C)(5 μg/mL)刺激PIEC 1 h,弃去上清,用含10%胎牛血清的RPMI 1640继续培养,用于后续检测。
1.2.3 Trizol裂解细胞及总RNA提取 病毒感染后12 h和24 h分别收集不同处理的细胞样品。每孔弃去上清,用PBS清洗3次,Trizol裂解、静置并转移至离心管中。按照RNA提取试剂盒说明书提取细胞总RNA,用电泳检测RNA。
1.2.4 基因芯片检测 在细胞感染24 h后收样进行检测。主要根据Agilent表达谱芯片配套试剂盒的操作过程对样品进行放大和标记、纯化、芯片杂交、洗片及扫描等。读取数据,进行归一化处理。用DAVID软件对差异蛋白进行分析。
1.2.5 反转录及荧光定量PCR 按照反转录试剂盒说明书,对提取的RNA反转录合成cDNA,用于荧光定量PCR检测。荧光定量PCR反应按照说明书进行,反应体系如下:2×Ultra SYBR Mixture 10 μL,ddH2O 7 μL,上游、下游引物各0.5 μL,模板2 μL;反应条件:95 ℃ 5 min,95 ℃ 20 s,退火温度,30 s,72 ℃ 30 s,共40个循环。95 ℃ 1 min,70 ℃ 30 s,95 ℃ 30 s,在70~95 ℃全程读板收集荧光信号。基因相关表达的分析按照2-△△t进行。各引物序列见表1。

表1 荧光定量PCR的引物序列Tab.1 Primer sequences used for fluorescence quantification PCR
1.2.6 细胞总蛋白提取及BCA法蛋白定量 细胞处理24 h,收集细胞样品。弃去上清,按照全蛋白提取试剂盒操作步骤进行,取少许用于蛋白定量,其余全蛋白提取物分装保存于-80 ℃。蛋白定量主要依照BCA法蛋白定量试剂盒说明书进行,绘制标准曲线,计算样品中的蛋白。
1.2.7 Western Blot试验 将提取的蛋白进行SDS-PAGE电泳,电泳后蛋白转移至PVDF膜上,时间90 min;用5%BSA封闭2 h;加入一抗(1∶2000)室温孵育2 h;TBST洗涤4次,每次10 min;二抗(1∶5000)孵育1 h,洗涤4次;最后使用Omega aplegen扫膜(Aplegen),ACTIN为内参。
1.2.8 数据处理与分析 所有的试验均独立重复3次,以平均值±标准差的形式表示。采用SPSS(19.0)单因素方差分析不同样品表达量之间的差异性,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 样品RNA质检分析
根据表2所示,所有样品RNA A260/A280比值均在1.90~2.0之间,且28S/18S>0.7,说明提取的RNA并未发生降解,达到基因芯片检测的要求。
2.2 基因芯片分析PCV2感染内皮细胞后模式识别受体信号通路的变化
基因芯片检测显示,共有2 470个基因相对比值在二倍差异以上(P<0.05)。通过基因本体分析(GO分析)和Pathway分析,可见与模式识别受体相关的差异基因通路有13个,其中12个上调基因,1个下调基因。这些基因主要包括RIG-I样信号通路受体(DDX58、IFIH1)、Toll样受体TLR1、MAPK信号通路相关基因(MAPK8、JNK、Fos)以及细胞趋化因子(IL-8、CCL2、CCL5)等(表3)。而涉及最多的是RIG-I样信号通路和Toll样受体信号通路,鉴于TLR1为显著下调且TLR1不识别病毒,DDX58(RIG-I)以及IFIH1(MDA-5)均显著上调,推测参与PCV2感染内皮细胞过程中识别病毒的信号通路可能为RIG-I样信号通路。
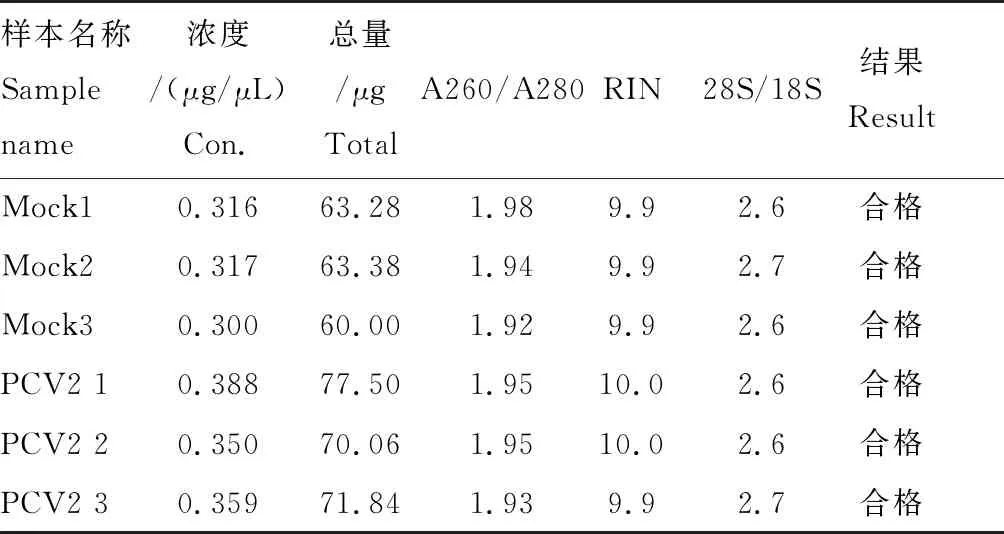
表2 RNA质检结果Tab.2 The results of RNA quality
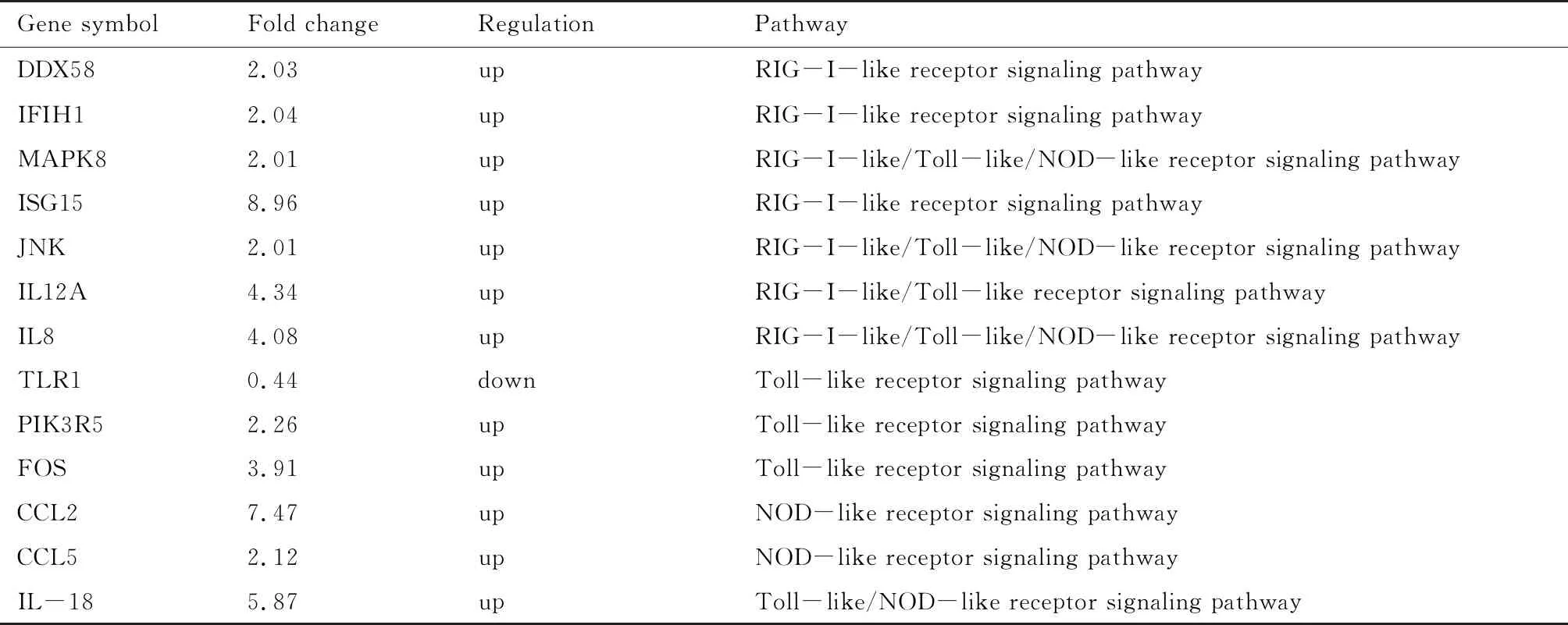
表3 与模式识别受体有关的信号通路Tab.3 Signaling pathways related to pattern recognition receptors
2.3 PCV2感染内皮细胞后RIG-I样信号通路关键蛋白mRNA的变化
PCV2感染12 h和24 h后,PIEC mRNA的检测结果见图1。与未感染组相比,两个时间点感染组RIG-I mRNA的表达水平显著升高,而24 h的上调幅度明显大于12 h;MDA-5和接头蛋白MAVS表现相似的趋势。而Poly(I:C)阳性对照组的结果与PCV2感染组的结果相同。
2.4 PCV2感染内皮细胞后RIG-I样信号通路关键蛋白的表达变化
为了进一步证明试验准确性,利用Western Blot方法对处理24 h后的细胞样品进行检测。由图2可知,与未感染组相比,感染组中RIG-I、MDA-5及MAVS三种蛋白的表达量显著增加,Poly(I:C)阳性对照组中三种蛋白的表达量明显高于未感染组。该结果与芯片及mRNA水平的变化一致。
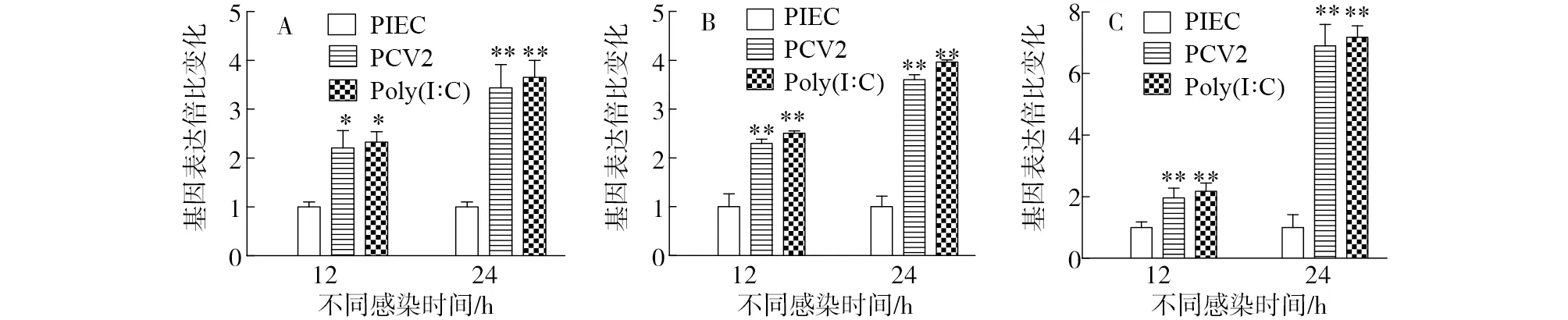
注:A是RIG-1,B是MDA-5,C是MAVS;*代表差异显著P<0.05,**代表差异极显著P<0.01。Note: A is RIG-1, B is MDA-5, C is MAVS; *means P<0.05, **means P<0.01.图1 RIG-I样信号通路中关键蛋白的基因变化Fig.1 Changes in gene levels of key proteins in RIG-I-like signaling pathway
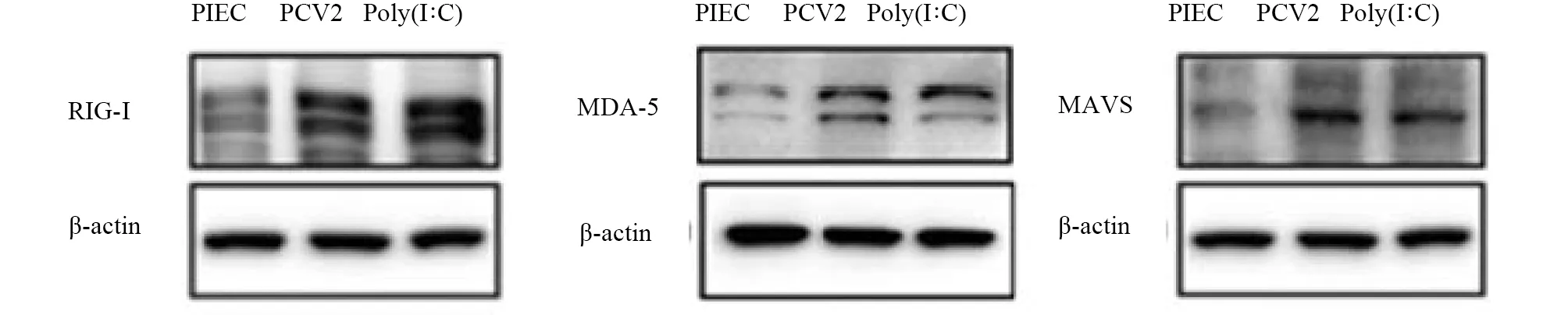
图2 RIG-I样信号通路中关键蛋白的表达情况Fig.2 Expression of key proteins in RIG-I-like signaling pathway
3 讨 论
PCV2的广泛流行给养猪业带来巨大的经济损失。然而,该病的致病机制目前尚不完全清楚。血管内皮细胞作为PCV2的靶细胞,在PCV2感染过程中发挥重要的免疫调节功能[5],但具体的模式识别机制至今尚无报道。本研究结果显示PCV2感染可激活PIEC中RIG-I样信号通路,从而影响感染内皮细胞功能的变化。
维甲酸诱导基因I样受体(RLRs)是模式识别受体的一种,该受体主要在抗病毒反应中发挥作用,它们能够直接或间接识别进入细胞内的病原微生物及其产物,诱导Ⅰ型干扰素(IFNα/β)的产生、炎症因子的活化和促炎症因子及趋化因子的表达。它包括三种蛋白:维甲酸诱导基因I(RIG-I)、黑色素瘤分化相关基因5(MDA5)、遗传学及生理学实验室蛋白2(LGP2)等分子[7],其中RIG-I和MDA5是细胞内主要的抗病毒蛋白。尽管两者具有相似的信号特征及结构同源性,但是却识别不同类型的病毒[8-9]。RIG-I主要识别含5′ppp的RNA病毒,如黄病毒[10]、狂犬病毒[11]等;MDA-5主要识别正链ssRNA病毒,如鼠肝炎病毒[12]等。也有一些病毒可以同时被RIG-I和MDA5识别,如麻疹病毒[13]、西尼罗河病毒[14]等。此外,以AT-rich DNA为模板经RNA聚合酶Ⅲ转录的5′ppp双链RNA也可被RIG-I识别[15-16]。有研究显示在VR1BL细胞和PK-15细胞中RIG-1和MDA-5能够识别PCV2,并诱导干扰素(IFNβ)的产生[17-18]。本研究基因芯片检测发现PCV2感染PIEC后,RIG-I样信号通路中的相关基因差异变化明显,RIG-I和MDA-5两个受体均显著上调;荧光定量PCR和Western Blot检测显示病毒感染组的RIG-1和MDA-5基因和蛋白水平均显著上调,说明PCV2感染内皮细胞后能够被RIG-1和MDA-5识别,影响相关因子表达而导致PCV2感染的PIEC相关功能的变化。
而位于胞质中的RIG-I和MDA5监测到病毒成分后,CARDs从信号抑制状态释放出来,并通过CARD-CARD的方式招募其下游接头蛋白MAVS(也称为IPS-1、CARDIF和VISA)[19-21]。只有MAVS被激活才能有效激活下游信号通路,诱导干扰素和促炎因子的产生[22-23]。本研究中MAVS检测结果显示,PCV2感染后PIEC中MAVS的mRNA及蛋白水平均显著升高,说明PCV2感染内皮细胞后MAVS被成功激活。至于该信号通路的激活是否与引起内皮细胞功能变化的相关因子异常表达有关需要进一步的研究。
