一例鸡源致病型大肠杆菌的分离鉴定
2019-10-14朱庆贺李文超杨旭东王观悦史同瑞
朱庆贺,王 爽,李文超,陈 曦,杨旭东,王观悦,李 丹,史同瑞*
(1.黑龙江省农业科学院畜牧兽医分院,黑龙江齐齐哈尔161005;2.方正县畜牧局,哈尔滨150800)
大肠杆菌病是由致病性大肠杆菌(Escherichiacoli)引起的各种急性或慢性疾病的总称。不同品种及日龄的鸡均可感染,尤其2~3周龄雏鸡发病严重,病鸡表现精神沉郁,腹泻,关节有肿胀,气囊炎等症状[1]。该病的发病率和死亡率高,暴发频繁,严重影响养鸡业的发展。因此,集约化鸡群养殖中常常使用抗生素来预防大肠杆菌病的发生[2],抗生素的大量不合理使用导致耐药菌株的产生,为大肠杆菌病的防治增加了难度。本研究自集约化养殖场的蛋鸡中分离鉴定了一株致病型大肠杆菌,同时通过药敏试验对分离菌株进行了敏感药物筛选,以期为鸡场大肠杆菌病的抗生素治疗提供药物指导,避免无效抗生素的滥用。
1 材料与方法
1.1 材料
1.1.1 病料 采集自黑龙江省拉哈镇某蛋鸡养殖场6月龄蛋鸡,濒死鸡表现精神沉郁,腿部关节肿胀,排黄白色稀粪。死亡鸡剖检可见明显的心脏纤维素沉积、包心包肝症状。
1.1.2 试剂与仪器 葡萄糖、乳糖、蔗糖、麦芽糖、甘露醇、尿素酶、吲哚、VP、MR、麦康凯、伊红美蓝琼脂培养基等生化试剂,购自青岛海博生物技术有限公司;药敏片购自杭州滨和微生物试剂有限公司;Veriti96孔PCR仪购自美国Life ABI公司。
1.1.3 试验动物 2周龄雌性SPF雏鸡10只,购自哈尔滨维科生物制品有限公司。
1.2 方法
1.2.1 病原分离培养 无菌条件下取病死蛋鸡的肝脏、脾脏,接种于营养琼脂、麦康凯和伊红美兰琼脂平板上,37 ℃ 条件下培养 24 h,再挑取菌落形态特征明显的单菌落,划线传代培养,纯化3代后观察单菌落细菌菌落形态,并挑取单菌落进行革兰氏染色,显微镜观察细菌形态。单个典型菌落接种普通肉汤增殖培养。
1.2.2 分离菌株生化试验 通过糖发酵试验、尿素酶试验、VP 试验、MR 试验、吲哚试验进行分离菌株生化特性检测。
1.2.3 分离菌株的PCR扩增和测序 以增殖的菌液为模板,用细菌 16S rDNA 的通用引物(表1)进行 PCR 扩增。PCR 扩增体系为:模板 0.5 μL,上、下游引物各1 μL,Premix 12.5 μL,ddH2O 10 μL。PCR 扩增程序为:94 ℃预变性 5 min;94 ℃变性 1 min,55 ℃退火 1 min,72 ℃延伸 90 s,30 个循环;72 ℃终延伸 10 min。扩增产物用1%琼脂糖凝胶电泳检测。

表1 引物序列Table 1 Primer sequence
1.2.4 分离菌株的同源性分析 将分离菌株的16S rDNA测序结果提交到GenBank中进行同源性比对,确定分离菌株的种属。
1.2.5 动物致病性试验 SPF雏鸡致病性试验:取SPF雏鸡10 只,随机分成 2 组,每组 5 只,试验组分别用分离纯化细菌肉汤进行颈部皮下注射,每只雏鸡接种上述细菌 0.5 mL (大肠杆菌浓度为3.0 × 109CFU/mL),对照组每只接种生理盐水0.5 mL,观察细菌致病性情况,雏鸡死亡后剖检,对死亡雏鸡心脏、肝脏组织涂片染色镜检。
1.2.6 药敏试验 将稀释好的菌液每个平板接种0.1 mL,用灭菌玻璃棒涂匀整个平板表面,用无菌镊子取10种药敏纸片贴于平板上,每个平板贴5张纸片,相隔不少于 3 cm,将上述平板置于37 ℃温箱内培养,24 h 后观察结果并测量各纸片周围抑菌圈直径(mm),参照EUCAST欧盟药敏试验(2016)标准[3]进行结果判定。
2 结果与分析
2.1 培养特性 麦康凯培养基上菌落呈现小粉红色;伊红美兰琼脂培养基上菌落呈现黑色带金属光泽、边缘整齐、光滑湿润形态;在普通琼脂培养基上呈灰白色、圆形、整齐、隆起的菌落。
2.2 染色镜检 分离菌株革兰氏染色为阴性小杆菌,两端钝圆,与大肠杆菌染色特性相符。
2.3 生化试验鉴定 分离菌株能发酵乳糖,发酵葡萄糖产酸产气,发酵麦芽糖、甘露醇,吲哚试验为阳性,VP 试验为阴性,尿素酶阴性,MR试验阳性,与大肠杆菌生化特性相符(表2)。
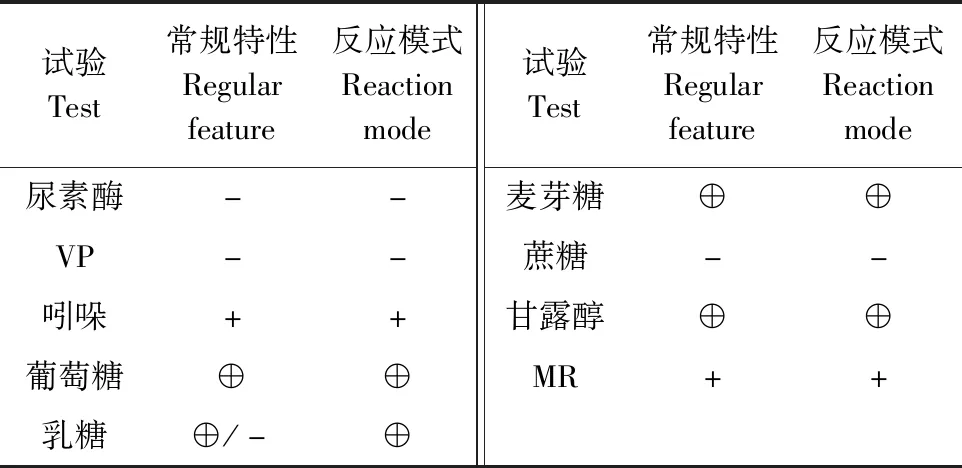
表2 生化试验结果Table 2 Results of biochemical test
“+”表示阳性,“-”表示阴性,“⨁”表示产酸产气
" +" means positive," -" means negative," ⨁" means acid producing gas
2.4 PCR鉴定 分离菌进行16S rDNA扩增,得到大小为1457 bp的目的片段(图1),与预期大小一致,目的片段送吉林库美生物有限公司测序。
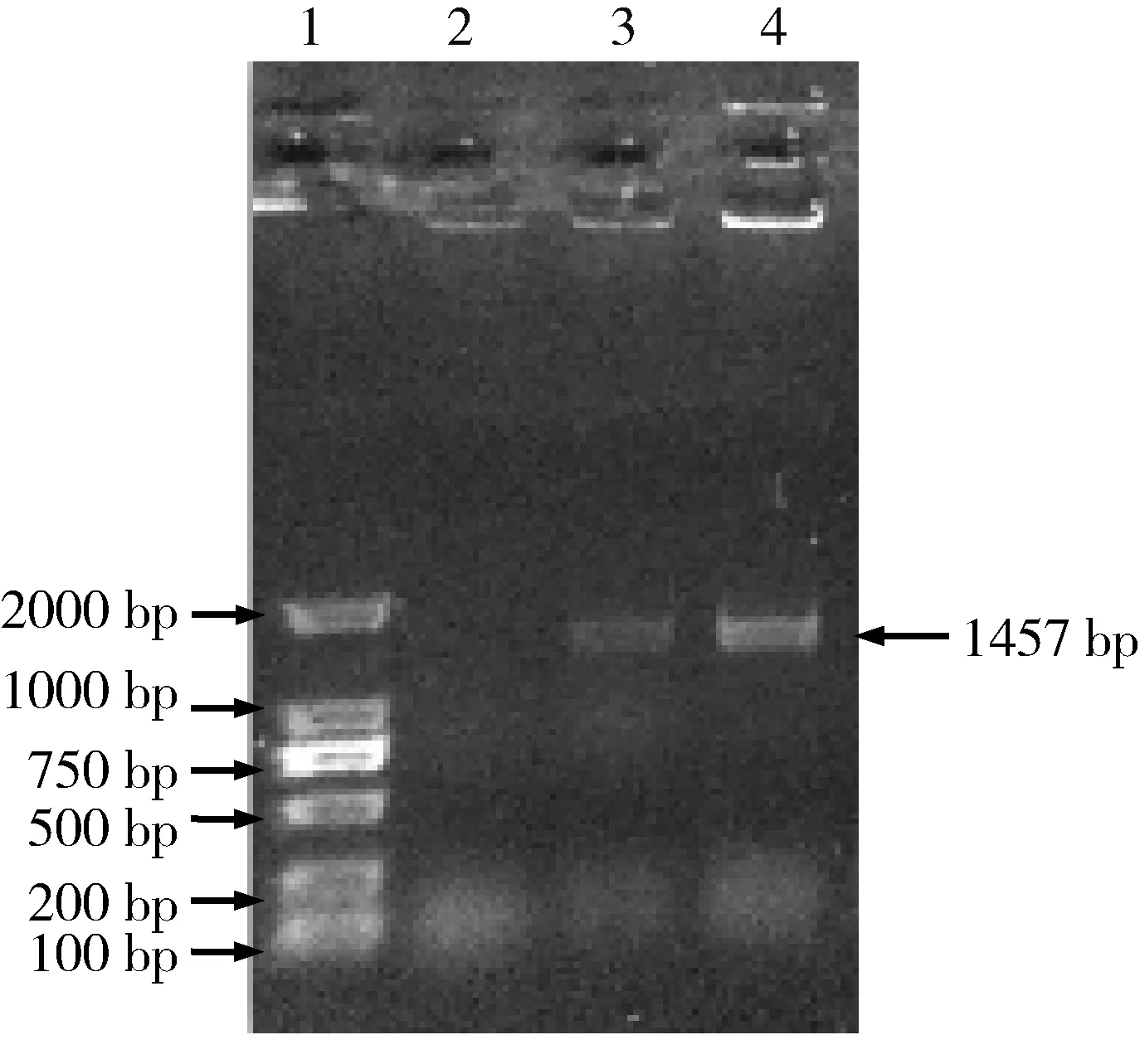
1.M.DL-2 000 Marker;2.阴性对照;3.分离菌;4.阳性对照1.M.DL-2 000 Marker;2.Negative control;3.Isolated bacteria;4.Positive control图1 细菌16S rDNA琼脂糖凝胶电泳结果Fig 1 Results of bacterial 16S rDNA agarose gel electrophoresis
2.5 测序分析 16SrDNA测序结果进行BLAST比对分析,结果表明(表3),分离菌16SrDNA测序片段与Genbank中已知10株大肠杆菌菌株的同源性均在99%以上,因此,确定分离菌株为大肠杆菌菌株。
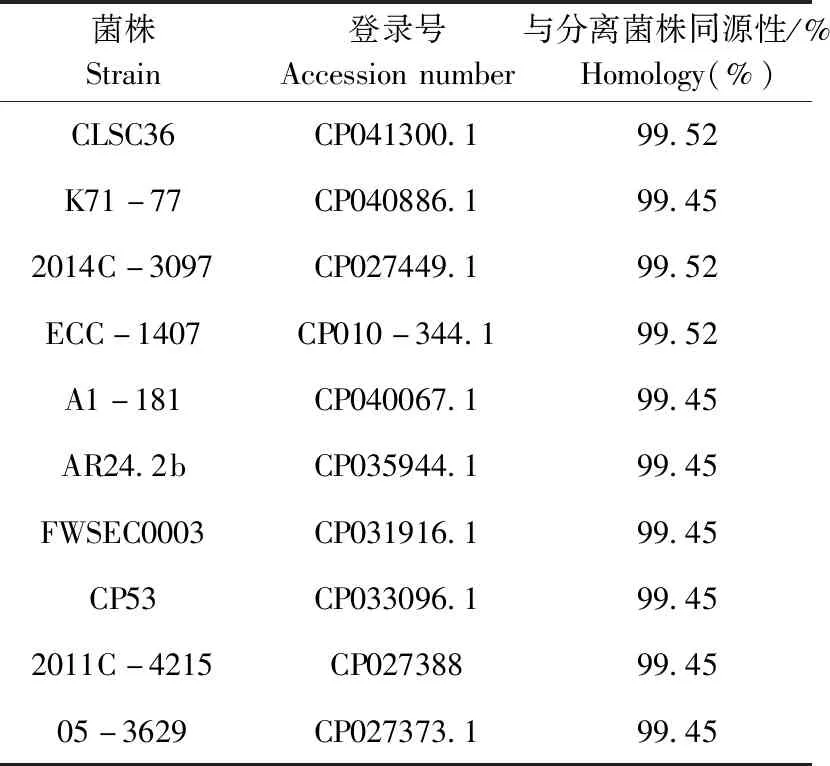
表3 分离菌株序列同源性分析Table 3 Analysis of sequence homology of isolated strain
2.6 雏鸡致病性试验结果 SPF雏鸡颈部皮下接种后 12 h 全部开始发病,出现明显腹泻症状,肛门周围有污秽物,48 h内全部死亡。剖检死亡雏鸡发现气管支气管粘液增加(图2 A);雏鸡少量心包积液,肝脏肿胀,有出血点及出血斑,质地变脆(图2 B);十二指肠出血(图2 C)。雏鸡的心脏和肝脏组织中均可见所接种的细菌(图2 D,100 x)。
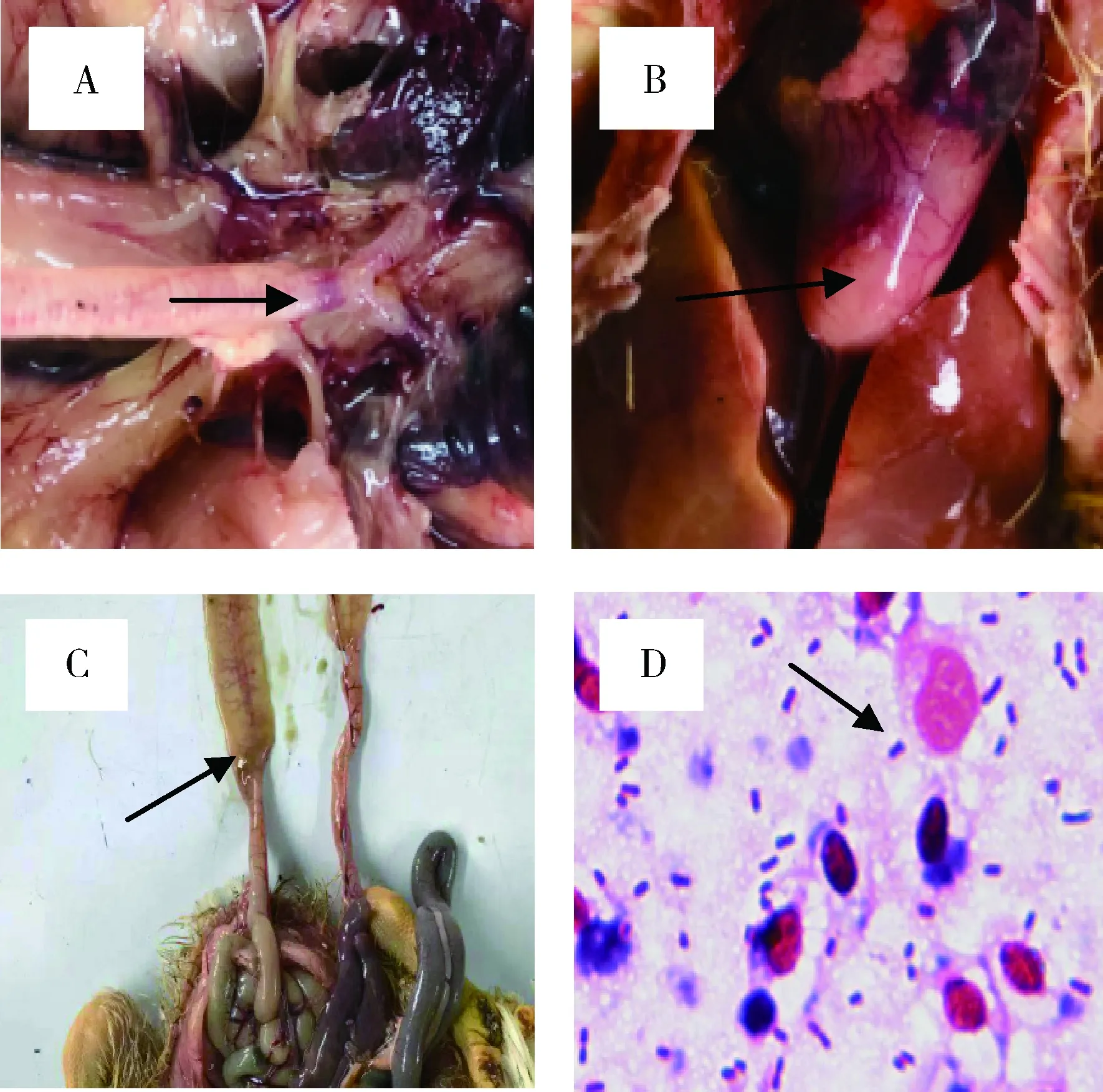
图2 致病性试验结果Fig 2 Results of attack test
2.7 药敏试验结果 对已鉴定出的大肠杆菌进行药敏试验,结果见表4。药敏试验结果显示,本次分离鉴定出的大肠杆菌对丁胺卡那敏感性较高,多粘菌素次之。

表4 药敏试验结果Table 4 Results of Antimicrobial test susceptibility test
R表示耐药,I表示中介,S表示敏感
3 讨论与结论
通过细菌的形态学观察、生化试验考察以及PCR鉴定等,确定从死亡蛋鸡中分离得到菌株为大肠杆菌,动物致病性试验证实,分离菌株具有强致病性。药敏试验证实,分离菌株对青霉素、氟苯尼考、庆大霉素、阿莫西林、氧氟沙星、头孢唑啉、红霉素等临床上常用多种抗生素耐药,仅对丁胺卡那霉素和多粘菌素较为敏感。这一结果与已报道黑龙江地区鹅源大肠杆菌药敏结果较为相似[4],证明临床中禽源大肠杆菌耐药性情况非常严重,有必要通过药敏试验进行药物筛选使用,根据药敏试验结果筛选最敏感的药物和最合适的剂量,切忌盲目用药,滥用药,否则耐药情况很可能进一步加重。
与国外相比,我国的大肠杆菌分离株存在着明显的地域性和多样性,致病型血清型数量较大,鸡源致病型大肠杆菌血清型多集中在O1、O2、O78等型,邓彦宏等在东北地区(黑龙江,吉林,辽宁)分离得到219株大肠杆菌,共鉴定了189个分离株的血清型,其中O1、O4、O78、O138、O107、O141检出率较高,证明这些血清型为东北地区的流行优势血清型[5],本研究并未进行大肠杆菌的血清型检测,但测序结果表明,分离株与O1血清型CLSC36 株同源性最高,为99.5%,这一结果与已报道流行大肠杆菌优势血清型结果一致,说明O1型大肠杆菌在黑龙江地区存在流行,并且耐药性较高,本研究中丁胺卡那霉素和多粘菌素对其较为敏感,此结果对黑龙江省鸡源致病型大肠杆菌的防治有一定的参考意义。
大肠杆菌病的控制主要以预防为主,但如果出现发病,抗生素治疗仍是目前最有效的治疗方式。随着蛋鸡、肉鸡集约化养殖的增加,饲喂抗生素进行预防和治疗大肠杆菌病已成为集约化养殖过程中必不可少的程序[2],不合理使用抗生素必然导致大量细菌产生耐药[6],为此兽医主管部门已经提出了减量化使用抗生素的倡议。最为行之有效的办法仍然是找到一种可以代替抗生素治疗细菌性疾病的替代品。应用疫苗和生物制剂防控大肠杆菌病被认为是一种良好防控措施[7-8]。益生菌的发现也为耐药菌治疗提供了机会[9]。而中草药及中药复方制剂因其疗效好、低残留、不宜产生耐药性的特点,成为近年来的研究热点[10],但目前上述方法仍不能完全取代抗生素的作用,因此,还应进一步探索研究,为真正做到抗生素减量化使用奠定基础。
