土霉素在鸡蛋中的残留消除研究
2019-10-14张崇威邱瑾丽李红娇
张崇威,邱瑾丽,李红娇
(1.河南省兽药饲料监察所,郑州 450008;2.郑州福源动物药业有限公司,郑州 450001)
盐酸土霉素可溶性粉为四环素类广谱抗菌药物制剂,能迅速抑制细菌的生长繁殖。临床上常用于治疗猪、鸡敏感大肠埃希菌、沙门氏菌、巴氏杆菌及支原体引起的感染性疾病。盐酸土霉素可溶性粉可用于产蛋期,治疗产蛋率下降或停止产蛋,以及因输卵管炎造成的蛋壳上带有血迹、产畸形蛋和软壳蛋、输卵管排出黄白色脓样分泌物等[1]。根据在养殖环节的调查,养殖场常以高于常规剂量给药,给药剂量为667 mg/L 50%盐酸土霉素可溶性粉,饮水给药,高于国家规定的500 mg/L给药剂量。人体长期摄入含少量抗生素的食品后,会造成药物的蓄积,产生毒性作用,严重的会出现致癌、致畸、致突变等,因此,对食品安全带来极大的潜在危害[2],我国农业农村部规定了土霉素在鸡蛋中的最高残留限量标准为200 μg/kg,弃蛋期2 d。目前,我国关于鸡蛋中土霉素的研究主要针对残留检测方法的研究,包括超高效液相色谱-串联质谱法[3]、高效液相色谱法[4]、固相萃取-高效液相色谱法[5]、毛细管电泳-电化学检测法[6]等,尚未见关于盐酸土霉素可溶性粉按国家规定剂量和增加剂量使用后在鸡蛋中残留消除规律的研究,本试验通过研究盐酸土霉素可溶性粉在鸡蛋中的残留情况,确定弃蛋期前后土霉素残留量,以期为蛋鸡产蛋期安全用药,保障食品安全提供科学依据。
1 材料与方法
1.1 主要试剂 土霉素对照品,批号:130305,中国食品药品检定研究院;盐酸土霉素可溶性粉,规格:50%,生产批号:201708003,郑州福源动物药业有限公司苏可乐(批准文号:兽药字160256691);甲醇,乙腈为色谱纯;乙二胺四乙酸二钠为分析纯,超纯水,所需溶液配制见GB/T 21317[7]。
1.2 主要仪器 Acquity UPLC-XEVO TQ-S质谱联用仪(美国Waters公司);3K-30台式高速冷冻离心机(Sigma公司);R215 Professional旋转蒸发仪(瑞士Buchi公司);IKAMS3.Basic圆周振荡器(广州仪科实验室技术有限公司);ALC-2100.2电子天平(赛多利斯科学仪器北京有限公司);VX-Ⅲ多管涡旋振荡器(北京踏锦科技有限公司);TTL-DCⅡ氮气吹干仪(北京同泰联科技发展有限公司);TD系列固相萃取柱,TD-TPS-00603(天津市兴达科技有限公司)。
1.3 试验动物及分组 试验选用三棚蛋鸡,品种为京红,362日龄,购自山西省阳城县浩博养殖有限公司,常规饲养,进行常规免疫程序,试验前不使用任何药物。三棚蛋鸡随机分为空白对照组(15000只),常规剂量组(14000只),加大剂量组(15000只)。饲喂不添加任何抗菌药物的全价饲料,自由采食饮水。试验前后各组蛋鸡饲养条件相同。
1.4 给药和样品采集 常规剂量组以500 mg/L,加大剂量组667 mg/L集中饮水给药5 d,空白对照组不给药。根据农业部文件农医发[2018]2号中畜禽产品兽药残留抽样要点[8],在停药后1、2、3、4、5、6、7、8、9、10、11、12 d,每个时间点分别从不同剂量组的鸡棚前中后位置的产蛋架随机采集鸡蛋,每个时间点10个样本,每个样本10枚鸡蛋。样本标记,冰箱4 ℃保存,待测。
1.5 色谱条件 色谱柱:Waters Acquity UPLCTMBEH C18(1.7 μm,2.1×100 mm);柱温30 ℃;流动相A:乙腈,B:0.1%甲酸溶液;进样量5 μL;梯度洗脱程序见表1。

表1 色谱梯度洗脱程序Tab 1 Procedure of gradient elution
1为即时变化,6为线性变化
1.6 质谱条件 电喷雾离子源;正离子扫描;多反应监测MRM;离子源温度150 ℃;脱溶剂气容量800 L/h;锥孔电压25 V;锥孔气流速150 L/h;毛细管电压3.3 kV;定性、定量离子对及对应的锥孔电压和碰撞能量见表2。

表2 定性、定量离子及对应的锥孔电压和碰撞能量Tab 2 Qualitative and quantitative ion pair and the corresponding cone volt and collision enerey
1.7 样品前处理 用匀浆机把鸡蛋制成匀浆,称取匀质样品(2±0.02)g,置50 mL离心管中,加入16 mL缓冲液,漩涡震荡20 min,14000 r/min低温离心5 min,静置,取上清液8 mL进行样品净化。HLB固相萃取柱用3 mL甲醇、3 mL水活化,取上述鸡蛋待净化的8 mL上清液注入萃取柱中,分别依次用3 mL水、3 mL 5%甲醇水溶液淋洗,弃去淋洗液后,用3 mL甲醇洗脱,洗脱液50 ℃水浴中氮气仪吹干,残渣用1 mL 30%甲醇溶液复溶,充分混匀,残渣溶液过0.22 μm针头式过滤器后,滤液供液相色谱-串联质谱法检测,若残留量超出曲线范围,以相应空白基质稀释至曲线范围。
1.8 标准曲线 分别精密吸取100 μg/L的土霉素标准中间液0.02、0.05、0.08、0.10、0.20 mL于1.7项中氮气吹干后所得残渣,加30%甲醇溶液0.98、0.95、0.92、0.90、0.80 mL,混匀,制成2、5、8、10、20 μg/kg的系列基质标准溶液,依次上机,以土霉素的质量浓度为横坐标,定量离子的色谱峰面积为纵坐标,绘制标准曲线。
1.9 检测限和定量限 取匀浆后空白鸡蛋样品2 g,添加适量的土霉素标准溶液,按照1.7项进行处理,经液相色谱串联质谱测定,按信号(S)与噪音(N)比值计算,S/N>3为检测限,S/N>10为定量限值。
1.10 精密度和准确度 分别取匀浆后空白鸡蛋样品2 g,添加4、200、400 μg/kg水平的土霉素进行回收率试验(按照1.7项进行处理),每个添加水平6个平行,连做3次,并计算日内相对标准偏差及日间相对标准偏差。
2 结果与分析
2.1 线性关系 土霉素在2~20 μg/kg浓度范围内呈现良好的线性关系,其曲线方程为:y=17489.07447X-2109.07021,相关系数r为0.99968,如图1所示。标准溶液图谱如图2。

图2 鸡蛋基质中10 μg/kg土霉素标准液的特征色谱图Fig 2 chromatogram of 10 μg/kg oxytetracycline standard solution in egg matrix
2.2 检测限和定量限 根据特征质量色谱峰的信噪比S/N>3为检测限,S/N>10为定量下限,得鸡蛋中土霉素的检测限为 2 μg/kg,定量限为 4 μg/kg。
2.3 准确度和精密度 土霉素在4、200、400 μg/kg 3个添加水平上,每个添加水平做6平行,其平均回收率、日内相对标准偏差及日间相对标准偏差见表3。土霉素的回收率在79.1%~93.6%之间,日内相对标准偏差及日间相对标准偏差均小于10%。图3为空白鸡蛋的土霉素特征离子质量色谱图,图4为空白鸡蛋中添加10 μg/kg的土霉素特征离子质量色谱图。

表3 土霉素回收率及相对标准偏差实验(n=6)Tab 3 Test of recovery rate and relative standard deviation(RSD)of Oxytetracycline(n=6)

图3 空白鸡蛋的土霉素特征离子质量色谱图Fig 3 The characteristicion quality chromatogram of oxytetracycline in blank eggs

图4 空白鸡蛋中添加10 μg/kg土霉素的特征色谱图Fig 4 Chromatogram of oxytetracycline (10 μg/kg)in blank eggs
2.4 鸡蛋中土霉素的残留消除 按照前处理方法对所采集的鸡蛋中土霉素残留进行检测,外标法定量。不同采样点土霉素残留量见表4,残留消除曲线如图5。
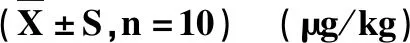
表4 高低剂量组鸡蛋中的土霉素残留量 Tab 4 Oxytetracycline residues in Eggs in high and low dose

图5 鸡蛋中土霉素残留消除曲线Fig 5 Depletion curve of oxytetracycline residue in egg
空白对照组试验期间与各试验组饲养条件和采样时间点相同,空白对照组样品在各取样时间点均未检测出土霉素残留,表明实验动物在试验期间未受到其他来源药物的影响,实验动物在试验期间土霉素残留均来源于目的性给药。表4结果显示,蛋鸡产蛋期分别按500 mg/L和667 mg/L剂量,连续5 d,每天1次,集中饮水给药50%盐酸土霉素可溶性粉。低剂量组在停药第1天,土霉素残留量最高,达到142.72 μg/kg,高剂量组残留量为74.71 μg/kg,高剂量组在停药第2天残留量最高,82.84 μg/kg,与我国规定的弃蛋期2 d符合。高、低剂量组在停药后的1~12 d,鸡蛋中的土霉素残留量均低于国家农业部235公告中规定的最高残留限量(200 μg/kg)。以上数据经方差分析,P>0.05,两组差异不显著。在临床病情严重时,按标签最大剂量的1.33倍给药后,不会造成土霉素在鸡蛋中残留量超标。
3 讨 论
3.1 药物剂量的选择 盐酸土霉素可溶性粉是我国极少数可用于蛋鸡的广谱抗生素,因此,在临床中常用于治疗蛋鸡的输卵管炎。50%盐酸土霉素可溶性粉根据《兽药质量标准》(2017年版)化学药品卷[9]中用法用量为,以本品计每1 L水鸡300~500 mg,连用3~5 d。因此,本试验选用标签中最大使用浓度500 mg/L作为常规剂量组,由于临床使用过程中存在加大药物使用剂量现象,经在养殖环节中现场调查,加大剂量一般为667 mg/L(每150 kg水100 g本品),因此,选用667 mg/L作为加大剂量组,经集中饮水给药途径,连用5 d,研究土霉素在鸡蛋中的残留水平。
3.2 药物在鸡蛋中的残留情况 试验选用的两个剂量是盐酸土霉素可溶性粉在临床治疗输卵管炎常用剂量,在大群养殖环境中,蛋鸡通过集中饮水给药,土霉素残留情况与试验室研究存在一定差异。低剂量组与高剂量组在停药3 d残留量比停药1 d分别下降了59.4%和20.4%,并且残留量均较低,说明土霉素在蛋鸡体内的代谢速率相对较快,我国规定鸡蛋中土霉素的最高残留限量(MRL)标准为200 μg/kg,停药3 d低、高剂量组土霉素在鸡蛋中残留量仅为最高残留限量标准的29%,两个剂量组均不会造成土霉素残留超标。
3.3 检测结果 不同给药浓度鸡蛋中残留量也不同,停药第1天,常规剂量组的残留量高于高剂量组,停药第2天开始,常规剂量组的检出值均低于高剂量组。国内文献[10]曾报道高剂量组在鸡蛋中的残留量比低剂量组先达到高峰。本试验两个剂量组的土霉素残留量在停药后的12 d中,药物的残留量均出现往复现象,如低剂量组停药第6天的残留量19.34 μg/kg,停药第7天的残留量25.83 μg/kg,高剂量组停药第6天的残留量20.48 μg/kg,停药第7天的残留量30.86 μg/kg。与国外文献[11]报道相似:对罗德岛红鸡通过饮水给予400、600、800 mg/L土霉素连续7 d,400和600 mg/L剂量组的蛋黄中土霉素残留量在停药第3、4天,也出现了残留量升高的现象。
土霉素在鸡蛋中残留量出现往复的原因,一是由于鸡蛋结构的特殊性,药物向蛋黄中的移行过程是向细胞内蓄积的过程,蛋黄中的药物残留反映了卵泡快速生长期(10 d)血浆的药物水平,蛋黄中的药物残留水平因用药时间长短和开始用药时间处于卵泡生长的不同阶段而升高、稳定或下降[12],因此,鸡蛋中药物残留量出现波动。第二个原因Kan等[13]推测是受药物与体内蛋白质结合率的影响,该研究在母鸡的峡部和输卵管的膨大部检测到四环素类药物,且四环素在输卵管和蛋白中的残留水平高于血液中的药物水平,等血液中药物浓度下降后,与蛋白质结合的部分药物会重新释放出来进入鸡蛋,这也会使鸡蛋中四环素类药物的残留量发生变化。本试验中土霉素在鸡蛋中的残留量虽然在后期有上升趋势,但幅度较小,远低于国家农业部235公告中规定的土霉素最高残留限量(200 μg/kg),不会造成土霉素残留量超标。
