阿拉伯海鲐鱼渔场时空分布及其与海洋环境的关系
2019-10-14杨胜龙范秀梅唐峰华程田飞樊伟
杨胜龙, 范秀梅, 唐峰华, 程田飞, 樊伟
阿拉伯海鲐鱼渔场时空分布及其与海洋环境的关系
杨胜龙1, 2, 范秀梅1,2, 唐峰华1,2, 程田飞1,2, 樊伟1,2
1. 中国水产科学研究院东海水产研究所, 农业部远洋与极地渔业创新重点实验室, 上海 200090;2. 中国水产科学研究院渔业资源与遥感信息技术重点开放实验室, 上海 200090
采用2016—2017年中国印度洋围拖网生产数据和同期的海表温度、叶绿素、表层海流和海面高度数据, 绘制了阿拉伯海鲐鱼围网月平均单位捕捞努力量渔获量(CPUE)和环境因子空间叠加图, 分析鲐鱼渔场与海洋环境因子之间关系, 采用频次分析和经验累积分布函数计算鲐鱼渔场最适宜的海洋环境区间。结果表明, 该海域月平均CPUE呈现先减少后增加的趋势; 围网渔场渔汛主要在东北季风期间, 从10月到翌年3月; 作业渔场重心分布在59°—62°E、13°—17°N, 具有明显的月变化, 基本呈现西南移动趋势。空间上, CPUE 分布在西边界流速较大的海域右侧, 在海流最大值和最低值中间区域。在印度洋东北季风期间, 阿拉伯海围网鲐鱼渔场适宜海表温度在25~28℃; 叶绿素浓度在0.2~0.5mg·m–3; 表层海流在0.05~0.25m·s–1; 海表高度0.2~0.35m。
鲐鱼; 阿拉伯海; 海表环境; 渔场
鲐鱼属于大洋暖水性中上层鱼类, 分布在印度洋、太平洋和大西洋温带和亚热带大陆架及其邻近海域(朱国平等, 2011;李显森等, 2018)。鲐鱼是中国近海一种重要的经济鱼种, 也是我国海洋渔业的重要组成部分。1990年代后我国鲐鱼年产量维持在30万t水平, 年波动在1.8万~2.3万t。有关近海鲐鱼研究非常多, 研究表明近海鲐鱼的资源丰度和空间分布特征与环境变量有着密切的关系(Yatsu et al, 2005; Yukami et al, 2009; 郭爱等, 2018), 证实海表温度、海面高度、海流、叶绿素和沿岸水团等海洋环境对近海鲐鱼资源渔场变动有重要影响(郑波等, 2008;李纲等, 2009; Li et al, 2014; 苏杭等, 2015; 易炜等, 2017), 并开发了渔场预报模型(高峰等, 2015)。
2015年我国围网渔船开始在北印度洋进行围网探捕作业, 开发了阿拉伯海公海围网渔场, 捕捞澳洲鲐。产量从2015年的2573 t 到2017年的3.4 万t。阿拉伯澳洲鲐最早发现于1993年(Gopakumar et al, 1993)印度西南沿海, 随后在红海、亚丁湾和阿曼湾等也被发现(Baker et al, 1998)。目前有关阿拉伯海鲐鱼的研究报道极少, 苏联学者发表了一篇阿拉伯海鲐鱼生物学分析报告(Peohk, 2015)。
我国以前未在该海域进行鲐鱼作业, 没有开展相关研究。为更好地了解和可持续利用阿拉伯海鲐鱼资源, 本文采用近年我国在阿拉伯海的鲐鱼生产捕捞数据, 结合海表温度、叶绿素浓度、海流和海面高度等卫星遥感数据, 分析鲐鱼渔场时空变动及其与表层环境关系, 为我国围网渔业在该地区的生产作业提供技术支撑。
1 数据与方法
1.1 渔获数据
鲐鱼渔获数据来自于2016—2017年我国在印度洋从事拖围网生产作业捕捞数据。数据包括下网时间、作业经度、作业纬度、作业时期、日产总产量、主要鱼种产量和作业网次。由于2016—2017年, 大部分作业区域在阿拉伯海海域, 因此本文采用阿拉伯海域数据, 范围为: 10°—25°N, 50°—80°S。
1.2 海表遥感数据
采用Aqua/MODIS月平均的海表温度(sea surface temperature, SST)和叶绿素 (chlorophyll a, Chl a)产品数据, 精度为(1/12)°(约8km), 数据下载于网站https://oceanwatch.pifsc.noaa.gov/。月平均的表层海流(sea surface current)和海面高度(sea surface height) 产品数据来自于CMEMS的预报数据, 精度为(1/12)°(约8km)。
1.3 分析方法
1.3.1 单位捕捞努力渔获量
单位捕捞努力渔获量(catch per unit effort, CPUE)CPUE计算公式为:
CPUE=(1)
其中,为0.5×0.5网格内月总的渔获量,为0.5×0.5网格内月总的作业总网次, 月平均CPUE单位为t·网–1。计算所有CPUE的平均值、均方差和四分位数(Q1—Q4)。大于Q3的CPUE称为高值CPUE, 即认为CPUE较高, 而其所属渔区定义为中心渔场。
1.3.2 渔场重心
计算公式为:

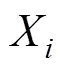
1.3.3 适宜环境区间
阿拉伯海鲐鱼渔场最适宜的表层环境参数分别通过频次分析和经验累积分布函数(ECDF)得到(Perry et al, 1994; Andrade et al, 1999; Zainuddin et al, 2008)。计算与高值CPUE对表层环境参数的平均值和均方差及适宜表层环境参数区间; 采用非数统计K-S(Kolmogorov-Smirnov)检验方法进行显著性检验, 检验方法为分别计算4个表层环境变量和中心渔场CPUE累积频度曲线, 求出K-S检验的统计量, 并作显著性检验。累积分布曲线方程式和统计量计算公式如下:
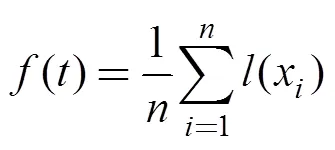
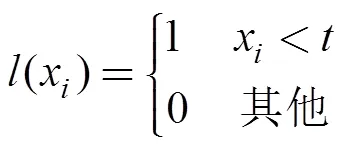
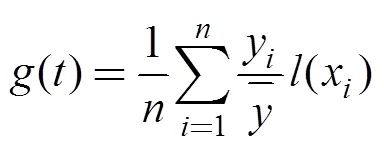
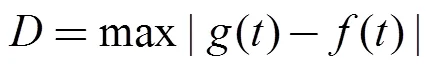
2 研究结果
2.1 渔获量分析
2016年阿拉伯海灯光围网鲐鱼年产量为2.56万t, 2017年为3.4万t, 年产量增长较快。图1表明阿拉伯海鲐鱼月产量从10月到翌年3月产量都较高, 期间各月鲐鱼总产量均超过7000t。11月阿拉伯海灯光围网鲐鱼产量最大, 月总产量超过1.1万t。CPUE高值出现在东北季风期间。CPUE最大值出现在2月(每网6.44t)。第二季度(4—6月)和第三季度(7—9月)总产量和CPUE逐渐变低, 其中6—7月没有捕捞产量, 8月总产量在100t, CPUE为1 t·网–1。

图1 2016—2017阿拉伯海鲐鱼月平均产量和CPUE
2.2 渔获重心变化
2016—2107年阿拉伯公海鲐鱼CPUE重心有明显的月份变化(图2)。6—7月几乎没有作业, 没有重心。8—9月开始在阿拉伯海捕捞作业, 捕捞作业重心在CPUE重心在60°30′E、15°N附近。10月作业渔场重心向东北移动到61°30′E、16°N附近区域。11月作业渔场重心到达全年最北端, 之后作业渔场重心向西南方向移动, 直到2月。这期间中心移动方向与表层海流方向相同。3月作业渔场重心向南稍微转移, 4—5月作业渔场重心开始向东转移。
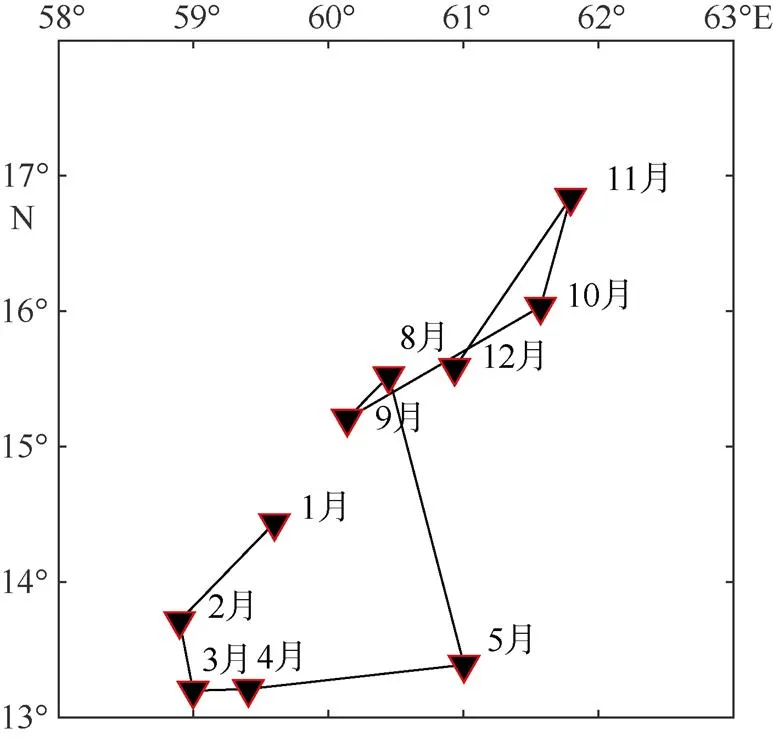
图2 2016—2017阿拉伯海鲐鱼渔场重心月变化图
2.3 鲐鱼渔场与海表温度关系
在印度洋东北季风期间, 阿拉伯海各月海表温度空间分布有明显差异(图3)。时间上, 灯光围网鲐鱼作业渔场的海表温度呈现先降低后上升的趋势。11月到翌年3月, 作业渔场区的海表温度在25.5~28℃, 灯光围网鲐鱼CPUE较高(图1)。与此同时, 在海表温度超过29℃区域几乎没有渔获。4—5月, 阿拉伯海的海表温度升高, 大部分海域的海表温度超过29℃。与此同时, CPUE值逐渐变小(图1)。9月作业区域的海表温度在27℃, 但CPUE值普遍变小, 没有形成渔场。
SST与高值CPUE离散图(图4)表明, 高值CPUE频数分布呈现双峰特征。高值CPUE出现在25~31℃之间,平均SST为27.7℃, 众数出现在26~28.5℃ (72%)。鲐鱼作业网次变化和高值CPUE相似, 大部分灯光围网作业集中在26~28.5℃(76.7%)。在30~31℃区间, 高值CPUE和围网作业网次呈现第二次峰值分布。
2.4 鲐鱼渔场与叶绿素关系
印度洋东北季风期间, 叶绿素高值空间分布大体呈纬向特征(图5)。12月开始, 叶绿素高值空间从阿拉伯海北部向南部覆盖, 3月高值覆盖区域向北部收缩。空间上, 全年CPUE分布随着叶绿素高值区域的纬向变动而南北移动。在CPUE高的月份, 鲐鱼CPUE出现在叶绿素高值区域外围, 介于叶绿素高值和低值之间, 在0.3~0.5mg·m–3; 而在CPUE低值的4—5月, 对应的叶绿素浓度值小于0.3mg·m–3。

图3 2016—2017年阿拉伯海鲐鱼月平均CPUE(圆圈, 单位: t·网–1)和海表温度(色块, 单位: ℃)空间叠加图

图4 2016—2017年阿拉伯海鲐鱼月平均CPUE与海表温度关系图 a. 散点图; b. 频次图
Chla与高值CPUE离散图(图6)表明, 高值CPUE出现在0.05~1.3mg·m–3之间,平均Chla为0.37mg·m–3, 众数出现在0.1~0.5mg·m–3(78%)。高值CPUE呈现双峰分布特征, 第一个波峰在0.1mg·m–3, 第二个波峰在0.3~0.35mg·m–3。鲐鱼作业网次变化和高值CPUE相似, 但分布比CPUE要偏右。大部分灯光围网作业集中在0.1~0.5mg·m–3(79%),在0.3~0.4mg·m–3。区间内作业网次频数最高。

图5 2016—2017年阿拉伯海鲐鱼月平均CPUE(单位: t•网–1)和叶绿素(色块, 单位: mg·m–3)空间叠加图

图6 2016—2017年阿拉伯海鲐鱼月平均CPUE与叶绿素浓度关系 a. 散点图; b. 频次图
2.5 鲐鱼渔场与表层海流关系
阿拉伯海西部表层海流大于东部, 各月变化也更明显(图7)。9月到翌年3月, 阿拉伯海西边界海流流速和覆盖面积呈现由大到小趋势。与此同时, CPUE多分布在西边界流速较大海域的右侧, 多呈径向分布在高值区和低值区中间区域。渔场区表层海流小于0.1 m·s–1的4、5月和表层海流大于0.3 m·s–1的9月, 月平均CPUE较小。
表层海流与高值CPUE离散图(图8)表明, 高值CPUE出现在0.0~0.6m·s–1之间,平均海流为0.19m·s–1, 众数出现在0.05~0.25m·s–1(84.3%)。鲐鱼作业的网次出现范围要比CPUE区间偏右, 大部分作业集中在0.1~0.3m·s–1(90%)。

图7 2016—2017年阿拉伯海鲐鱼月平均CPUE(单位: t•网–1)和表层海流(色块, 单位: m·s–1)空间叠加图

图8 2016—2017年阿拉伯海鲐鱼月平均CPUE与海流关系 a. 散点图; b. 频次图
2.6 鲐鱼渔场与海面高度关系
全年阿拉伯海西部海面高度小于东部, 海面高度出现在印度西南沿岸及外围海域(图9)。在CPUE高值月份, 渔场区域海面高度在0.3m左右。从4月开始, 随着渔场区的海面高度变大, 月平均CPUE值开始呈下降趋势。
SSH与CPUE离散图(图10)表明, CPUE出现在0.1~0.55m之间,平均SSH为0.28m, 众数出现在0.2~0.4m(81%)。鲐鱼作业的网次出现范围要比CPUE区间偏右, 大部分作业集中在0.25~0.45m (90.2%)。

图9 2016—2017年阿拉伯海鲐鱼月平均CPUE(圆圈, 单位: t·网–1)和海面高度(色块, 单位: m)空间叠加图
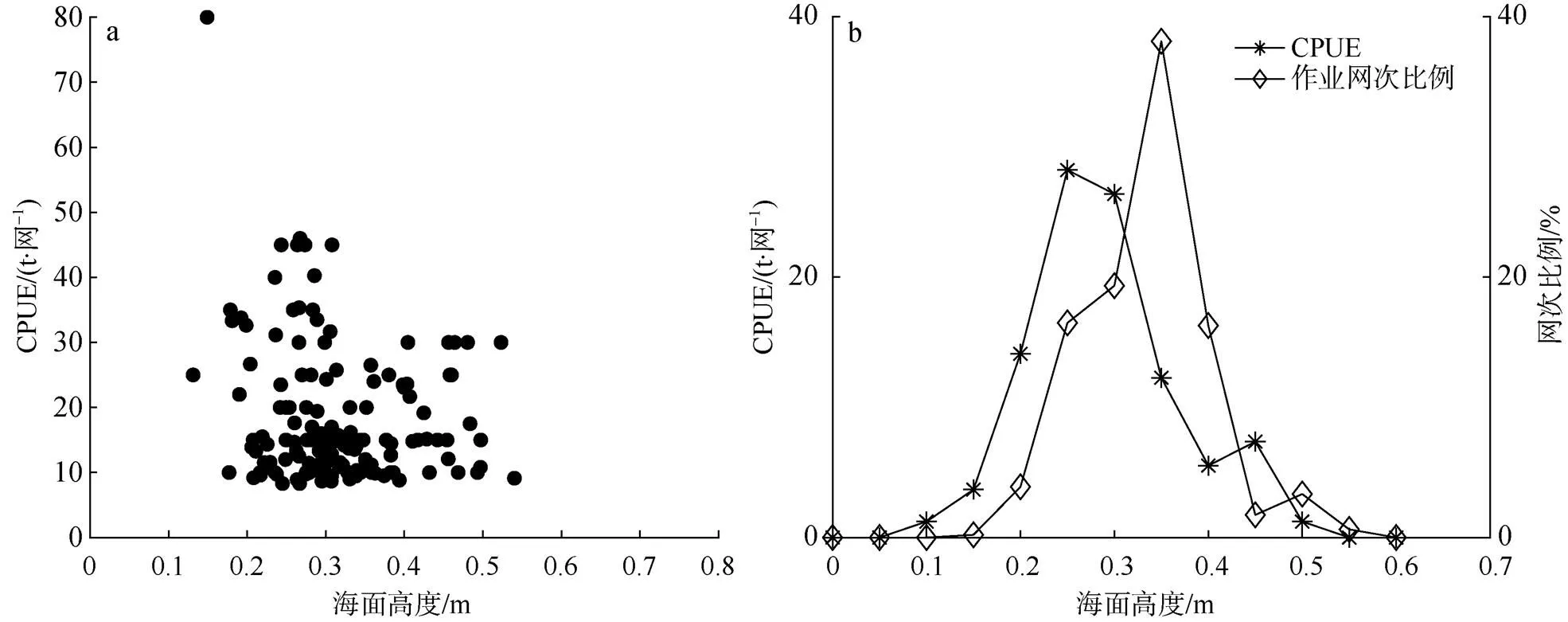
图10 2016—2017年阿拉伯海鲐鱼月平均CPUE与海面高度关系 a. 散点图; b. 频次图
2.7 K-S检验

图11 围网CPUE和海表温度(a)、叶绿素浓度(b)、海流(c)、海面高度(d)的关系
3 讨论与分析
3.1 渔场分布特征及其影响因素
海表温度对鲐鱼的洄游、生殖和产卵有直接影响, 是影响鲐鱼渔场形成最为关键的环境因子(Yatsu et al, 2005; 易炜等, 2017) , 东海鲐鱼每年春、夏季向东海北部和黄海洄游产卵和索饵, 我国东海鲐鱼灯光围网渔场由南向北逐渐转移到黄海(朱国平等, 2011)。阿拉伯海叶绿素浓度对中上层鱼类资源分布有重要影响(Madhupratap et al, 1994, 2001)。海面高度和海流有关, 海流的聚合和辐散会导致海面高度的上升和下降, 形成渔场。本文选择上述几个表层环境因子是合理的。
在阿拉伯海, 灯光围网鲐鱼渔汛期从10月开始, 到次年3月结束。渔场重心从第4季度的61°E以东、15°30′N以北海域向西南方向移动到第1季度的59°E和13°30′N附近海域。期间, 围拖网作业渔区的海表温度呈逐渐下降趋势, 但变化不大(Rao et al, 1996), 在26~28℃之间(图3)。同期围拖网作业渔区始终分布在靠近叶绿素浓度最高值的外围, 在0.3 mg·m–3海域附近(图5)。阿拉伯海西北海域叶绿素浓度全年要高于东部海域, 尤其是阿曼海湾附近海域(Piontkovski et al, 2012), 这可能是围网作业渔场在阿拉伯海中部偏西区域的原因。
水团对鲐鱼的空间分布有重要影响(杨红等, 2001)。东海鲐鱼中心渔场随着台湾暖流水舌锋的进退而移动(苗振清, 1993), 位于海面高度极大值和极小值交汇海域(李纲等, 2009)。在阿拉伯海, 灯光围网鲐鱼作业渔场多出现在强弱海流交汇处右侧, 呈径向分布特征, 在海面高度的高值和低值中间区域。随着表层海流强的覆盖区域向本文研究区域的西南部收缩, 并伴随着0.3mg·m–3海域的纬向变化, 围拖网作业渔场重心向西南方向移动, 方向与同期表层海流相同。在东北季风期间, 作业渔场适宜海表温度在27~30℃、叶绿素0.2~0.5mg·m–3、表层海流0.05~0.25m·s–1和海表高度0.2~0.35m, 渔场适宜环境分布和中国东海鲐鱼研究结果吻合(李纲等, 2009)。
4月开始, 阿拉伯海的海表温度持续上升, 5月在阿拉伯海南部形成暖池(>29.5℃)(Rao et al, 1996); 同期围拖网作业渔区叶绿素浓度快速降低。西南季风期间, 较强的、水汽充沛的西南季风代替了东北季风, 在阿拉伯海形成反气旋型环流, 阿拉伯海的海表层海流变大(Rao et al, 1996; Valsala, 2009), 海面高度相比东北季风期间变高(Prasanna Kumar et al, 1998)。在围拖网作业渔区, 表层海流值偏低, 海面高度值升高, 同期伴随随着叶绿素浓度和表层海流速度的下降以及海面高度和海表温度值的升高, 4—5月灯光围拖网CPUE逐渐变小, 渔场重心向东移动。6月没有作业, 作业渔场消失。9月作业区域叶绿素浓度较高, 鲐鱼开始洄游此处索饵, 但在索马里海流的作用下, 作业区域的海表温度小于26℃, CPUE同样非常低。
3.2 鲐鱼渔场季节性原因
目前没有有关阿拉伯海鲐鱼渔场季节性变化研究文献, 也未见阿拉伯海鲐鱼生殖洄游研究报道。在坦桑尼亚的桑给巴尔岛的羽鳃鲐产量也是东北季风时高、西南季风时低(Mwebaza-Ndawula, 1990)。印度沿岸的羽鳃鲐产量在第3、4季度高, 在第1、2季度产量变低, 3—5月经常没有渔获(Madhupratap et al, 1994, 2001)。研究推断羽鳃鲐在西南季风期间在近岸产卵, 7—8月为产量盛期; 在东北季风期间到外海进行觅食(Mwebaza-Ndawula, 1990; Madhupratap et al, 1994, 2001)。阿拉伯海鲐鱼渔场季节性变化出现可能与鲐鱼的产卵和索饵洄游有关。东北季风期间适宜的海表温度、较充足的饵料适宜阿拉伯海鲐鱼觅食。夏季季风期间, 在表层海洋环境超出阿拉伯海鲐鱼适宜栖息范围情况下, 4—5月阿拉伯海鲐鱼也可能从深水层向近海洄游。
上述推断需要进一步积累科研数据, 采集更多的鲐鱼数据, 分析阿拉伯海鲐鱼生物学特征, 了解其洄游习性, 这将有助于更好地了解该海域的渔汛变动。
高峰, 陈新军, 官文江, 等, 2015. 基于提升回归树的东、黄海鲐鱼渔场预报[J]. 海洋学报, 37(10): 39–48. GAO FENG, CHEN XINJUN, GUAN WENJIANG, et al, 2015. Fishing ground forecasting of chub mackerel in the Yellow Sea and East China Sea using boosted regression trees[J]. Acta Oceanologica Sinica, 37(10): 39–48 (in Chinese with English abstract).
郭爱, 余为, 陈新军, 等, 2018. 中国近海鲐鱼资源时空分布与海洋净初级生产力的关系研究[J]. 海洋学报, 40(8): 42–52. GUO AI, YU WEI, CHEN XINJUN, et al, 2018. Relationship between spatio-temporal distribution of chub mackereland net primary production in the coastal waters of China[J]. Acta Oceanologica Sinica, 40(8): 42–52 (in Chinese with English abstract).
李纲, 陈新军, 2009. 夏季东海渔场鲐鱼产量与海洋环境因子的关系[J]. 海洋学研究, 27(1): 1–8. LI GANG, CHEN XINJUN, 2009. Study on the relationship between catch of mackerel and environmental factors in the East China Sea in summer[J]. Journal of Marine Sciences, 27(1): 1–8 (in Chinese with English abstract).
李显森, 逄志伟, 朱建成, 等, 2018. 中东大西洋中部海域鲐鱼渔场的时空变化初步研究[J]. 水产科学, 37(1): 31–37. LI XIANSEN, PANG ZHIWEI, ZHU JIANCHENG, et al, 2018. Spatial-temporal patterns in fishing ground ofin Central Eastern Central Atlantic ocean[J]. Fisheries Science, 37(1): 31–37 (in Chinese with English abstract).
苗振清, 1993. 东海北部近海夏秋季鲐鲹渔场与海洋水文环境的关系[J]. 浙江水产学院学报, 12(1): 32–39. MIAO ZHENQING, 1993. Relation betweenandfishing grounds in the summer-autumn and ocean hydrologic environment in the northern part of the East China Sea[J]. Journal of Zhejiang College of Fisheries, 12(1): 32–39 (in Chinese with English abstract).
苏杭, 陈新军, 汪金涛, 2015. 海表水温变动对东、黄海鲐鱼栖息地分布的影响[J]. 海洋学报, 37(6): 88–96. SU HANG, CHEN XINJUN, WANG JINTAO, 2015. Influence of sea surface temperature changes onhabitat in the Yellow Sea and East China Sea[J]. Acta Oceanologica Sinica, 37(6): 88–96 (in Chinese with English abstract).
杨红, 章守宇, 戴小杰, 等, 2001. 夏季东海水团变动特征及对鲐鲹渔场的影响[J]. 水产学报, 25(3): 209–214. YANG HONG, ZHANG SHOUYU, DAI XIAOJIE, et al, 2001. Characteristics of water masses and its influence on mackerel scad fishery in the East China Sea in the summer[J]. Journal of Fisheries of China, 25(3): 209–214 (in Chinese with English abstract).
易炜, 郭爱, 陈新军, 2017. 不同环境因子权重对东海鲐鱼栖息地模型的影响研究[J]. 海洋学报, 39(12): 90–97. YI WEI, GUO AI, CHEN XINJUN, 2017. A study on influence of different environmental factors weights on the habitat model for[J]. Acta Oceanologica Sinica, 39(12): 90–97 (in Chinese with English abstract).
郑波, 陈新军, 李纲, 2008. GLM和GAM模型研究东黄海鲐资源渔场与环境因子的关系[J]. 水产学报, 32(3): 379–386. ZHENG BO, CHEN XINJUN, LI GANG, 2008. Relationship between the resource and fishing ground of mackerel and environmental factors based on GAM and GLM models in the East China Sea and Yellow Sea[J]. Journal of Fisheries of China, 32(3): 379–386 (in Chinese with English abstract).
朱国平, 李纲, 郑晓琼, 等, 2011. 东海鲐鱼资源时空分布特征[J]. 生态科学, 30(1): 1–7. ZHU GUOPING, LI GANG, ZHENG XIAOQIONG, et al, 2011. Spatial-temporal distribution characteristic of chub mackerel () resource in the East China Sea[J]. Ecological Science, 30(1): 1–7 (in Chinese with English abstract).
ANDRADE H A, GARCIA C A E, 1999. Skipjack tuna fishery in relation to sea surface temperature off the southern Brazilian coast[J]. Fisheries Oceanography, 8(4): 245–254.
BAKER E A, COLLETTE B B, 1998. Mackerel from the northern indian ocean and the red sea are, not[J]. Ichthyological Research, 45(1): 29–33.
GOPAKUMAR G, SARMA P S S, THOMAS K T, 1993. First record of spotted chub mackerel(scombridae: pisces) off Vizhinjam, Southwest Coast of India[J]. Journal of the Marine Biological Association of India, 35(1–2): 227–229.
LI GANG, CHEN XINJUN, LEI LIN, et al, 2014. Distribution of hotspots of chub mackerel based on remote-sensing data in coastal waters of China[J]. International Journal of Remote Sensing, 35(11–12): 4399–4421.
MADHUPRATAP M, SHETYE S R, NAIR K N V, et al, 1994. Oil sardine and Indian mackerel: their fishery, problems and coastal oceanography[J]. Current Science, 66(5): 340–348.
MADHUPRATAP M, NAIR K N V, GOPALAKRISHNAN T C, et al, 2001. Arabian sea oceanography and fisheries of the west coast of India[J]. Current Science, 81(4): 355–361.
MWEBAZA-NDAWULA L, 1990. Seasonal variation in abundance of the Indian mackerel,Cuvier (Pisces: Scombridae) along the Zanzibar coast of East Africa[J]. Hydrobiologia, 190(3): 233–239.
PEOHK C T, 2015. Age and growth rate of blue mackerel (Cuvier, 1831) in the Gulf of Aden[J]. Journal of Southern Fisheries and Ocean Research Institute, 53: 131–142 (in Russian with English abstract).
PERRY R I, SMITH S J, 1994. Identifying habitat associations of marine fishes using survey data: an application to the northwest Atlantic[J]. Canadian Journal of Fisheries and Aquatic Sciences, 51(3): 589–602.
PIONTKOVSKI S A, CLAEREBOUDT M R, 2012. Interannual changes of the Arabian Sea productivity[J]. Marine Biology Research, 8(2): 189–194.
PRASANNA KUMAR S, SNAITH H, CHALLENOR P, et al, 1998. Seasonal and inter-annual sea surface height variations of the northern Indian Ocean from the TOPEX/POSEIDON altimeter[J]. Indian Journal of Marine Science, 27: 10–16.
RAO R R, SIVAKUMAR R, 1996. Seasonal variability of near-surface isothermal layer and thermocline characteristics of the Tropical Indian Ocean[J]. Meteorology and Atmospheric Physics, 61(3–4): 201–212.
VALSALA V, 2009. Different spreading of Somali and Arabian coastal upwelled waters in the northern Indian Ocean: a case study[J]. Journal of Oceanography, 65(6): 803–816.
YATSU A, WATANABE T, ISHIDA M, et al, 2005. Environmental effects on recruitment and productivity of Japanese sardineand chub mackerelwith recommendations for management[J]. Fisheries Oceanography, 14(4): 263–278.
YUKAMI R, OHSHIMO S, YODA M, et al, 2009. Estimation of the spawning grounds of chub mackereland spotted mackerelin the East China Sea based on catch statistics and biometric data[J]. Fisheries Science, 75(1): 167–174.
ZAINUDDIN M, SAITOH K, SAITOH S I, 2008. Albacore () fishing ground in relation to oceanographic conditions in the western North Pacific Ocean using remotely sensed satellite data[J]. Fisheries Oceanography, 17(2): 61–73.
Relationship between spatial-temporal distribution ofand environmental factors in the Arabian Sea
YANG Shenglong, FAN Xiumei, TANG Fenghua, CHEN Tianfei, FAN Wei
1. Key Laboratory of Oceanic and Polar Fisheries, Ministry of Agriculture and Rural Affairs; East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai, 200090, China;2. Key and Open Laboratory of Remote Sensing Information Technology in Fishing Resource, East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China;
Satellite-based oceanographic data of sea surface temperature (SST), sea surface chlorophyll-a concentration (Chla), sea surface current (SSC), and sea surface height (SSH) together with purse seine catch data of Chinese purse fishing boats during 2016-2017 were used to investigate the relationship between the fishing grounds of spotted mackerel (and environmental factors in the Arabian Sea. Empirical cumulative distribution function and high catch data analyses were used to calculate preferred ranges of the four oceanographic factors. Results indicated that average CPUE (catch per unit effort) decreased from February to May, and then increased until December. The purse seine fishing season is mainly during the northeast monsoon from October to March of the following year. The gravity of fishing grounds is distributed between 59°-62°E and 13°-17°N, and shows monthly variation, mainly presenting a southwest movement trend. The CPUEs were observed along the high value area of SSC in the north-south direction, and located between the high and low value areas of SSH. The optimum ranges of SST, Chla, SSC, and SSH were 26–28℃, 0.15–0.5 mg·m–3, 0.05–0.25m·s–1s, and 0.2–0.35 m, respectively.
; Arabian Sea; sea surface environmental; fishing grounds
date: 2018-10-16;
date: 2019-02-27.
The Special Funds of Basic Research of Central Public Welfare Institute (2016Z01-02); the research was supported by The Chinese National Natural Science Foundation (41606138); the Fund of Key Laboratory of Open-Sea Fishery Development, Ministry of Agriculture, P. R. China(LOF 2018-01); Central Public-interest Scientific Institution Basal Research Fund, CAFS ( 2018HY- XKQ0305)
FAN Wei, fanwee@126.com
S931.4; P735
A
1009-5470(2019)04-0091-10
10.11978/2018106
http://www.jto.ac.cn
2018-10-16;
2019-02-27。
孙淑杰编辑
中央级公益性科研院所基本科研业务费资助项目(2016Z01-02); 国家自然科学基金项目(41606138); 农业部外海渔业开发重点实验室开放基金项目(LOF 2018-01); 中国水产科学研究院基本科研业务费资助项目(2019GH02、2018HY-XKQ0305)
杨胜龙(1982—), 男, 硕士, 助研, 主要从事海洋生态学研究, E-mail: ysl6782195@126.com
樊伟, fanwee@126.com
Editor: SUN Shujie
