不同胰岛素起始治疗方案对口服药失效的2型糖尿病患者β细胞功能的影响
2019-10-12韩旸王凯亮赖杰李洪梅
韩旸 王凯亮 赖杰 李洪梅
(应急总医院内分泌科,北京 100028)
2型糖尿病(T2DM)是一种终身存在并缓慢进展的代谢紊乱性疾病,最新的数据显示,我国成年糖尿病的发病率高达11.6%,患病人数约1.139亿,居全世界首位,糖尿病已成为威胁我国居民身心健康的公共卫生问题之一[1]。胰岛素抵抗和胰岛β细胞功能缺陷是T2DM发病的中心环节,初期表现为适应胰岛素抵抗性增加,胰岛出现代偿,随着病情进展,β细胞开始减少,胰岛β细胞功能进行性下降[2]。对于T2DM患者,无论最初采用的是什么口服药治疗方案,大约0.5~5年后都会出现血糖控制不良现象,目前,口服药失效患者首选的是胰岛素治疗,但对于胰岛素种类、起始治疗剂量的选择尚无统一标准[3]。本研究对煤炭总医院门诊收治的口服药失效的T2DM患者给予甘精胰岛素或门冬胰岛素30治疗,旨在探讨两种胰岛素起始治疗方案对β细胞功能的影响,报告如下。
1 资料与方法
1.1一般资料 选取2017年3月至2017年9月煤炭总医院门诊收治的60例口服药失效的T2DM患者,随机分为基础组和预混组各30例。纳入标准:(1)符合2013版《中国T2DM防治指南》中T2DM的诊断标准[4];(2)糖尿病病程<3年;(3)服用口服药(阿卡波糖、二甲双胍)>3个月;(4)糖化血红蛋白(HbA1c)介于7.5%~10.00%之间;(5)空腹血糖(FBG)≥7 mmol/L。排除标准:入组前使用过胰岛素促泌剂者;近1个月内出现过糖尿病高渗性非酮症昏迷或糖尿病酮症;存在尚未控制的甲状腺功能减退或亢进;合并严重肝功能损害(谷丙转氨酶超过参考范围上限的2.5倍)、肾功能损害(血肌酐≥133 μmol/L)等脏器疾病;近期接受过糖皮质激素治疗者;计划未来6个月内妊娠或处于妊娠期、哺乳期者;依从性差者。剔除标准:临床医生出于患者安全或利益考虑认为患者应停止本次研究;患者要求退出/终止本研究;患者死亡。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。患者及家属均知情同意。两组一般资料见表1。
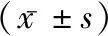
表1 两组一般资料比较
1.2方法 所有患者均接受糖尿病健康教育,包括饮食、运动、治疗方案、注意事项、自我血糖监测及低血糖应对措施等内容,治疗目标:FBG 4.4~7.0 mmol/L,餐后2h血糖(PBG)<10 mmol/L,HbA1c≤7.0%[5]。两组均严格控制饮食、规律运动,维持口服阿卡波糖、二甲双胍不变;基础组:加用长效胰岛素类似物,甘精胰岛素注射液(德国 Sanofi-Aventis Deutschland GmbH,进口药品注册证号S20080101,10 mL:1000单位/支),1次/d,起始剂量为0.2 U/kg,第1个月每3d测量1次FBG,若仍≥7 mmol/L,则每次增加2 U,电话随访1次/周,直至FBG达标。预混组:加用预混胰岛素类似物,门冬胰岛素30注射液(丹麦 Novo Nordisk A/S,进口药品注册证号S20090098,3毫升/支),2次/d,起始剂量为0.4 U/kg,第1周每3d测量1次FBG,若仍≥7 mmol/L,则每次增加2U电话随访1次/周,直至FBG达标。
1.3观察指标 收集患者病历,记录糖尿病病程、年龄、性别、体重、身高、体质量指数(BMI)、收缩压、舒张压。治疗前和12周后分别采集两组患者早晨空腹静脉血,采血前先测量体重,采用血糖仪测定FBG、PBG,每次测量3次,取平均值;采用化学发光免疫分析法测定空腹和餐后C肽(C-P);采用高效液相色谱法测定HbA1c;记录血糖达标时间、胰岛素用量及HbA1c达标率;使用使用稳态模型计算胰岛β细胞功能指数(HOMA-β)及胰岛素抵抗指数(HOMA-IR),HOMA-β=20×空腹胰岛素/(空腹血糖-3.5),HOMA-IR=空腹血糖×空腹胰岛素/22.5。观察两组治疗期间低血糖发生情况,轻度低血糖标准:<3.1 mmol/L,伴有或不伴有低血糖症状,患者可自我处理;重度低血糖事件是指患者低血糖发作后丧失自我处理能力,需他人帮助进食和给予胰高血糖素或静注葡萄糖治疗。
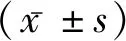
2 结 果
2.1体重、FBG、PBG及HbA1c比较 两组治疗后体重、FBG、PBG及HbA1c均明显降低(P<0.05),预混组PBG、HbA1c均低于基础组(t=2.349、2.790,P<0.05),两组体重、FBG无明显差异(P>0.05)。见表2。
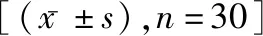
表2 两组治疗前后体重、FBG、PBG及HbA1c比较
注:与治疗前比较,*P<0.05。
2.2HOMA-β、HOMA-IR、空腹及餐后C-P比较 两组治疗后HOMA-β、空腹及餐后C-P均明显升高,HOMA-IR均明显降低,预混组变化幅度大于基础组,差异有统计学意义(t=4.643、2.279、3.677、3.030,P<0.05)。见表3。
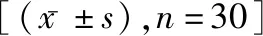
表3 两组治疗前后HOMA-β、HOMA-IR、空腹及餐后C-P比较
注:与治疗前比较,*P<0.05。
2.3胰岛素用量、达标率及低血糖发生率比较 基础组胰岛素用量低于预混组(P<0.05),血糖达标时间长于预混组(P<0.05),两组HbA1c达标率无显著差异(P>0.05),基础组轻度低血糖1例,预混组轻度低血糖3例,两组均未出现重度低血糖事件。见表4。
表4 两组胰岛素用量、达标率及低血糖发生率比较
3 讨 论
据统计,我国T2DM患者血糖控制不良占70%左右,治疗不达标,尤其是单纯服用口服药的患者[6]。英国前瞻性糖尿病研究显示,T2DM患者在确诊时有约50%的患者胰岛β细胞丧失了功能,并随着病程的进展而不断衰退,导致血糖控制不良,而高血糖又会加重胰岛素分泌反应缺陷,形成一种恶性循环[7]。在我国2013年的T2DM防治指南中,已对各种口服药进行了细分,如二甲双胍、胰岛素促泌剂、噻唑烷二酮等,也明确指出口服药失效的患者需使用胰岛素进行干预,如基础或预混胰岛素,但临床中胰岛素起始治疗方案较混乱[8-9]。
甘精胰岛素是一种新型的长效胰岛素类似物,通过基因工程技术将人胰岛素A链第21位的门冬氨酸替换为甘氨酸,增强分子间的结合力,溶解度降低,注入人体后吸收缓慢,药效能维持24 h,无明显的波峰和波谷,较好的模拟人生理性基础胰岛素分泌[10]。门冬胰岛素30是目前最常用的预混胰岛素类似物,含30%可溶性门冬胰岛素和70%精蛋白门冬胰岛素,通过基因重组技术将人胰岛素B链上排第28位的脯氨酸替换为门冬氨酸,增加了分子间的排斥力,缩短解聚时间,加快起效时间,在注射10min后便可起效,其高峰时间相当于可溶性人胰岛素的一半,仅30~60 min,与鱼精蛋白结晶结合后起到基础胰岛素的作用,能更好地模拟生理胰岛素的作用[11]。本研究结果显示,两组治疗后体重、FBG、PBG及HbA1c均明显降低,预混组PBG、HbA1c均低于基础组,两组体重、FBG无明显差异,基础组血糖达标时间长于预混组;说明门冬胰岛素30具有快速降血糖的优势,降糖效果优于甘精胰岛素。
既往研究[13]表明,当FBG>7.8 mmol/L时,β细胞功能已丧失75%,但在糖尿病早期阶段,β细胞功能的损害是可逆的,但长期慢性高血糖会直接刺激β细胞过度分泌胰岛素,导致β细胞胰岛素储备耗竭,损害胰岛β细胞功能,破坏β细胞结构,致使β细胞数量减少和凋亡[12]。因此,要保护β细胞功能,延缓其衰竭必须尽早控制血糖,同时减少β细胞分泌压力,让β细胞休息,使β细胞功能逐渐恢复,从而达到稳定病情和延缓糖尿病病程进展的目的。杨彩娴等[14]研究指出,外源性补充胰岛素能部分恢复剩余的胰岛β细胞功能,下调胰岛素抵抗,促进胰岛β细胞功能的修复。本研究中,两组治疗后HOMA-β、空腹及餐后C-P均明显升高,HOMA-IR均明显降低,预混组变化幅度大于基础组,提示门冬胰岛素30更有助于口服药失效T2DM患者胰岛β细胞功能的恢复。另外,本研究结果还显示,基础组轻度低血糖1例,预混组轻度低血糖3例,两组均未出现重度低血糖事件,提示门冬胰岛素30与基础胰岛素一样,能较好的模拟生理胰岛素的作用,减少低血糖的发生。
综上所述,对于口服药失效的T2DM患者,门冬胰岛素30(起始剂量0.4 U/kg)能在短时间内获得理想的血糖控制效果,促进胰岛β细胞功能的恢复,且并未增加低血糖发生率。本研究实验设计来源于长期临床实践,为口服药失效的T2DM患者的胰岛素起始治疗提供了临床依据,但样本量较少,仍需进一步扩大样本量研究。
