炎症状态下终末期肾病大鼠肾脏Klotho蛋白表达及血管钙化的关系*
2019-10-12郭莉李建东郭珊珊陈航龚幼兰张亚璞
郭莉, 李建东, 郭珊珊, 陈航, 龚幼兰, 张亚璞
(河北大学附属医院 肾脏内科, 河北 保定 071000)
慢性炎症引起的终末期肾病(end-stage renal disease,ESRD)极易引发血管钙化和动脉粥样硬化等并发症[1],钙磷代谢紊乱是血管硬化的常见危险因素之一,而高磷血症又是血管钙化的重要诱因[2]。Klotho蛋白是一种骨-肾内分泌轴蛋白,与衰老密切相关,主要在肾脏表达,正常生理情况下Klotho蛋白参与维持机体磷和维生素D的平衡[3-4]。研究发现,当肾功能出现下降时,Klotho蛋白表达减少[5],而Klotho蛋白的缺乏有可能会导致血管钙化[6]。ESRD患者体内常常伴随有炎症的发生[7-8],关于ESRD患者炎症状态与Klotho蛋白表达是否有关的报道较少,本研究通过检测ESRD大鼠炎症状态时的多项血管钙化指标,探讨Klotho蛋白与炎症状态下ESRD大鼠血管钙化的关系。
1 材料与方法
1.1 主要试剂、仪器及动物
1.1.1主要试剂及仪器 腺嘌呤、酪蛋白购自迈新生物技术有限公司,血清钙(Ca)、磷(P)、肌酐(SCr)、尿素氮(BUN)试剂盒购自北京北方生物研究所,Klotho蛋白、大鼠丙二醛(MDA)、过氧化氢酶(CAT)及甲状旁腺激素(iPTH) ELISA试剂盒购自美国Sigma公司,大鼠Klotho免疫组化试剂盒购自北京博奥森生物技术有限公司。
1.1.2实验动物 SPF级成年健康雄性SD大鼠30只,体质量250 g,由中国食品药品检定研究院提供[许可证号SCXK(京)2016-0017]。实验的整个过程对SD大鼠处置均符合《关于善待实验动物的指导性意见》标准。
1.2 方法
大鼠适应性喂养5 d,参考文献[9-10]将大鼠随机分均为对照组(灌胃生理盐水)、ESRD组(灌胃250 mg/kg腺嘌呤)、ESRD合并炎症组(灌胃250 mg/kg腺嘌呤,隔日以1.0 g/kg皮下注射10%酪蛋白),各组大鼠连续灌胃10周。
1.3 检测指标
连续灌胃10周后,禁食12 h后称重,按0.3 mL/100 g体质量给予10%水合氯醛腹腔注射进行麻醉,麻醉后各组大鼠通过腹主动脉收集血液,3 000 r/min离心分离血清,采用化学比色法检测血清Ca、P、BUN及SCr,采用ELISA法检测血清iPTH水平;取血麻醉后处死大鼠,取大鼠肾脏组织,去除肾脏包膜,纵切面切开肾脏,1/3置于4%多聚甲醛固定,其余-80 ℃冰箱冻存。多聚甲醛固定的肾脏组织石蜡包埋、切片,采用免疫组化法检测Klotho蛋白在肾脏组织的原位表达,HE染色后显微镜下观察肾组织形态学改变,茜素红染色后显微镜下观察肾组织钙盐沉积。取-80 ℃冻存的肾组织块置于研钵内,用移液器按1 ∶9的比例取预冷的匀浆介质(0.9%氯化钠)在冰上碾磨6~8 min,充分碾碎,使组织匀浆化,低温低速3 000 r/min,离心15 min,离心好的匀浆留取上清液,采用ELISA法测定肾组织匀浆上清液中Klotho蛋白水平、MDA及CAT含量。
1.4 统计学方法

2 结果
2.1 血清P、Ca、SCr、BUN及iPTH
灌胃10周时, ESRD组、ESRD合并炎症组大鼠血清P、SCr、BUN及iPTH浓度显著高于对照组,差异有统计学意义(P<0.01);ESRD组与ESRD合并炎症组血清P、SCr、BUN及iPTH浓度比较,差异无统计学意义(P>0.05);各组大鼠血清Ca浓度比较,ESRD组 大鼠肾脏组织匀浆中Klotho蛋白和CAT水平表现为ESRD合并炎症组 血清指标对照组ESRD组ESRD合并炎症组P(mmol/L)2.02±0.115.21±0.35(1)5.36±0.29(1)Ca(mmol/L)2.66±0.232.14±0.15(2) 2.47±0.32(2) (3)SCr(μmol/L)63.47±5.93268.91±10.55(1)260.73±11.98(1)BUN(mmol/L)7.18±0.9227.44±2.51(1)34.19±3.75(1)iPTH(ng/L)30.42±4.2843.61±5.90(1)45.49±4.86(1) 注:与对照组比较,(1)P<0.01,(2)P<0.05;(3)与ESRD组比较,P<0.05。 表2 各组大鼠肾脏组织匀浆中Klotho蛋白表达水平、MDA及CAT含量比较Tab.2 Comparison of Klotho protein expression, MDA and CAT content in renal homogenate of rats in each group 注:(1)与对照组比较,P<0.01;(2)与ESRD组比较,P<0.05。 免疫组化染色结果显示,Klotho蛋白表达主要集中在肾小管,正常对照组Klotho蛋白表达较多,ESRD组和ESRD合并炎症组Klotho蛋白的表达减少,ESRD合并炎症组表达最弱,ESRD组、ESRD合并炎症组显著低于对照组,差异有统计学意义(P<0.05)。见图1,表3。 HE染色结果显示,正常对照组大鼠肾小球、小管间质、肾血管均正常,而ESRD组呈现系膜区增宽,肾小球、肾小管纤维结缔组织增生显著,出现炎性细胞浸润,ESRD合并炎症组出现肾小球萎缩和硬化。见图1。 表3 各组大鼠肾脏组织Klotho蛋白表达水平Tab.3 Expression of Klotho protein in kidney of rats in each group 注:(1)与对照组比较,P<0.05。 茜素红染色结果显示,正常对照组无钙化,ESRD组肾内小动脉及周围组织有少许点片状钙盐沉积,而ESRD合并炎症组肾内小动脉及周围组织有较多红色点片状钙盐沉积,肾内小动脉存在明显钙化现象。见图1。 注:A、B、C为Klotho蛋白表达(免疫组织化学,×200,箭头为表达阳性),D、E、F为组织形态学(HE,×200,箭头为系膜区增宽),G、H、I为钙盐沉积(茜素红,×400,红色示钙盐沉积)。图1 各组大鼠肾脏组织Klotho蛋白表达、组织形态学及钙盐沉积Fig.1 Expression of Klotho protein in kidney tissue of rats in each group 血管钙化是一种常见、发生于血管系统软组织的生物钙化,磷酸钙矿物质在各种血管组织中的沉积是其典型表现,可导致血管中层厚度增加或硬化斑块的形成,临床多见于老龄、高血压、肾功能不全者等[11-13]。本课题组已报道,ESRD患者高磷血症与血管硬化密切相关,血磷水平是影响患者血管情况的重要因素。本研究观察了血清Ca、P、SCr、BUN及iPTH的水平,结果显示,与正常对照组相比,ESRD组、ESRD合并炎症组大鼠血清Ca均降低,而血清P和iPTH却显著升高。提示ESRD时大鼠肾功能减退,限制机体对钙的吸收,进而引起血清中低血钙的发生;但由于肾功能障碍,导致肾脏排泄磷的能力的减弱,所以会引起大鼠血清P水平的升高;而低钙高磷血症又对iPTH的分泌产生刺激,加剧iPTH水平的上升。因此,抑制甲状旁腺功能亢进或iPTH的分泌也可成为临床防治血管钙化的有效措施之一。 Klotho蛋白与多种生物学功能相关,在肾病发生、发展过程中起到关键性作用[14]。有研究表明:Klotho基因的表达多少与肾衰竭的发生密切有关,过表达可减轻肾脏氧化应激造成的损伤,对肾脏产生一定的保护作用[15];而ESRD患者体内常常伴有炎症的发生,CAT是一类末端氧化酶,为生物防御系统的关键酶之一,可防止细胞内过氧化;MDA是脂质过氧化的终产物,可间接反映细胞受自由基攻击的损伤程度,二者可以反映慢性肾脏病患者体内氧化应激水平[16]。本研究检测炎症状态下ESRD大鼠的Klotho蛋白浓度、CAT含量、MDA含量,实验结果显示:对照组大鼠肾组织中CAT含量较高,而ESRD组与ESRD合并炎症组大鼠CAT含量均显著下降(P<0.01);与对照组比,ESRD组与ESRD合并炎症组大鼠MDA显著升高(P<0.01);免疫组化染色Klotho蛋白表达主要集中在肾小管,ESRD组和ESRD合并炎症组Klotho蛋白的表达明显减少(P<0.05),且ESRD合并炎症组大鼠的表达最弱;提示ESRD患者在炎症状态时,Klotho蛋白减少与CAT含量下降、MDA含量升高有关,推测Klotho蛋白可能通过防止细胞内过氧化和避免细胞受自由基攻击来保护肾小管上皮细胞,从而在ESRD时保护组织免受炎症的伤害。 HE染色结果提示:对照组大鼠肾小球、小管间质、肾血管均正常,而ESRD组呈现系膜区增宽,肾小球、肾小管纤维结缔组织增生显著,出现炎性细胞浸润,ESRD合并炎症组出现肾小球萎缩和硬化;茜素红染色显微结果显示:ESRD组肾内小动脉及周围组织有少许点片状钙盐沉积,而ESRD合并炎症组肾内小动脉及周围组织有较多红色点片状钙盐沉积,肾内小动脉存在明显钙化现象。上述结果提示在ESRD时,炎症可作为一种危险因素促进血管钙化,与Klotho蛋白下降有关。有体外实验证明,Klotho蛋白能直接抑制磷诱导的血管平滑肌细胞钙化,阻碍血管平滑肌细胞向成骨细胞转化[17]。推测Klotho蛋白可能是血管钙化的抑制因子,机制可能为:(1)Klotho蛋白通过加强FGF-23活性促进肾脏磷的排泄;(2)过表达Klotho可延缓CRF进展,阻碍由于肾功能恶化导致的矿物质代谢紊乱和其他血管钙化的因素[18]。Hu等[19]研究显示:KLotho过表达的CKD基因小鼠具有较高的Klotho蛋白水平,且小鼠有较好的残存肾功能。 综上所述,甲状旁腺功能亢进和钙磷代谢紊乱可以启动血管钙化。炎症状态可加速ESRD血管钙化的进程,而Klotho 蛋白对ESRD血管具有一定的保护作用,可改善高磷血症以及内皮细胞损伤,减少血管疾病的发生与发展,具有重要的临床参考价值。2.2 肾组织匀浆中Klotho蛋白、MDA及CAT水平


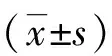
2.3 肾组织Klotho蛋白表达
2.4 肾脏组织组织形态学
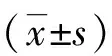
2.5 大鼠肾组织钙盐沉积

3 讨论
