双吲哚马来酰亚胺衍生物GZWM-051对HEL细胞周期及分化的影响*
2019-10-12刘务玲姚尧陈娟吴昌学宋晶睿王春林邱剑飞王立平朱伟明龙群李艳梅
刘务玲, 姚尧, 陈娟, 吴昌学, 宋晶睿, 王春林, 邱剑飞, 王立平, 朱伟明,3, 龙群**, 李艳梅**
(1.贵州省中国科学院 天然产物化学重点实验室, 贵州 贵阳 550014; 2.贵州医科大学, 贵州 贵阳 550025; 3.中国海洋大学, 山东 青岛 266100)
白血病(leukemia)是危害人类健康的恶性血液疾病[1],美国癌症协会预测2019年美国将有22 846人死于白血病,并且白血病仍会是第六大癌症[2]。目前,白血病的主要治疗方法是化疗和放疗[1],但白血病细胞对化疗药物的耐药性是临床治疗的主要障碍[3]。因此,探索新的白血病化疗药物具有重要的医学意义。已有研究显示,诱导细胞分化可作为一种有效抑制多种癌症细胞的新思路[4-5],且细胞周期检查点抑制剂对白血病、实体肿瘤有一定的治疗效果[6],这使通过细胞分化和细胞周期阻滞途径抑制癌细胞增殖的化合物有着重要的应用前景。1982年,Martin等[7]科学家首次报道从白血病病人外周血中分离并建立了HEL(human erythroleukemia)细胞系,自此HEL细胞系作为人白血病细胞模型广泛用于科学研究[8-11]。双吲哚马来酰亚胺及其衍生物主要用于抑制蛋白激酶C(protein kinase C,PKC)[12-13],但双吲哚马来酰亚胺衍生物GZWM-051(简称化合物GZWM-051)对白血病细胞的周期及分化的影响未见报道。因此,本研究就化合物GZWM-051对HEL细胞系的周期及分化的影响进行探讨,报告如下。
1 材料与方法
1.1 主要材料和仪器
1.1.1细胞、药物和试剂 人红白血病HEL细胞系为贵州省中国科学院天然产物化学重点实验室保存。化合物GZWM-051由中国海洋大学朱伟明教授课题组设计合成,相对分子量为638,纯度95%以上。细胞分化抗体CD61、CD41a、CD235a、CD71购自美国Thermo Fisher公司,PBS缓冲液、二甲基亚砜(dimethyl sulfoxide,DMSO)、细胞周期碘化丙啶(propidium iodide, PI)染料及RNAase及试剂购自北京索莱宝科技有限公司,蛋白裂解液(radio-immunoprecipitation assay,RIPA)、BCA蛋白浓度测定试剂盒和SDS-PAGE凝胶快速配置试剂盒购于上海碧云天生物技术有限公司,PVDF膜购于美国Bio-Rad公司,蛋白内参(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、c-Myc、Cyclin B1、STAT3(signal transducer and activator of transcription 3)、P-STAT3(phosphorylated signal transducer and activator of transcription 3)抗体购自美国Abcam公司,荧光标记抗兔二抗购自美国CST公司。
1.1.2主要仪器 Microfuge 20R冷冻离心机购自美国Beckman公司,SDS-PAGE电泳转膜仪购自美国Bio-Rad公司产品,Synergy2酶标仪购自美国Bio-Tek公司,NovoCyte 2040R流式细胞仪购自杭州安捷伦生物有限公司,Odyssey CLX双色红外激光成像系统购自美国LI-COR公司。
1.2 实验方法
1.2.1细胞周期测定 取2×106个对数生长期细胞,铺于6孔板中,分别加入0.025、0.050、0.100 μmol/L化合物GZWM-051作为低剂量、中剂量和高剂量组,以DMSO为对照组;作用24 h后,用离心管收集细胞,1 500 r/min离心5 min,弃上清液;用PBS轻轻冲洗细胞,洗3次;接着1 500 r/min离心5 min,弃上清液;加入75%乙醇1 mL固定细胞,置-20 ℃固定处理过夜;取出样品1 500 r/min离心5 min去除乙醇上清液,用PBS洗涤细胞后去除上清液;加入500 μL的 PBS重悬细胞,转移至1.5 mL离心管中,加入RNAase酶、PI染液使其终浓度分别为100 mg/L和50 mg/L;轻轻混匀,置37 ℃避光处理1 h;用1 mL的PBS洗涤细胞1次,并1 500 r/min离心5 min,弃上清液;用适量PBS重悬细胞沉淀,后用流式细胞仪检测并分析HEL细胞周期分布。
1.2.2细胞分化分析 收集生长状态良好的细胞,放入离心机1 500 r/min离心5 min,弃去上清液;用培养基重悬细胞,进行细胞计数后,铺6孔板,每孔2×106个;加入1.2.1项下化合物GZWM-051低、中、高剂量作用48 h,用离心管收集细胞,1 500 r/min离心5 min,弃去上清液;用PBS重悬细胞,进行细胞计数后,调整细胞密度至1×1010个/L;取100 μL转移至1.5 mL离心管,加入分化抗体进行染色:对于巨核分化检测,加入CD61-APC抗体及CD41a-FITC抗体各2 μL至细胞悬液;对于红系分化检测,则加入CD235a-APC抗体及CD71-FITC抗体各2 μL至细胞悬液;加入分化抗体后混匀,置冰上染色1 h,用流式细胞仪进行检测并分析HEL细胞CD61、CD41a、CD235a及CD71的百分比分布。
1.2.3Western blot测定 取2×106个对数生长期稳定生长细胞,铺于6孔板中,加入1.2.1项下化合物GZWM-051低、中、高剂量,同时以DMSO为对照组;处理48 h,收集细胞,加入适量蛋白裂解液置于冰上作用30 min,12 000 r/min低温离心15 min,取上清液,弃去沉淀。用BCA蛋白浓度测定试剂盒测定蛋白样品浓度,加入5×蛋白上样缓冲液,100 ℃蛋白变性5 min,置于超低温冰箱备用;进行SDS-PAGE凝胶电泳分离(100 V恒压,2 h),将PVDF膜置于甲醇中激活1 min,放入1×转膜缓冲液浸润后转膜(220 mA恒流,2 h);用5%脱脂牛奶进行封闭1 h,一抗孵育过夜;完成一抗孵育后洗膜3次,二抗孵育1 h后洗膜3次,用双色红外荧光成像系统检测和分析HEL细胞的蛋白表达水平。
1.3 统计学分析

2 结果
2.1 细胞周期
流式细胞术检测结果显示,处理24 h后,与对照组HEL细胞相比,化合物GZWM-051中、高剂量组 HEL细胞处于G1和S期细胞数量显著减少,处于G2期的数量显著增加,差异有高度统计学意义(P<0.01)。见图1、图2。
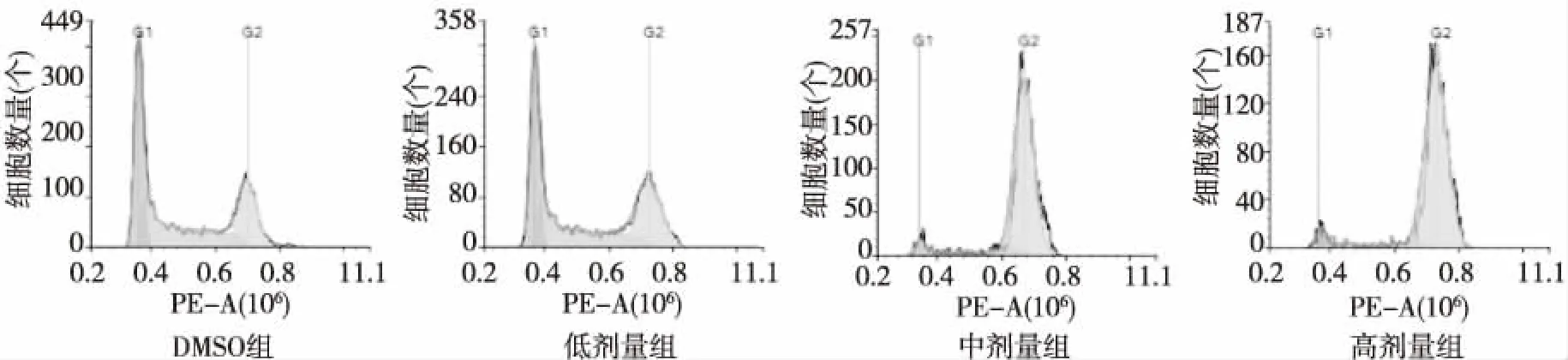
图1 化合物GZWM-051促使HEL细胞G2期阻滞Fig.1 G2 phase arrest induced by compound GZWM-051
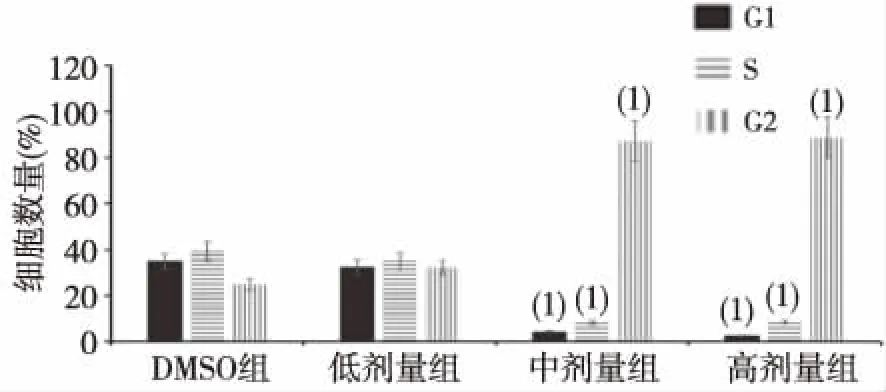
注:(1)与DMSO组比较,P<0.01。图2 化合物GZWM-051处理24 h后HEL细胞周期分布Fig.2 The effect of GZWM-051 on different phrases of cell cycle
2.2 细胞分化
流式细胞术检测结果显示,相比对照组,作用48 h化合物GZWM-051低、中、高剂量组HEL细胞的CD41a和CD71均上调。见图3。
2.3 Cyclin B1、c-Myc、STAT3及P-STAT3蛋白表达水平
Western blot检测结果显示,与对照组HEL细胞对比,中剂量化合物GZWM-051及高剂量化合物GZWM-051组HEL细胞生长相关蛋白c-Myc表达水平降低,差异有统计学意义(P<0.05或P<0.01)。与对照组HEL细胞对比,低化合物GZWM-051、中化合物GZWM-051及高剂量的化合物GZWM-051组HEL细胞的P-STAT3表达水平降低(P<0.05或P<0.01),中、高剂量化合物GZWM-051组HEL细胞周期蛋白Cyclin B1表达水平降低(P<0.05)。见图4。

图3 化合物GZWM-051诱导HEL细胞分化Fig.3 The effect of compound GZWM-051on HEL cell differentiation

注:A为Western blot检测结果,B为蛋白相对表达水平直条图;与DMSO组比较,(1)P<0.05,(2)P<0.01。图4 化合物GZWM-051对HEL细胞Cyclin B1、c-Myc、STAT3及P-STAT3蛋白表达水平的影响Fig.4 Effect of compound GZWM-051 on the expression levels of Cyclin B1、c-Myc、STAT3 and P-STAT3
3 讨论
为了探索不同浓度化合物GZWM-051对HEL细胞的作用效果,本研究检测低剂量(0.025 μmol/L)、中剂量(0.050 μmol/L)、高剂量(0.100 μmol/L)3种浓度对HEL细胞的周期、分化及相关蛋白表达水平的影响。结果显示,化合物GZWM-051低、中、高剂量组HEL细胞的CD41a阳性率均高于对照组,这表明化合物GZWM-051诱导HEL细胞向巨核分化。中、高剂量化合物GZWM-051处理组CD71阳性率高于对照组,表明化合物GZWM-051诱导HEL细胞向红系分化。正常血细胞在骨髓中增殖、分化并成熟,然后进入血液发挥作用,所以大部分血细胞处于高度分化的状态,其蛋白合成及细胞分裂能力较低,寿命大多很短,如中性粒细胞只有几小时,血小板只有几天,红细胞只有几周[14]。然而,大部分癌症细胞尤其是白血病细胞,在细胞成熟的不同阶段分化被阻断而保持未分化状态[15]。因此,诱导癌细胞分化可改变癌细胞的干细胞特征,抑制其恶性增殖。分化疗法是用小剂量的化合物诱导癌细胞分化,将恶性癌症细胞及无用的细胞重新分化成为功能细胞,这被认为是诱导癌细胞死亡和增殖抑制的一种新思路[14,16-17]。相比其他癌症治疗方法,分化疗法可以降低细胞化疗带来的毒副作用,更重要的是可以提高完全缓解和治愈率,且不易产生耐药性[15,18]。化合物GZWM-051处理组HEL细胞的红细胞标志物CD41a及巨核细胞标志物CD71增多,意味着化合物GZWM-051促使HEL细胞发生红系及巨核分化,从而抑制其恶性增殖。因此,该化合物有重要的潜在临床应用价值。许多抗癌药物都能在特定的检查点阻滞细胞周期,从而导致分裂停止[19]。抑制细胞周期已成为抑制癌症进展中最常见的方法之一,已报道的一些化合物可以通过诱导G2周期阻滞进而抑制肿瘤细胞的增殖[20-22]。本研究检测结果显示,处理24 h后,与对照组HEL细胞相比,化合物GZWM-051中、高剂量组HEL细胞处于G1和S期细胞数量显著减少,处于G2期的数量显著增加(P<0.01),这表明化合物GZWM-051诱导HEL细胞阻滞于G2期,从而抑制细胞分裂与增殖。STAT3是STAT蛋白家族中的一员[23]。在细胞因子和生长因子的作用下,STAT3被受体相关的Janus激酶(janus kinase, JAK)磷酸化,并转移到细胞核中,在细胞核中发挥转录激活剂的作用[23]。STAT3介导多种基因在细胞刺激反应中的表达,在细胞生长、凋亡等细胞过程中发挥着关键作用[24-26]。有报道指出,一些影响癌症进展的microRNA,如miR-337-3、miR-17-5p及miR-20a等,通过调控JAK/STAT3信号通路发挥作用[27-28]。JAK/STAT3信号通路还在促进肿瘤干细胞自我更新和分化过程中扮演重要角色[29-30]。不仅如此,STAT3还可通过调控线粒体功能及表观遗传影响癌症进展[24]。因此,可以认为STAT3是癌症治疗的重要靶点。本研究中化合物GZWM-051下调P-STAT3蛋白表达水平(P<0.05),推测其抑制STAT3所在信号通路,从而抑制细胞生长。此外,Cyclin B1对细胞发育至关重要,细胞有丝分裂必须从细胞核中释放Cyclin B1,以防止细胞过早进入有丝分裂[31]。本研究显示化合物GZWM-051可显著下调Cyclin B1表达水平(P<0.05),从而抑制细胞的分裂。c-Myc通常在癌症组织中表达,并引起许多参与细胞增殖及有助于癌症形成的基因表达增加[32-33]。化合物GZWM-051显著下调c-Myc的表达水平(P<0.05或P<0.01),从而进一步抑制细胞分裂。
综上所述,化合物GZWM-051不仅能诱导白血病HEL细胞发生G2周期阻滞,促进其向巨核及红系进行分化,抑制细胞恶性增殖,还能失活STAT3关键通路。因此,化合物GZWM-051是良好的治疗癌症的潜在化合物。
