果胶降解与采后果实质地变化研究进展
2019-10-12李倩倩付佳璇赵玉梅曹建康
李倩倩 付佳璇 赵玉梅 曹建康*
(1中国农业大学食品科学与营养工程学院 北京 100083
2北京联合大学应用文理学院 北京 100191)
果胶是存在于高等植物初生细胞壁和中胶层中的一种酸性多糖物质。果实质地变化与果胶的代谢密切相关。一般地,在后熟软化过程中,果实细胞壁果胶逐渐降解,引起细胞壁结构的完整性受到破坏,使果实质地出现软化。本文综述果胶分子的化学结构和基本结构模型、组分与含量、后熟软化过程中果胶降解模式等,为深入研究果胶与果实质地变化提供参考。
1 果胶分子化学组成与结构模型
果胶是由β-D-半乳糖醛酸(β-D-Galacturonic Acid,GalA)通过α-1,4-糖苷键相互连接而成的部分甲酯化的多聚物。多聚半乳糖醛酸链构成果胶分子的基本主链骨架,在主链上还往往连接有大量的由中性糖组成的侧链。果胶侧链富含α-L-鼠李糖(α-L-Rhamnose,Rha)、α-L-阿拉伯糖(α-L-Arabinose,Ara)、 β-D-半乳糖(β-D-Galactose,Gal)等 20余种中性糖[1-2]。根据果胶分子结构中主链和侧链的组成不同,可以将其分为同型半乳糖醛酸聚糖(Homogalacturonan,HG)、鼠李糖半乳糖醛酸聚糖-Ⅰ(Rhammogalacturonan-I,RG-Ⅰ)、鼠李糖半乳糖醛酸聚糖-Ⅱ(Rhammogalacturonan-Ⅱ,RG-Ⅱ),以及木糖半乳糖醛酸聚糖(Xylogalacturonan,XGA)和芹菜糖半乳糖醛酸聚糖(Apiogalacturonan,AGA)[3]。这些不同果胶多聚物之间大多以共价键相连。关于它们之间的连接方式,目前已提出多个模型。Visser等[4]认为HG、RG-I和RG-II形成了一个连续的构架,其中,由线性HG构成的“光滑区”和由RG-I和RG-II构成的“毛发区”交替存在(图1a)。Vincken 等[1]提出了另一种模型,即RG-I作为主链,HG及阿拉伯糖和半乳糖为长侧链(图1b)。另外,Yapo[5]还提出了一种“living thing-like”模型,认为果胶分子的主链结构是由两个线型的HG和一个RG-I交替连接。
1.1 HG
HG是由约100~200个β-D-半乳糖醛酸残基通过α-1,4-糖苷键相连接而成的线性果胶分子([(1→4)-α-D-GalA]n),是细胞壁中含量最多的果胶多聚物,约占细胞壁总果胶的60%~65%。其中,有些半乳糖醛酸残基C-6羧基会被甲酯化(图1a),有些半乳糖醛酸残基O-2或O-3可能会发生乙酰化[6]。HG链的甲酯化程度和形式在很大程度上决定了果胶的功能特性[7-8]。未被甲酯化的β-D-半乳糖醛酸残基带负电荷,会与Ca2+通过离子键发生交联。当10个以上未酯化的半乳糖醛酸残基与钙离子相连时即可形成一个稳定的凝胶结构,这种HG-Ca模型又被称为 “蛋壳模型”[8](图2)。但是,乙酰基团的存在会阻碍HG与Ca2+的连接。果胶分析结构中的HG与细胞壁多孔性、完整性和机械强度都密切相关;HG-Ca模型在增强细胞壁机械强度、增加细胞之间的相互粘附方面具有一定作用。
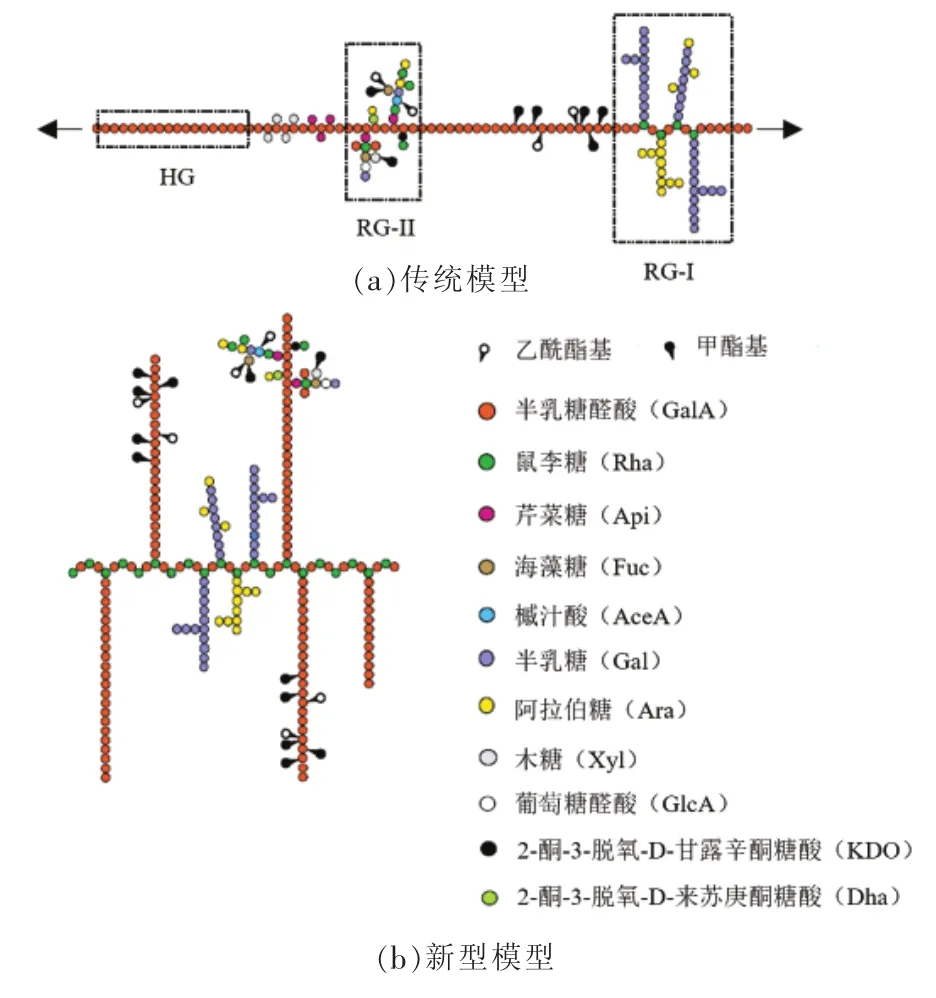
图1 果胶的基本结构模型[9]Fig.1 The basic structure of pectin
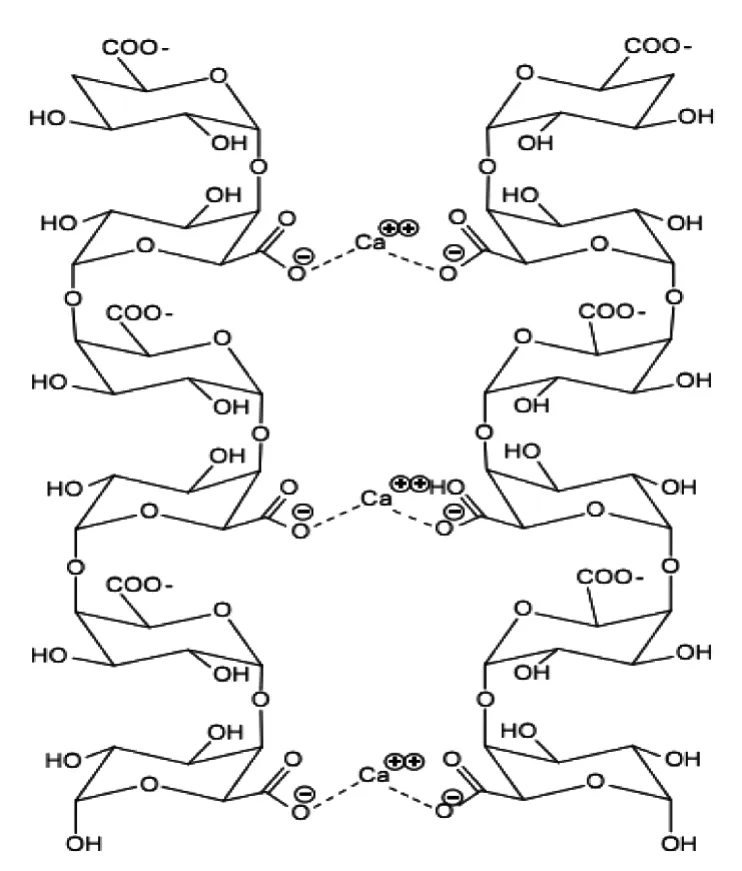
图2 HG-Ca连接而成的蛋壳模型[9]Fig.2 The ‘Egg model’ derived from the crosslinking of HG-Ca
1.2 RG-I
RG-I是一类含有较多复杂结构侧链的果胶多聚物。RG-I是由β-D-半乳糖醛酸和α-L-鼠李糖通过α-1,2-和α-1,4-糖苷键连接的重复二糖单元([→a-D-GalA-1,2-α-L-Rha-1,4→]n)构成主链骨架,约有一半的鼠李糖残基在C-4上带有富含多聚半乳糖或多聚阿拉伯糖的侧链[10](图1a)。RG-I约占细胞壁总果胶的20%~35%。RGI中的半乳糖醛酸残基在O-2或O-3上也可能会被乙酰化。在苋科类植物(如甜菜和菠菜)中,RGI侧链上的阿拉伯糖残基和半乳糖残基能分别与阿魏酸在O-2和O-6上发生酯化反应,这些阿魏酸酯能够进行氧化耦合反应,进而形成脱氢二聚体,以进一步形成果胶网状结构[11]。RG-I和木葡聚糖之间还可以通过共价键连接,形成稳定性的结构[12]。
1.3 RG-II
RG-Ⅱ在细胞壁果胶中所占比例约为10%[6]。它由约7~9个半乳糖醛酸残基相互连接形成主链骨架,带有5个固定的侧链基团。这些侧链由富含鼠李糖的多聚糖构成,含有12种不同的糖基,包括一些稀有糖类,如2-O-甲基木糖、2-O-甲基海藻糖、槭汁酸、2-酮-3-脱氧-D-来苏庚酮糖酸和2-酮-3-脱氧-D-甘露辛酮糖酸等[13-14]。RG-II分子是自组装起来的,硼酸盐可通过硼酯键与侧链中的芹菜糖残基(Apiose,Apif)相连接形成RG-II果胶多糖二聚体[15]。
1.4 XGA和AGA
XGA是HG中的半乳糖醛酸残基在C3位置被 D-木糖残基取代([Xylp-(1,2)-Xylp-(1,3)-GalpA])形成的分支结构,主要存在于大叶藻科海草和豆科植物中。AGA也是HG中半乳糖醛酸残基在C2或C3位置被D-芹菜糖取代形成的芹菜糖聚半乳糖醛酸,主要存在于水生植物如浮萍和海草中[6]。
2 采后果实果胶含量的变化
不同种类果实的果胶含量差异很大(表1)。其中,柑橘皮、甜菜根和苹果渣中果胶含量较高,是商业果胶的主要来源。果实的发育成熟、与衰老程度对果胶含量有较大影响。一般地,成熟度较低的果实果胶含量较高,而成熟高的果实果胶含量较低。“Gala”苹果在花后70 d总果胶含量最高,在之后发育过程中一直降低,在采后贮藏20周时进一步降低[16]。高成熟度的“Friar”李总果胶含量比中成熟度的低[17]。此外,不同果实组织中果胶含量也有较大差异。果皮、果渣的果胶含量比其果肉部分果胶含量高,如柑橘[18]、柚子[19]、西葫芦[20]、百香果[21]、木瓜[22]等果实果皮中果胶含量都相比果肉中较高。苹果[23]、番茄[24]、甘薯[25]和辣椒[26]等加工废渣中果胶含量也很高,颇具利用价值。但是,有些果实果肉却含有较丰富的果胶,如苹果[16]、李[17,27]、梨[28]、南瓜[29]、胡萝卜[30]等。
果胶的提取、分离方法对果胶含量也有较大的影响,同时还极大地影响果胶的得率和提取效率。果胶提取的方法主要有传统酸提法、碱提法、酶法、微生物法、微波辅助提取法、超声波辅助提取法、离子交换法、草酸铵提取法等(表1)[38]。果胶含量的数值还受到测定方法的影响。目前,果胶的测定方法主要有咔唑比色法和间羟基联苯法(表1)。利用强酸将果胶水解生成半乳糖醛酸单体,与咔唑试剂发生缩合反应生成紫红色化合物,该化合物呈色强度与半乳糖醛酸溶液浓度成正比,可利用半乳糖醛酸含量来表示果胶含量。但果胶中的中性糖可与硫酸-咔唑形成棕色衍生物,干扰测定结果的准确性[39]。后来用间羟基联苯取代咔唑试剂,测定结果误差有所减小,但各文献报道差异较大[40-41]。
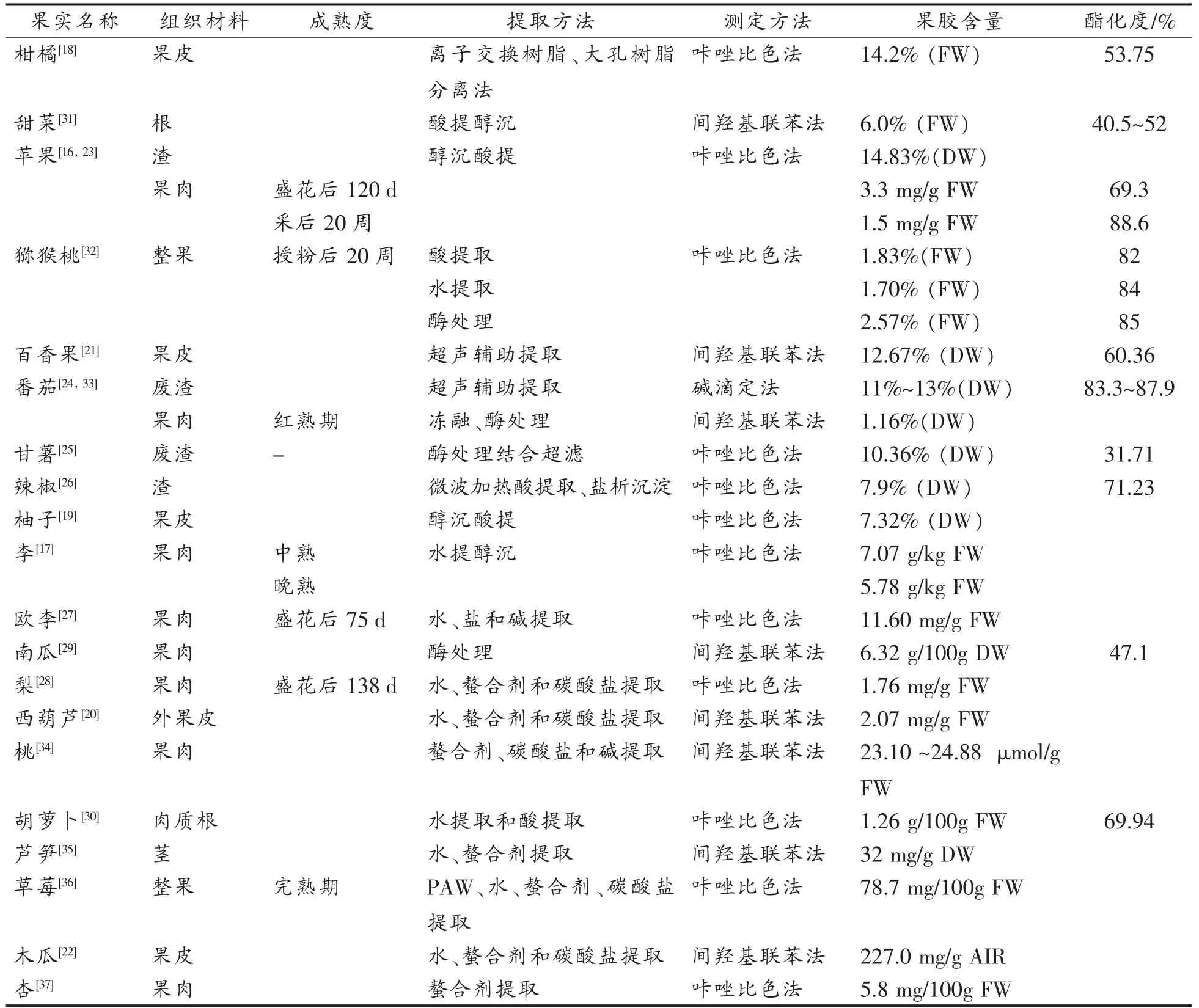
表1 采后果实果胶含量Table 1 Pectin contents in some fruits
3 采后果实中不同溶解性果胶组分的变化
由于果胶在细胞壁中存在状态不同,表现出了不同的溶解性[42]。用热乙醇溶液蒸煮果实原料以去除不溶性糖分,得到细胞壁乙醇不溶物(Alcohol insoluble residues,AIR)。利用水或苯酚、乙酸和水的混合液(Phenol/Acetic acid/Water,PAW)溶解AIR即可得到水溶性果胶(Water-soluble pectin,WSP)。WSP主要为那些能溶解在细胞质和细胞间隙溶液中的果胶组分。再利用螯合剂(一般为EDTA)从沉淀物中溶解所得的果胶为螯合剂溶解性果胶(Chelate-soluble pectin,CSP),主要为那些与细胞壁其它成分以离子键或氢键相结合的果胶,还有以钙桥结合在“蛋壳模型”中的果胶。CSP又称离子结合型果胶,主要位于中胶层,其中的多聚半乳糖醛酸含量很高。最后再用Na2CO3溶液从沉淀物中提取碱溶性果胶(Sodium carbonate-soluble pectin,SSP),主要是以共价键和纤维素等细胞壁成分紧密结合的果胶。SSP又称共价结合型果胶,主要位于初生壁中,其中的RG-I含量较高,所以中性糖与糖醛酸之比值较高[43]。
果实在采后质地软化过程中,WSP含量往往显著上升,有的果实CSP含量也会上升,相应地,与细胞壁紧密结合的SSP含量一般会减少[43-45]。如梨在贮藏18d后WSP含量为采收时的2.3倍,CSP含量为采收时的2.9倍,而SSP含量却下降了72%[28]。西葫芦在贮藏过程中外果皮WSP和CSP含量均有所上升,而SSP含量下降[20]。梨采后软化过程中,SSP可转变形成WSP,经长期贮藏后WSP又可进一步分解成小分子物质脱离出细胞壁物质[46]。然而有些果实如某些品种的桃[47]、枣[48]等,在采后质地变化过程中,各种溶解性果胶组分含量均有所上升,但WSP含量上升幅度仍最大。还有些果实各果胶组分变化不明显,如某些品种的苹果,从贮藏初期到衰老过程中,果胶各组分变化很小[49]。相反,有些果实如番茄[50]、草莓[51]等在后熟软化过程中SSP含量上升幅度很大,而WSP和CSP上升幅度则较小。可见,果实细胞壁中不同溶解性果胶代谢模式并不是此消彼长的关系。在果实成熟软化过程中,细胞壁组分(包括果胶)会发生溶解、侧链断裂、解聚、去甲酯化、直接降解和溶胀等多种变化,从而影响果实质地变化的模式。
4 采后果实果胶中性糖组成变化
不同溶解性果胶组分的中性糖组成都是以半乳糖、阿拉伯糖和鼠李糖为主,还有甘露糖、木糖、葡萄糖和岩藻糖等[50](图1)。中性糖主要存在于RG-I和RG-II的侧链中。中性糖链通过化学键与半纤维素、纤维素等相结合从而将果胶分子锚定在细胞壁上[12,52]。果胶分子间也会通过中性糖侧链发生物理缠绕。果实后熟软化过程中,在细胞壁β-糖苷酶作用下,果胶侧链中性糖会被水解而丢失,果胶多聚物会逐渐解聚和降解,果胶与细胞壁成分的结合力减弱,进而为果胶水解酶作用于其底物打开了接触的通道,间接诱导了降解物片段逐渐溶解[53]。
不同溶解性果胶组分的中性糖含量变化有较大差异。绿熟番茄SSP中中性糖主要为半乳糖、鼠李糖和阿拉伯糖等,它们的含量都远远高于WSP和CSP组分中相应的中性糖含量[50]。但在贮藏过程中,番茄WSP中性糖含量显著增加,CSP中性糖含量也有所增加,而SSP中性糖含量却显著减少[50]。西葫芦在采后14 d内,WSP中性糖含量先上升再下降,变化幅度不大,CSP中性糖含量缓慢下降,而SSP中性糖含量急剧下降[20]。不同种类的中性糖,变化趋势也不一致。如猕猴桃在成熟过程中,鼠李糖含量上升,阿拉伯糖、半乳糖、甘露糖、木糖、葡萄糖和海藻糖含量均下降[32]。然而,在有些果实中,中性糖减少与果胶降解没有直接关系,例如,当李果实中果胶大量降解时,阿拉伯糖和半乳糖并没有明显减少;当苹果和沙梨中半乳糖大量减少时,果胶也并没有发生显著降解[54]。
5 采后果实果胶多聚物的解聚
原子力显微镜(AFM)技术的发展为研究果胶多聚物纳米结构的变化提供了有力的工具。利用AFM技术可得到果胶多聚物样品表面的三维立体图像,通过对图像的解析可获得果胶分子纳米结构特征[65]。表3列举了一些果实中不同溶解性果胶组分的链长以及链宽。在果实质地软化过程中,果胶多聚物会在一系列细胞壁水解酶的作用下发生解聚,主要表现为聚合物的数量减少,果胶链长度变短,果胶链宽度缩小。其中,以SSP组分中果胶多聚物纳米结构的变化最为显著。如未成熟樱桃比成熟果实果胶拥有更宽和更长的SSP链,SSP片段数量更多并且缠绕得更紧密[56]。Yang等[59]分析了两种不同质地(软质和脆质)的桃果实中3种组分果胶多聚物分子纳米结构,发现最大的区别在于两种类型果实的SSP长度不同,脆质桃果实SSP长度(249 nm)比软质桃的(57 nm)长得多。另外,脆质桃果实CSP和SSP果胶链带有侧链,而软质桃果胶组分中没有或很少有侧链。
CSP果胶组分的结构也可能对果实质地有明显的影响。如番茄果实从转色期到半熟期时,CSP链宽度减小,线型的、单一的、短的果胶链明显增多[64]。枣果实CSP果胶链长度也随着果实成熟而减小[48]。未成熟的草莓果实CSP组分中长链果胶较多,而成熟草莓中较短的链多;侧链聚合物在未成熟和成熟草莓中出现的程度要高[63]。
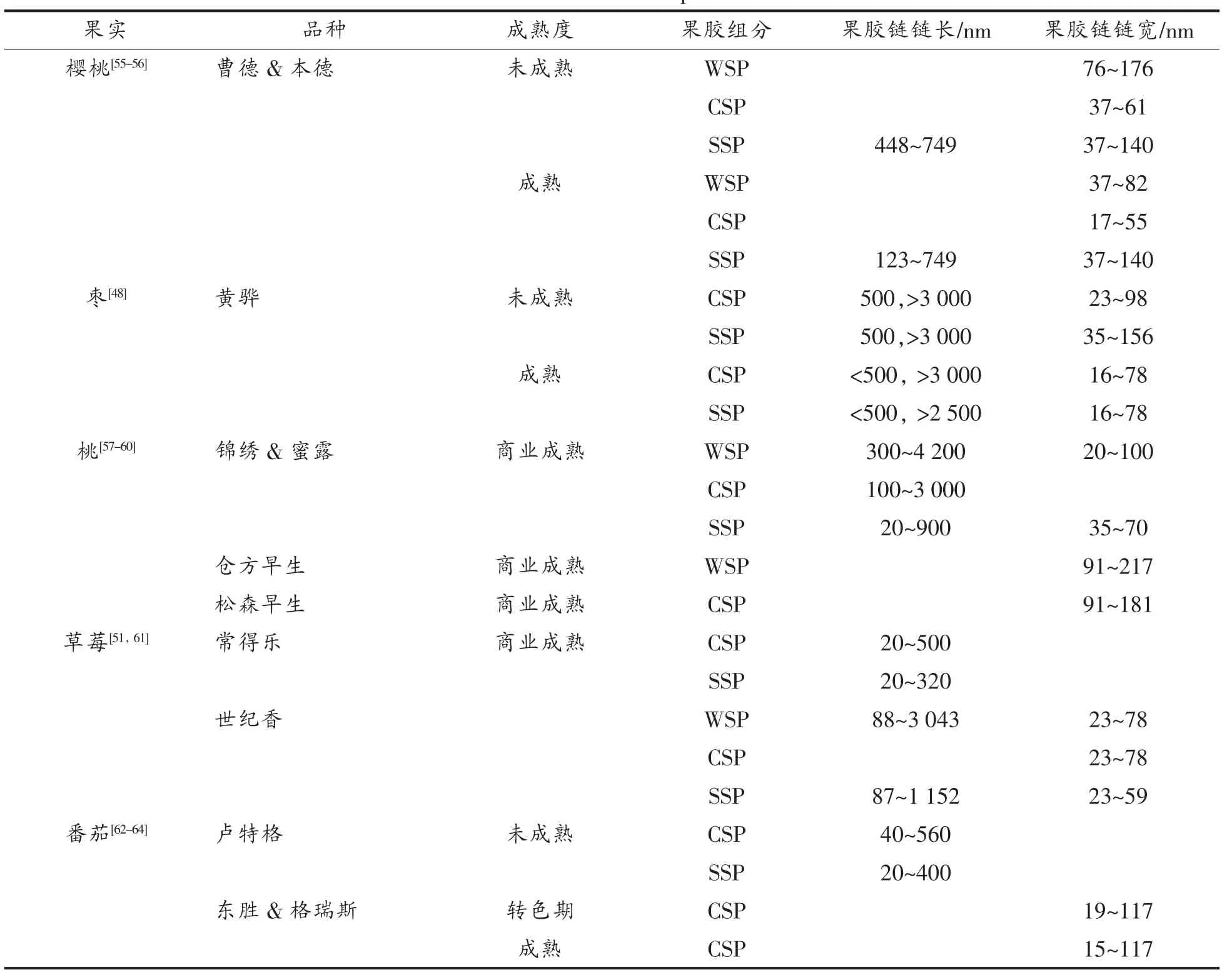
表2 果实不同溶解性果胶组分的纳米结构Table 2 Nanostructural of different soluble pectin fractions of some fruits
6 采后果实质地变化与果胶代谢
6.1 质地变绵(沙)与果胶代谢
苹果、梨、西瓜、冬枣等果实在长期贮藏后或后熟过度时容易出现果肉变绵(沙)、缺少汁液的现象,严重影响口感。有报道表明,苹果变绵(沙)时果实细胞之间的连接显著减少,这可能与果实细胞壁中胶层果胶降解过快、失去了对相邻细胞的粘结能力有关[66]。在咬下或咀嚼果实的过程中,由于中胶层果胶的降解失去粘结能力,果实细胞容易错动而不易破裂,从而减少了细胞内容物的流出;同时,中胶层水解的果胶容易与Ca2+形成凝胶复合物大分子溶胀吸水,从而减少了果实汁液中的自由水分,给人以沙质绵软、缺乏汁液的感觉[67]。进一步研究发现,苹果变绵(沙)与果胶甲酯酶基因表达下调最为相关[66]。京白梨果实快速软化时,果实呈沙质绵软状态,这可能与果实半乳糖醛酸酶、β-半乳糖苷酶和α-阿拉伯糖苷酶基因表达量和酶活性高、中胶层果胶迅速降解和溶解有关[28]。
6.2 组织浆化与果胶代谢
多数核果、番茄、猕猴桃、芒果、草莓等果实在采后容易出现浆状软化(又称溶质化)。猕猴桃是典型的浆化果实,在贮藏初期果肉细胞结构完整,果实较硬;贮藏一段时间后,中胶层逐渐溶解分离,细胞间产生空隙,果肉开始变软;随后,果胶进一步解体,中胶层液化,细胞壁空泡化,纤维素多聚物解散,微纤丝断裂;果实衰老末期,果肉组织全部瓦解浆化,细胞壁和其它结构己全部液化[68]。可见,与变绵过程中果肉组织崩解成细胞个体不同,果实组织浆化过程是细胞个体的崩裂、消融、溶解形成均一态胶体的过程。
果实组织的浆状软化与各组分果胶的形态变化有关。在软质桃‘Akatsuki’后熟软化过程中,内切多聚半乳糖醛酸酶活性升高,使SSP含量降低而CSP含量上升,果胶溶解性增加[34]。采后杏果实组织浆化过程中,CSP含量上升但侧链结构减少、链宽缩小、且短链CSP明显增加而长链CSP减少[37]。另外,在草莓组织浆化过程中发现,WSP和SSP链的长度下降达30%~39%,CaCl2处理可减少草莓中SSP的解聚从而维持果实硬度[51]。
6.3 “慢软化”果实的果胶代谢
“慢软化”指一些品种果实后熟软化速率比一般品种慢,软化所需时间往往可达到一般品种的两倍甚至更多。近年来,“慢软化”机制的研究逐渐引起了国内外学者的关注。如“Friar”李果实在25℃下可以贮藏 3~4周[17]。“V98041”李也是一种“慢软化”李,在4℃下贮存30 d后,还可在20℃下贮存12 d。“V98041”李的慢软化与细胞壁降解相关酶的基因转录表达水平很低有关[69]。“慢软化”苹果“Kanzi”在成熟软化过程中没有明显的果胶解聚或者溶解发生,只是在衰老期,果实硬度才会陡然下降,但此时它的中胶层仍保持完整[49]。“Scifresh”苹果的“慢软化”机制可能与其在早期发育阶段果胶溶解较少、半乳糖丢失水平较低有关[16]。硬质桃“Mochizuki”采后软化缓慢,其果胶溶解程度也处在相当低的水平,果胶提取物分子质量分布基本保持不变[34]。
近年来,各种细胞壁糖苷酶如β-半乳糖苷酶、β-甘露糖苷酶和α-呋喃阿拉伯糖苷酶等在果实细胞壁成分降解和质地软化中的作用得到越来越多的研究[49,70-71]。细胞壁不同组分往往以糖苷键相连接而牢固地结合在一起,维持了细胞壁的机械强度。细胞壁糖苷酶能够水解这些糖苷键,释放出中性糖,促进细胞壁物质的解聚和溶解。但是,有研究认为较高的半乳糖水平可减少细胞壁的多孔性,阻碍细胞壁酶作用的通道,进而有利于保持结构完整,减缓果实软化速率[72]。
6.4 果实冷害与果胶代谢
冷害往往导致果实组织出现絮败、木质化、半透明化、凝胶化、不软化或过快软化等质地变化。这些症状的出现可能与低温冷害引起的果胶代谢异常有关[73]。李果实常见冷害症状为半透明化,出现于近皮的果肉处,果肉呈胶状、半透明的状态。半透明化被认为是由于细胞间隙WSP结合水形成胶体状结构而形成的现象[73]。桃果实在冷藏过程中经常会发生果肉絮败现象。研究发现,絮败果实比正常果实具有更高的CSP和SSP含量和更低的WSP含量[74]。杏果实在冷藏过程中也会发生絮败,低温容易发生冷害的杏果实多聚半乳糖醛酸酶活性低而果胶甲酯酶活性高,CSP和SSP含量高于正常成熟的果实,在贮藏过程中,冷害杏果实果胶物质不能正常降解,因而容易形成果肉絮败[75]。
7 结论与展望
在果实软化过程中,在一系列细胞壁代谢相关酶的作用下,中性糖不断丢失,果胶侧链不断解离,果胶多聚物逐渐降解,果胶分子结构和果胶组分溶解性发生了改变,果胶物质逐渐与细胞壁其它成分分离。在采后果实正常软化过程中,不溶性果胶向可溶性果胶的转变,使果实变得柔嫩多汁。然而,由于果实种类与品种、发育及成熟程度等本身生物学特性的影响,以及采后贮藏温度等因素的影响,采后果实果胶发生降解的方式、不同溶解性果胶组分构成都发生了变化,中性糖丢失与果胶多聚物的解聚程度也发生了改变,因此出现了果实变绵(沙)、浆化(溶质化)、“慢软化”等质地软化方式,还出现了半透明化、凝胶化、絮败等异常质地变化现象,严重地影响果实的后熟生理进程、贮藏品质、加工性能、甚至医疗保健功能。果实细胞壁中果胶存在状态复杂,不同果实果胶组成与含量又有较大差异,因此还需利用现代分析技术如荧光免疫定位、激光共聚焦显微镜和原子力显微镜观察、核磁共振技术、光谱分析、高效离子交换色谱分析等手段,不断深入研究果胶及其在果实后熟软化、贮藏保鲜和加工过程中的变化规律。
