不同品种大豆分离蛋白体外消化产物的结构特性
2019-10-12江连洲胡继莹张潇元张菀坤齐宝坤悦米董苗苗王中江
江连洲 胡继莹 张潇元 张菀坤 李 杨 齐宝坤 刘 爽 潘 悦米 思 董苗苗 王中江
(东北农业大学食品学院 哈尔滨 150030)
大豆是我国重要的经济及油料作物之一,是人类生存不可或缺的重要食物来源[1]。根据栽培区域不同,我国大豆主要划分为3个大区种,即北方春大豆栽培区、黄淮流域夏大豆栽培区及南方大豆栽培区[2]。根据大豆生产用途又将其划分为三大品种,即高蛋白大豆、高油品种、双高大豆[3]。大豆蛋白各组分含量和比例、氨基酸组成、亚基组成及空间构象随大豆品种和产地的不同而有所不同,这种差异显著影响大豆蛋白的功能特性。
近年来关于蛋白质结构的研究逐渐深入,对不同品种大豆分离蛋白(SPI)红外光谱酰胺I带进行分析,结果表明:品种差异对大豆分离蛋白二级结构4种类型α-螺旋、β-折叠、β-转角和无规则卷曲的含量影响极显著[4]。这种差异显著影响大豆蛋白的生产加工。谢良等[5]对国产与进口大豆分离蛋白研究,差示扫描量热法(DSC)结果表明国产大豆热焓较低,大豆分离蛋白分子质量较小。Khatib等[6]采用色氨酸荧光发射光谱和同步荧光光谱研究不同品种大豆的7S球蛋白和11S球蛋白,得知品种差异引起色氨酸所处微环境极性不同,反映出三级结构存在差异。对不同种类大豆分离蛋白在人体正常消化道条件下的消化吸收差异仍知之甚少[7],阻碍了大豆蛋白构象的定性及定量分析。
本研究通过模拟人体胃部消化环境,探讨体外模拟消化过程中不同品种大豆分离蛋白及空间构象与大豆分离蛋白消化程度的构效关系,为我国大豆蛋白实现产业化发展提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白,实验室自制;氢氧化钠、盐酸、磷酸二氢钠、磷酸氢二钠,国产分析纯试剂;正己烷,天津北科化学品有限责任公司。
1.2 仪器与设备
TD5M-WS 台式大容量离心机,上海卢湘仪离心机仪器有限公司;MAGNA-IR560傅里叶变换红外光谱系统,美国贝克曼公司;PerkinElmer Raman Station 400拉曼光谱仪,美国贝克曼公司。
1.3 试验方法
1.3.1 大豆分离蛋白的热处理 参考王中江等[8]的方法,将适量不同品种大豆分离蛋白分散于蒸馏水中配制成5%的大豆蛋白溶液,并取调配后样品溶液100 mL,分别密封于加热套管中,并在85℃控温水浴锅进行15 min预热处理,经热处理完成后,迅速放入冰水浴降温待用。
1.3.2 大豆分离蛋白消化产物水解度的测定 采用邻苯二甲醛法对大豆蛋白消化过程的水解度(DH)的测定,用可见光分光光度计在340 nm下测定其吸光度。
水解度的计算:
式中:htot取决于原料的类型,H表示丝氨酸氨基毫摩数的函数,Serine NH2表示毫摩Serine NH2/g蛋白,X表示样品质量,P表示样品中的蛋白含量,0.1表示样品体积转换成L,α、β见表1[9]。
1.3.3 傅里叶红外光谱(FT-IR)的测定 参考张忠慧[10-12]的方法。将冻干样品充分干燥后,取样品1~2 mg与100 mg溴化钾混匀、研磨、压片,测定FT-IR。测定在波数范围为 4 000~400 cm-1的吸收光谱,分辨率4 cm-1,波数精度0.01 cm-1,扫描次数64次,环境温度25℃。
1.3.4 拉曼光谱的测定 参考张萍[13]的方法。扫描波长785 nm,功率为300 mW,扫描范围400~2 000 cm-1,扫描时间每次 60 s,积分 10 次,4次扫描进行累加。以苯丙氨酸(1 003±1 cm-1)作为归一化因子,得到大豆分离蛋白的拉曼光谱。
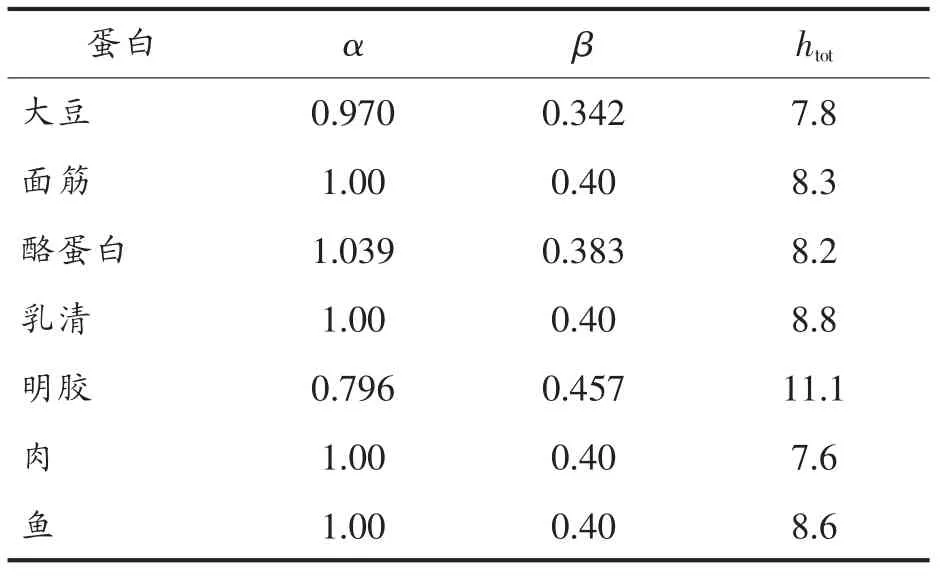
表1 不同来源蛋白质的α、β及htot值Table 1 Different sources of protein of α,β and htotvalues
1.3.5 数据统计分析 每次试验做3次平行,结果用平均值±标准差表示,组间差异显著性采用t检验分析(P<0.05)。数据统计分析采用SPSS 17.0软件,试验数据用Origin 9.1软件、PeakFit 4.12软件分析等进行数据分析,图表处理及图谱分析处理。
2 结果与分析
2.1 大豆分离蛋白体外模拟消化过程中的DH分析
5种不同品种的大豆分离蛋白经过连续5 h的体外模拟消化试验,不同样品在消化过程中不同消化时间的DH测定结果如表2所示。
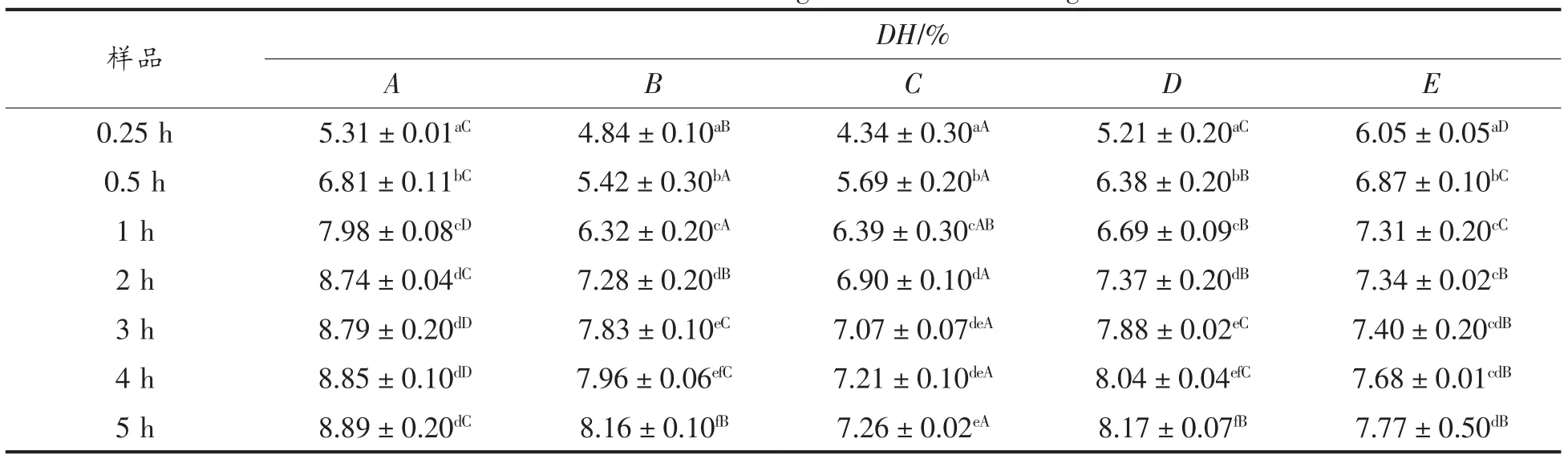
表2 不同消化时间对大豆分离蛋白DH的影响Table 2 Effects of DH in vitro digestion at different digestion time
由表2可知,不同品种大豆分离蛋白在消化过程中,水解度DH随着消化时间延长,均呈增加趋势,经1h消化反应,DH增加速度减慢,不同样品DH存在差异性。样品C在不同消化时间的DH基本保持最低水平,而样品E的DH在反应开始0.5 h内消化水解的程度较大,样品A的DH在整个消化过程中一直保持较高的消化水平,其余样品的DH居中呈波动式变化趋势。
2.2 不同品种大豆分离蛋白体外消化过程中的红外光谱分析
2.2.1 东农46号(A)及消化产物的红外光谱分析
由图1可知,大豆分离蛋白及其消化产物在波数范围为4 000~400 cm-1的吸收光谱,其中在酰胺I带1 700~1 600 cm-1有较强吸收。指认拟合图谱中各子峰与二级结构对应关系为:1 650~1 660 cm-1为 α-螺旋结构[14];1 618~1 640 cm-1和1 670~1 690 cm-1为 β-折叠结构[15];1 640~1 650 cm-1为无规则卷曲结构[14];1 660~1 700 cm-1为 β-转角结构[15-16]。通过计算各子峰积分面积得到二级结构4种类型的相对百分含量及水解度曲线DH见图2。经过连续5 h的消化试验,从样品A大豆分离蛋白的红外光谱拟合计算出的二级结构含量变化结果可以看出,二级结构中的β-折叠、β-转角呈逐渐下降的趋势,而无规则卷曲含量随消化时间的延长不断增加,α-螺旋变化先增加后减少。在β-折叠结构的进一步分析可知,平行式的β-折叠结构与反平行式β-折叠结构变化趋势相反,平行式的β-折叠结构逐渐减少向反平行式的β-折叠结构转换。
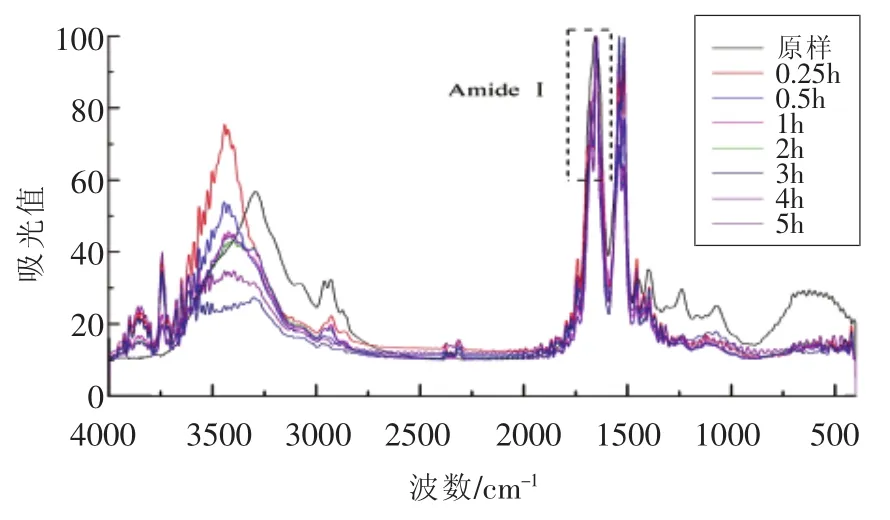
图1 不同消化时间样品A及消化产物的FT-IR谱图Fig.1 FT-IR spectrum of digestion products of SPI-A with different digestion time
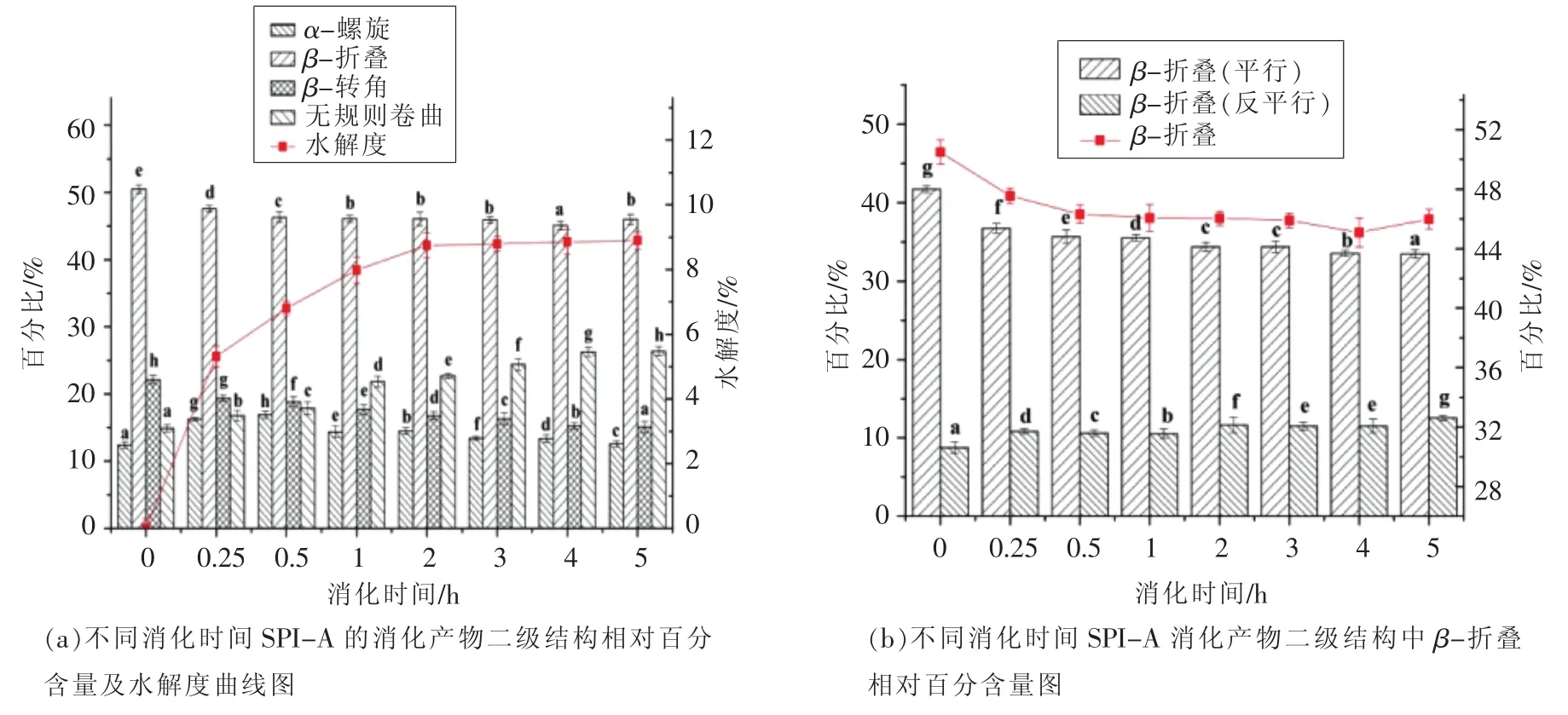
图2 不同消化时间SPI-A及消化产物的二级结构Fig.2 The secondary structures of digestion products of SPI-A with different digestion time
2.2.2 菏豆21号(B)及消化产物的红外光谱分析
经过连续5 h的消化试验,从样品B大豆分离蛋白的红外光谱拟合计算出的二级结构含量变化结果可以看出,二级结构中的β-折叠呈逐渐下降的趋势,β-转角含量总体上看也呈下降趋势,而无规则卷曲含量随时间的延长仍不断增加,α-螺旋变化不规律,略增加后减少。在β-折叠结构的进一步分析可知,平行式的β-折叠结构与反平行式β-折叠结构变化趋势相反,平行式的β-折叠结构逐渐减少向反平行式的β-折叠结构转换。
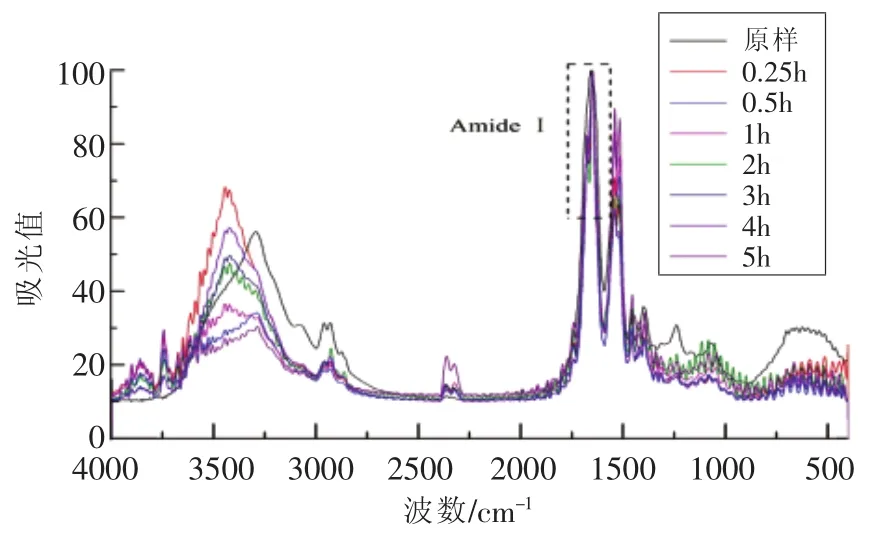
图3 不同消化时间样品B及消化产物的FT-IR谱图Fig.3 FT-IR spectrum of digestion products of SPI-B with different digestion time
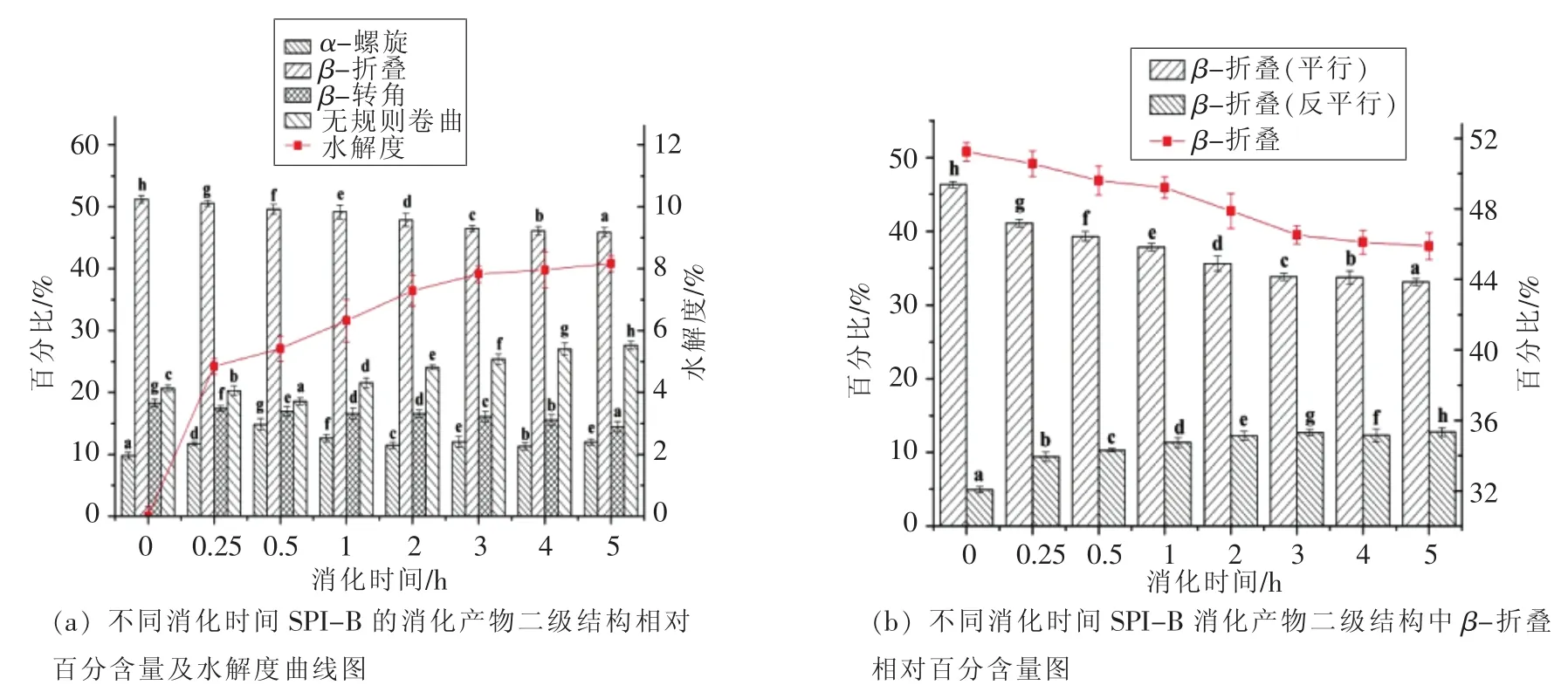
图4 不同消化时间样品B及消化产物的二级结构Fig.4 The secondary structures of digestion products of SPI-B with different digestion time
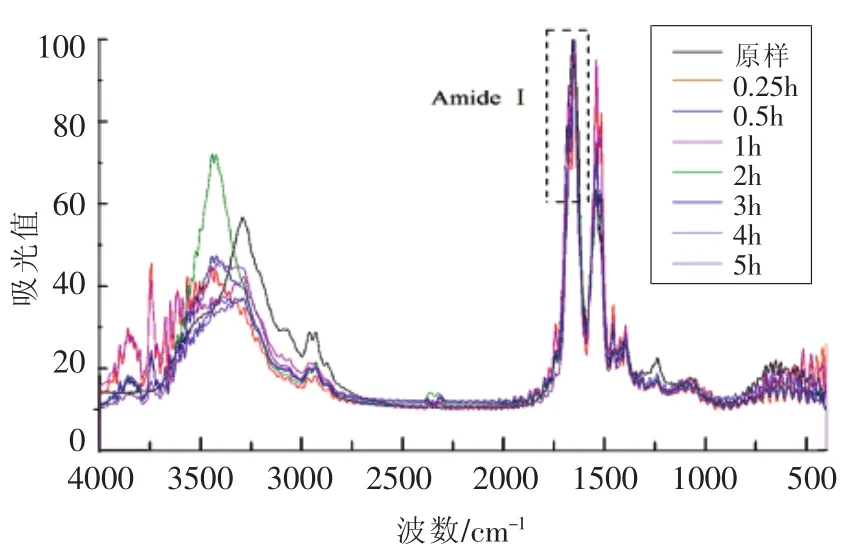
图5 不同消化时间样品C及消化产物的FT-IR谱图Fig.5 FT-IR Spectrum of digestion products of SPI-C with different digestion time
2.2.3 陕豆125号(C)的红外光谱分析 经过连续5 h的消化试验,从样品C大豆分离蛋白的红外光谱拟合计算出的二级结构含量变化结果可以看出,二级结构中的β-折叠、β-转角含量总体上看呈下降趋势,而无规则卷曲含量随消化时间的延长仍不断增加后略有减少,α-螺旋含量变化不规律总体上看呈增加趋势。在β-折叠结构的进一步分析可知,随着β-折叠结构总体含量的下降,平行式的β-折叠结构与反平行式β-折叠结构呈相反的变化趋势,平行式的β-折叠结构逐渐减少向反平行式的β-折叠结构转换。
2.2.4 滇豆4号(D)的红外光谱分析 经过连续5 h的消化试验,从样品D大豆分离蛋白的红外光谱拟合计算出的二级结构含量变化结果可以看出,二级结构中的β-折叠、β-转角含量总体上看呈下降趋势,而二级结构中无规则卷曲的含量随消化时间的延长总体呈增加趋势,α-螺旋含量变化不规律。在β-折叠结构的进一步分析可知,随着β-折叠结构总体含量的下降,平行式的β-折叠结构含量不断减少,而反平行式β-折叠结构含量变化不大,略有增加。
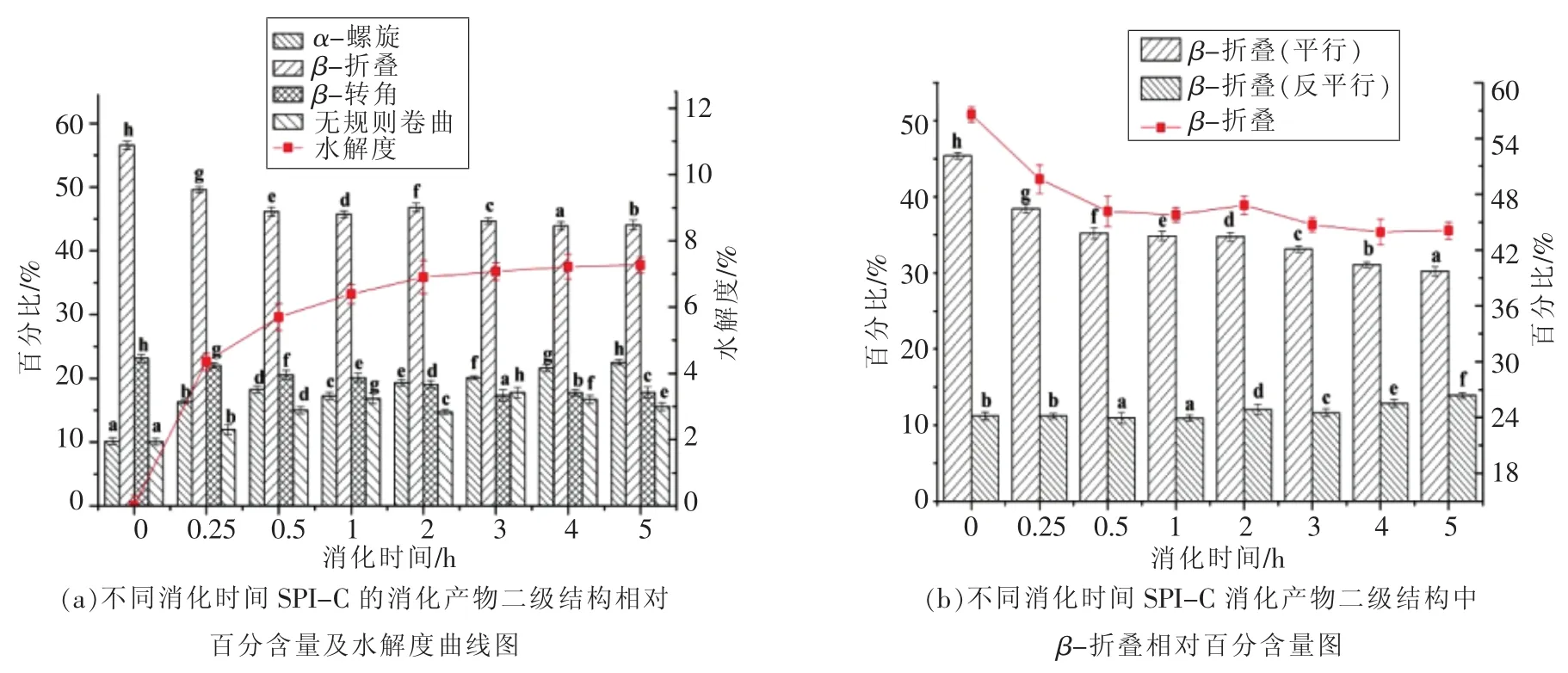
图6 不同消化时间样品C及消化产物的二级结构Fig.6 The secondary structures of digestion products of SPI-C with different digestion time
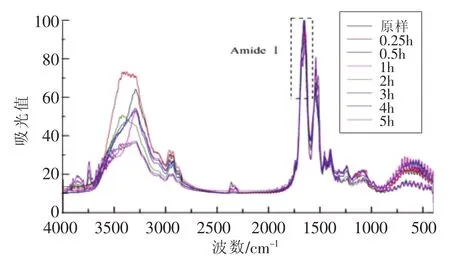
图7 不同消化时间样品D及消化产物的FT-IR谱图Fig.7 FT-IR spectrum of digestion products of SPI-D with different digestion time
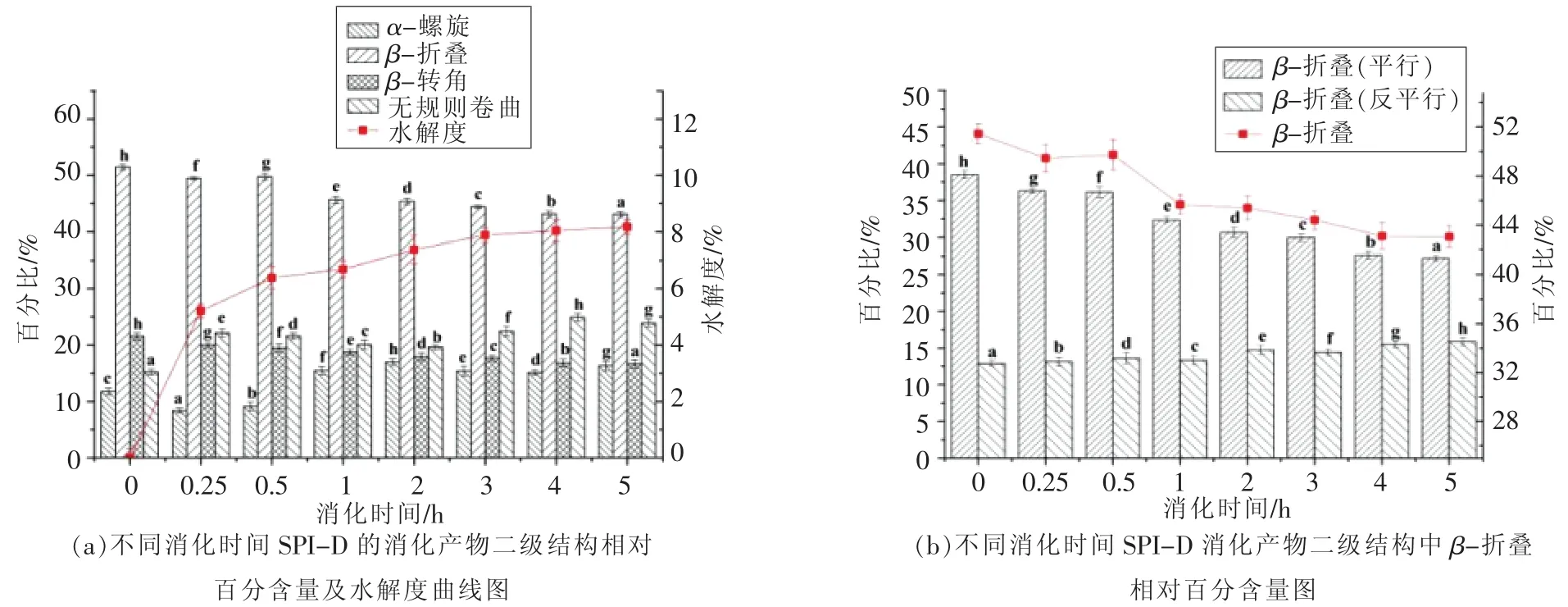
图8 不同消化时间样品D及消化产物的二级结构Fig.8 The secondary structures of digestion products of SPI-D with different digestion time
2.2.5 冀豆15号(E)的红外光谱分析 经过连续5 h的消化试验,从样品E大豆分离蛋白的红外光谱拟合计算出的二级结构含量变化结果可以看出,二级结构中的β-折叠、β-转角含量总体上看呈下降趋势,而无规则卷曲的含量随消化时间的延长总体呈增加趋势,α-螺旋含量变化呈现波动趋势。对β-折叠结构的进一步分析可知,随着β-折叠结构总体含量的下降,平行式的β-折叠结构含量不断减少,而反平行式β-折叠结构含量变化不大,略有增加。
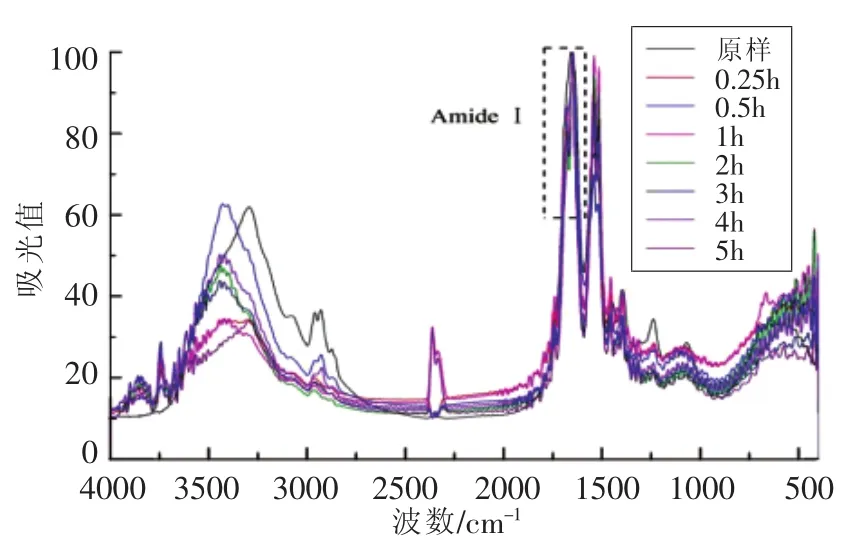
图9 不同消化时间样品E及消化产物的FT-IR谱图Fig.9 FT-IR spectrum of digestion products of SPI-E with different digestion time
图10 不同消化时间样品E及消化产物的二级结构Fig.10 The secondary structures of digestion products of SPI-E with different digestion time
本部分研究主要以5种样品在连续5 h的消化过程中,大豆分离蛋白的红外光谱拟合计算出的二级结构中β-折叠结构含量变化为考察指标。SPI-A的β-折叠结构含量较高,但α-螺旋结构的含量较低;SPI-B无规卷曲结构的含量最高而α-螺旋含量最低;SPI-C的β-折叠和β-转角结构的含量最高,但无规卷曲结构的含量最低。在本研究中,随着消化反应的不断进行,5个SPI样品二级结构中β-折叠和β-转角结构的含量有所下降。分析原因可能为,SPI样品中β-折叠总含量的降低可以归因于平行β-折叠的消化酶解,而反平行β-折叠量略有增加。在连续5 h的消化过程后,SPIA和SPI-B的α-螺旋比例含量呈先上升后下降的趋势,而SPI-D和SPI-E普遍呈先下降后上升的趋势,但SPI-C的α-螺旋结构百分比呈上升趋势。SPI中α-螺旋结构比例降低有可能是α-螺旋被消化酶解。SPI-A和SPI-B中的α-螺旋的含量在0.5~1 h不断下降,而在0~0.5h,SPI-D和SPIE中的α-螺旋的含量也降低,表明α-螺旋的消化水解反应发生在反应的初期。
随着消化反应的不断进行,SPI-A、SPI-D和SPI-E中的无规卷曲结构的百分比普遍增加,SPI-B的无规卷曲结构的百分比先下降后上升,SPI-C的无规卷曲结构比例先升高后下降,分析推知α-螺旋和β-折叠结构的消化可能增加无规卷曲结构的含量。因此,研究几乎不能确定SPIA,SPI-D和SPI-E在消化过程无规卷曲结构的消化规律,但SPI-B的初始消化阶段时间和SPI-C下前2 h的消化反应中无规卷曲结构的含量降低可能与无规卷曲结构的消化降解有关。
2.2.6 大豆分离蛋白的二级结构与DH相关性分析 由上所述分析可知,大豆蛋白结构展开,使得β-折叠结构在SGF中暴露出更多易感位点,增加了胃蛋白酶与酶切位点结合的可及性与可能性,而大豆蛋白中的α-螺旋结构的消化发生初期,只有部分被消化酶解掉,而整个消化反应过程中β-折叠结构几乎都随时间不断延长而被消化酶解。在连续5 h消化反应中,大豆分离蛋白的二级结构与DH相关性分析如表3。
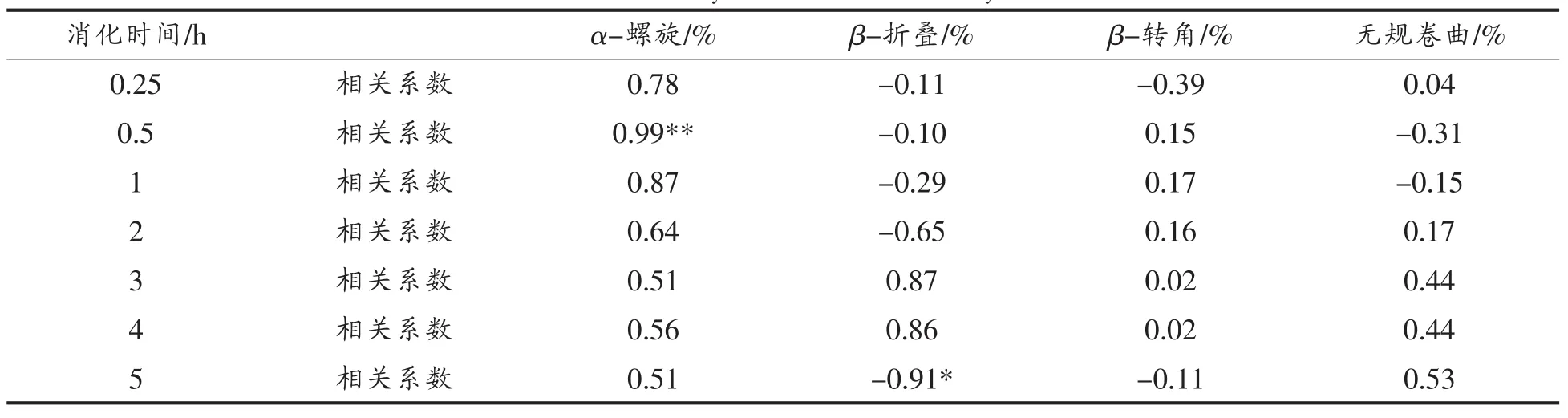
表3 二级结构与DH之间的相关性Table 3 The correlation analysis between secondary structure and DH
由表3可知,5种大豆分离蛋白经过连续5 h的体外模拟消化后,由于消化反应过程的β转角结构与无规卷曲变化呈现波动趋势,在消化反应的不同时间段与DH之间几乎均未有相关性,在反应进行0.5 h的短时消化酶解,样品的蛋白质中α-螺旋结构与 DH 具有极显著(P<0.05,r=0.99)的正相关;而样品的蛋白质中β-折叠结构在长时间消化反应过程中与DH的相关性逐渐明显,在反应进行5 h后,β-折叠结构与DH呈现出显著负相关(P<0.05,r=-0.91)这与 Carbonaro 等[17]研究的结果相一致。由此可以初步推断,样品蛋白质中α-螺旋结构及β-折叠结构的含量对大豆蛋白质的长、短时消化酶解的效果及效率都有着重要影响,而从上述5种样品连续5 h消化过程中,二级结构的变化分析也可得知,随着消化反应的不断进行,5种样品的大豆分离蛋白的红外光谱拟合计算出的二级结构中的β-折叠、β-转角含量总体上看呈下降趋势,α-螺旋含量及无规则卷曲变化呈现波动趋势,各结构之间可能存在相互转化。
2.3 不同大豆分离蛋白的拉曼光谱分析
2.3.1 东农46号(A)及消化产物的拉曼光谱分析
样品A(SPI-A)大豆蛋白及消化产物拉曼光谱如图11所示,其谱峰的归属见表4。
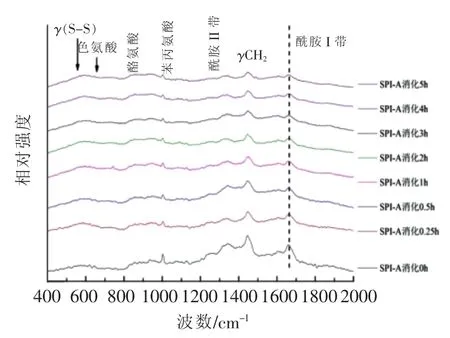
图11 不同消化时间样品A及消化产物的拉曼光谱图Fig.11 Raman spectra of digestion products of SPI-A with different digestion time
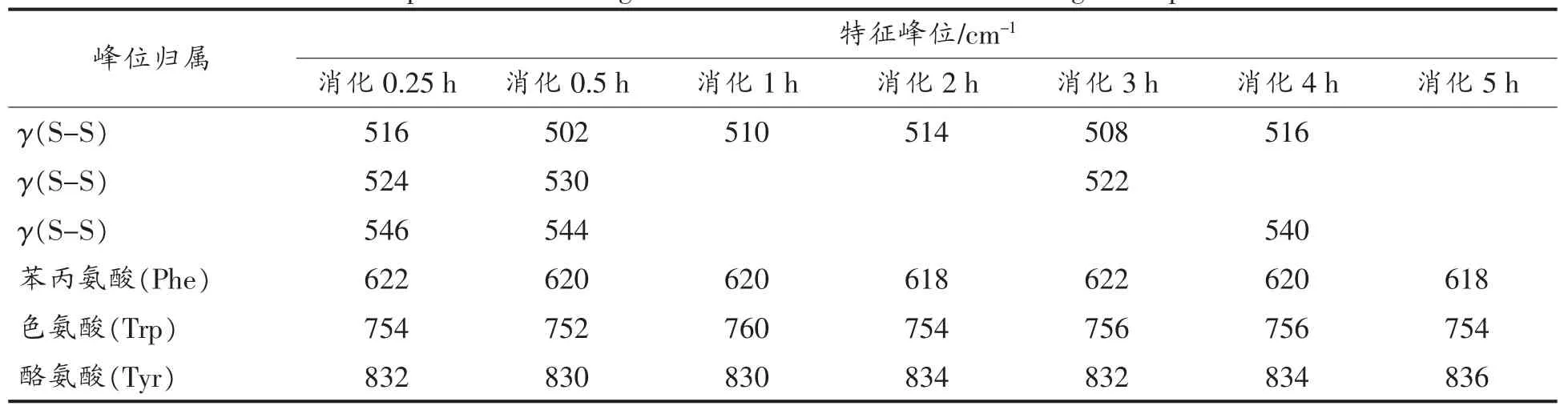
表4 SPI-A消化产物的拉曼光谱及特征频率归属Table 4 Raman spectrum and assignment of characteristic bands of digestion products of SPI-A
1)主链构象分析 样品A大豆蛋白消化产物的拉曼光谱的酰胺I带进行定量分析,分析采用Raman Spectral Analysis Package Version 2.1软件完成,结果见表5。
由表5可知,在连续5 h的消化过程中,SPIA及消化产物的二级结构以β-折叠含量最高且含量不断减少,而α-螺旋结构含量呈增加的趋势,β-转角含量及无规则卷曲含量变化不规律。
2)侧链构象分析 SPI-A消化产物的色氨酸谱带相对强度及酪氨酸费米共振线I850/I830分析结果见表6。
由表6可知,样品A大豆分离蛋白及不同时间的消化产物的I850/I830在1.01~1.02之间,其酪氨酸残基趋向于“暴露式”,5 h的消化过程中,酪氨酸残基微观环境变化较小,在760 cm-1附近区域的拉曼峰色氨酸谱带强度在整个消化反应中呈下降趋势。

表6 SPI-A消化产物的I850/I830及酪氨酸残基分析结果Table 6 I850/I830and tyrosine residues analysis results of digestion products of SPI-A
2.3.2 样品菏豆21号(B)的拉曼光谱分析 样品B(SPI-B)大豆蛋白及消化产物的拉曼光谱如图12所示,其谱峰的归属见表7。
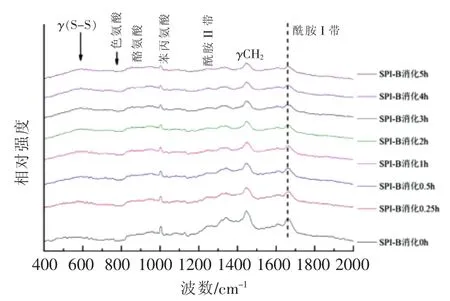
图12 不同消化时间样品B及消化产物的拉曼光谱图Fig.12 Raman spectra of digestion products of SPI-B with different digestion time
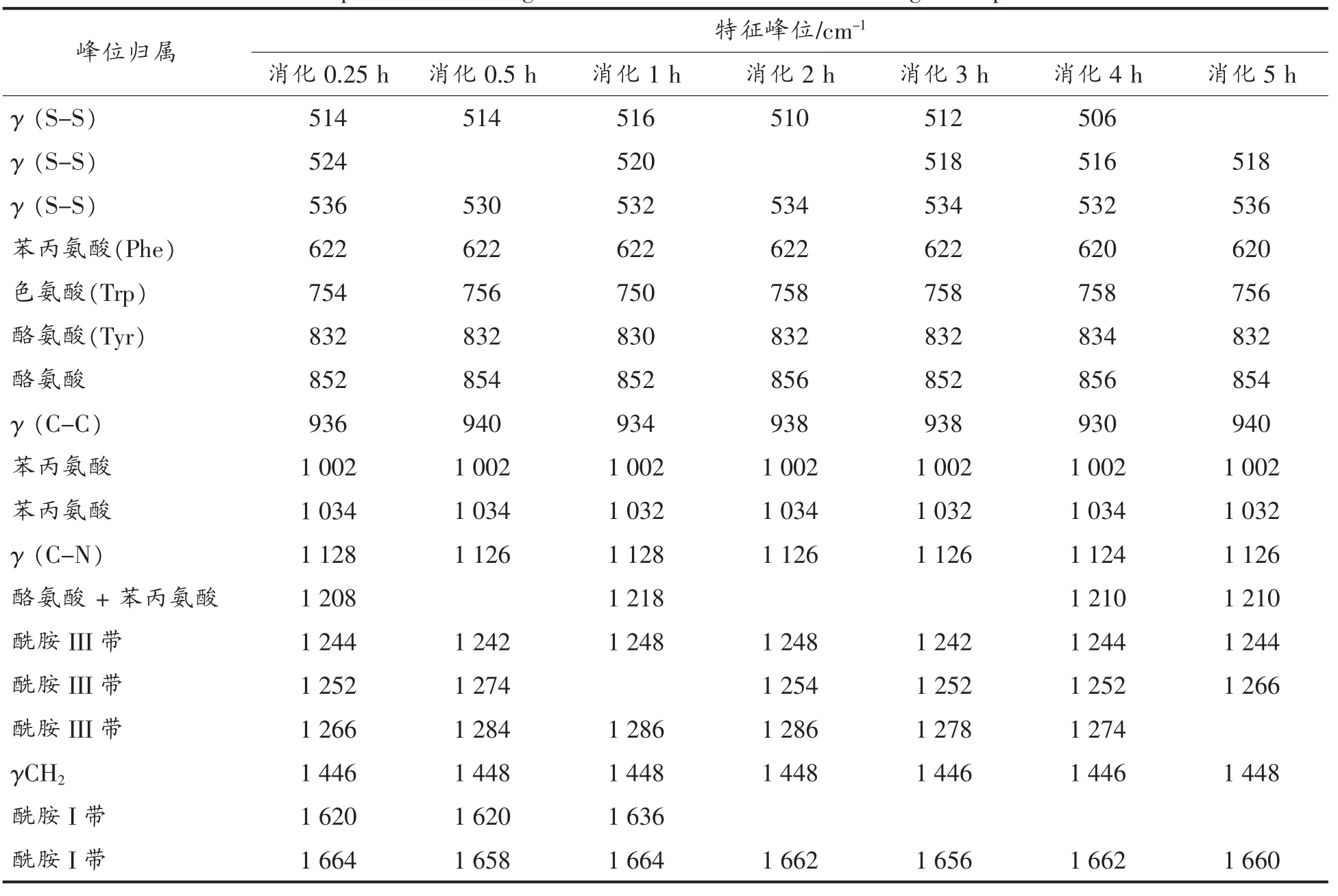
表7 SPI-B消化产物的拉曼光谱及特征频率归属Table 7 Raman spectrum and assignment of characteristic bands of digestion products of SPI-B
1)主链构象分析 SPI-B的消化产物的拉曼光谱的酰胺I带进行定量分析,分析采用Peakfit 4.12软件完成,结果见表8。
由表8可知,样品B大豆分离蛋白及消化产物的二级结构以β-折叠含量最高。在连续5 h的消化过程中,α-螺旋结构的含量在0~1 h时先升高而后开始降低,β-折叠结构的含量随着消化反应的不断进行,一直呈下降的趋势,而β-转角含量及无规则卷曲含量变化不规律,总体而言,经过长时间的消化反应,无规则卷曲的含量有所增加。
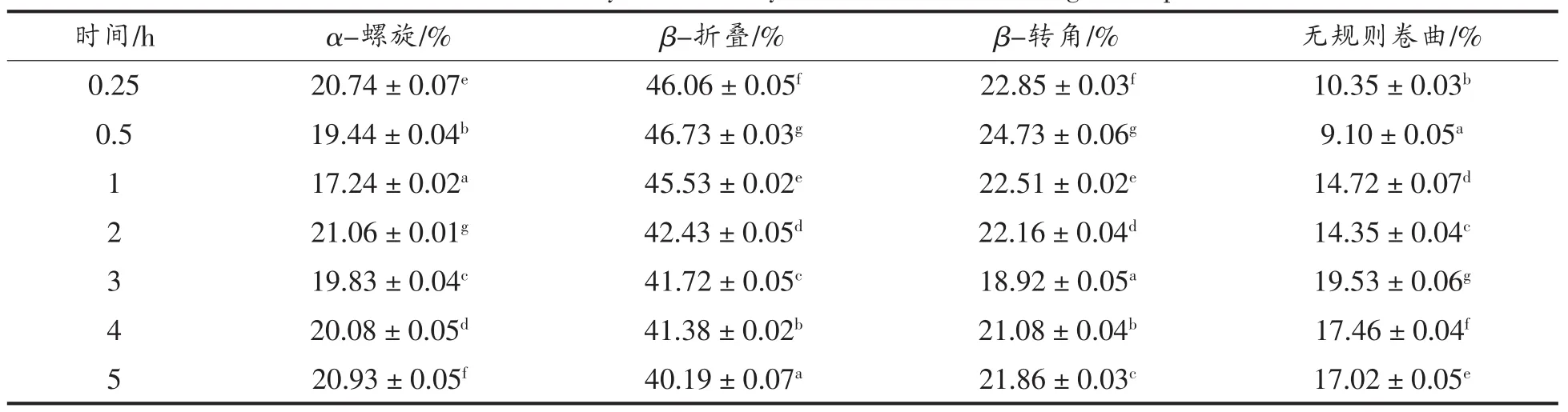
表8 利用酰胺I带拟合SPI-B消化产物二级结构结果Table 8 Contents of the secondary structure by Amide I bands for digestion products of SPI-B
2)侧链构象分析 SPI-B消化产物的色氨酸谱带相对强度及酪氨酸费米共振线I850/I830分析结果见表9。
由表9可知,样品B的大豆分离蛋白及不同时间的消化产物的I850/I830在1.01~1.02之间,其酪氨酸残基趋向于“暴露式”,5 h消化过程中,酪氨酸费米共振线I850/I830比值及残基暴露变化不明显。而由表9可知,760 cm-1附近区域的拉曼峰色氨酸谱带强度在整个消化反应中也一直呈下降趋势。
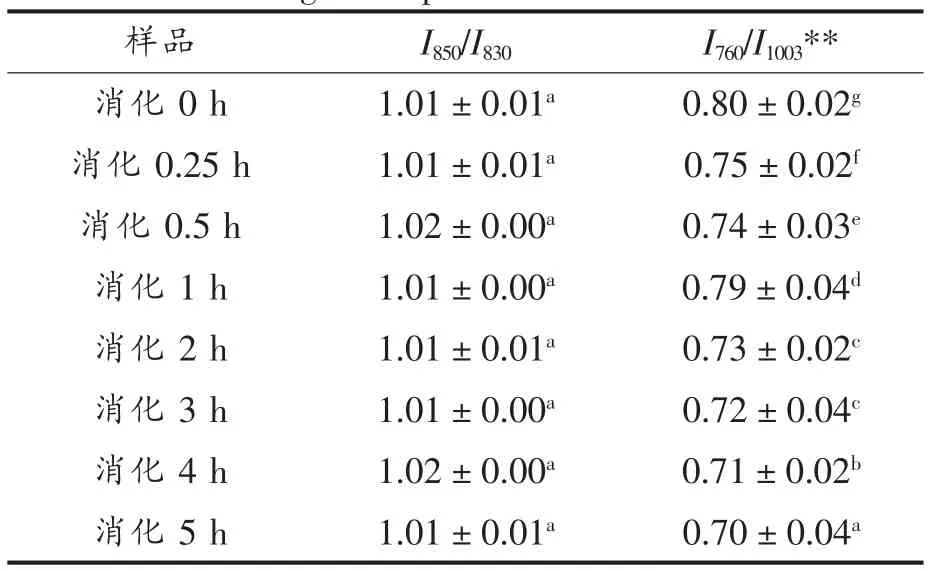
表9 SPI-B消化产物的I850/I830及酪氨酸残基分析结果Table 9 I850/I830and tyrosine residues analysis results of digestion products of SPI-B
2.3.3 陕豆125号(C)的拉曼光谱分析 样品C(SPI-C)大豆蛋白的拉曼光谱如图13所示,其谱峰的归属见表10。
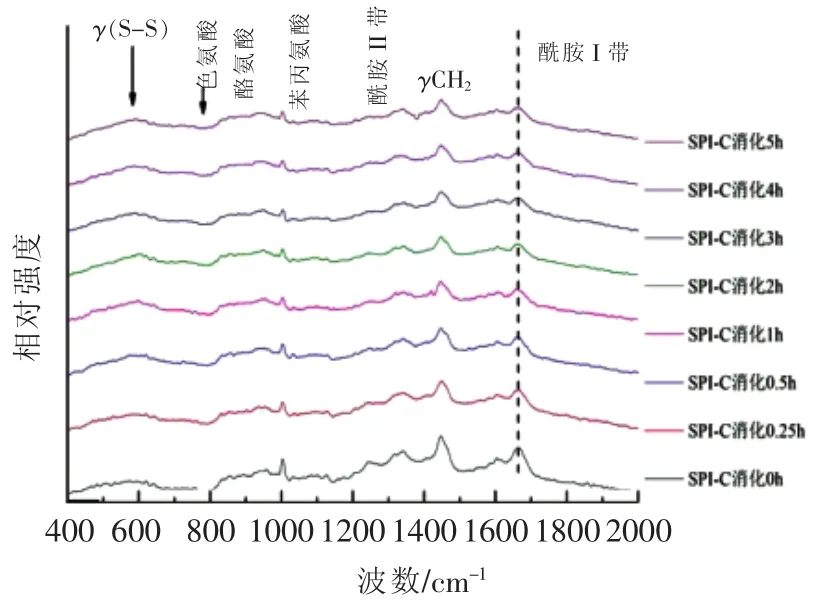
图13 不同消化时间样品C及消化产物的拉曼光谱图Fig.13 Raman spectra of digestion products of SPI-C with different digestion time

表10 SPI-C消化产物的拉曼光谱及特征频率归属Table 10 Raman spectrum and assignment of characteristic bands of digestion products of SPI-C

(续表10)
1)主链构象分析 SPI-C的消化产物的酰胺I带进行定量分析,分析采用Peakfit 4.12软件完成,结果见表11。

表11 利用酰胺I带拟合SPI-C消化产物二级结构结果Table 11 Contents of the secondary structure by Amide I bands for digestion products of SPI-C
由表11可知,在连续5 h的消化过程中,样品SPI-C消化产物的二级结构中α-螺旋结构的含量随着消化时间的延长呈逐渐升高的趋势,β-折叠结构的含量与β-转角含量在消化反应过程中不断降低,而无规则卷曲含量变化不规律。
2)侧链构象分析 SPI-C消化产物的色氨酸谱带相对强度及酪氨酸费米共振线I850/I830分析结果见表12。
由表12可知,样品SPI-C及不同时间的消化产物的I850/I830在1.01~1.02之间,其酪氨酸残基趋向于“暴露式”,5 h消化反应,酪氨酸费米共振线I850/I830比值及残基暴露变化不明显。而由表12可知,760 cm-1附近区域的拉曼峰色氨酸谱带强度在整个消化反应中也一直呈下降趋势。
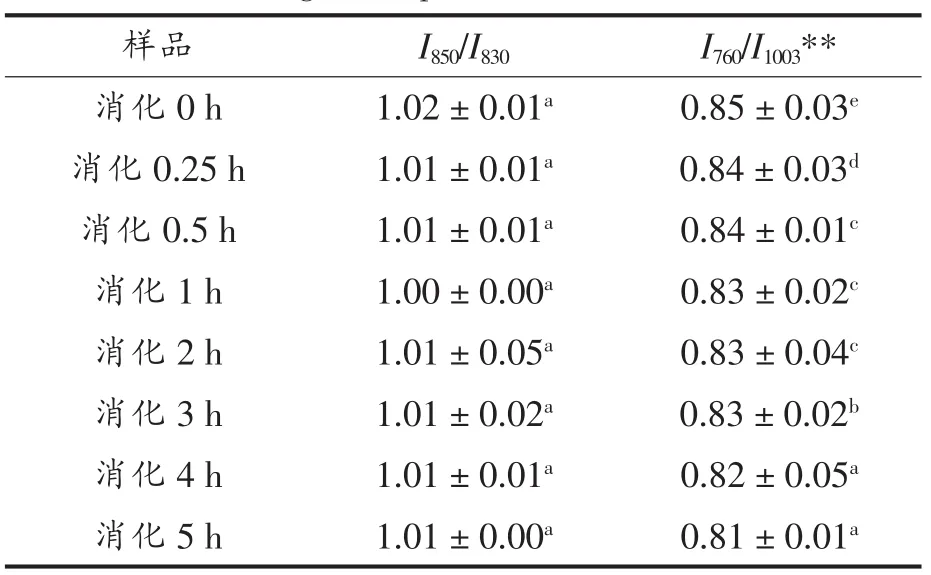
表12 SPI-C消化产物的I850/I830及酪氨酸残基分析结果Table 12 I850/I830and tyrosine residues analysis results of digestion products of SPI-C
2.3.4 滇豆4号(D)的拉曼光谱分析 样品D(SPI-D)大豆蛋白的拉曼光谱如图14所示,其谱峰的归属见表13。

图14 不同消化时间样品D及消化产物的拉曼光谱图Fig.14 Raman spectra of digestion products of SPI-D with different digestion time
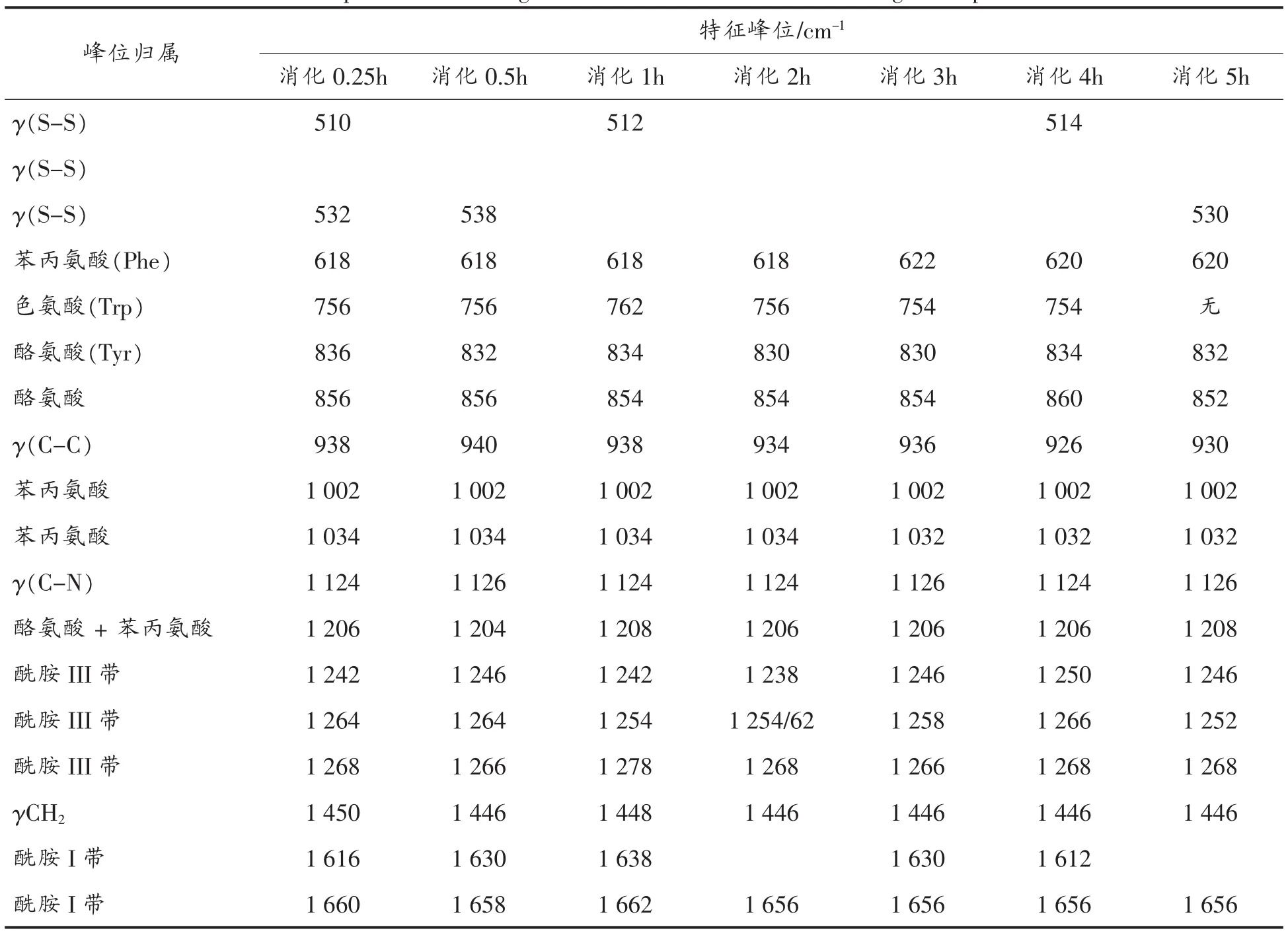
表13 SPI-D消化产物的拉曼光谱及特征频率归属Table 13 Raman spectrum and assignment of characteristic bands of digestion products of SPI-D
1)主链构象分析 SPI-D消化产物的酰胺I带进行定量分析,分析采用Peakfit 4.12软件完成,结果见表14。
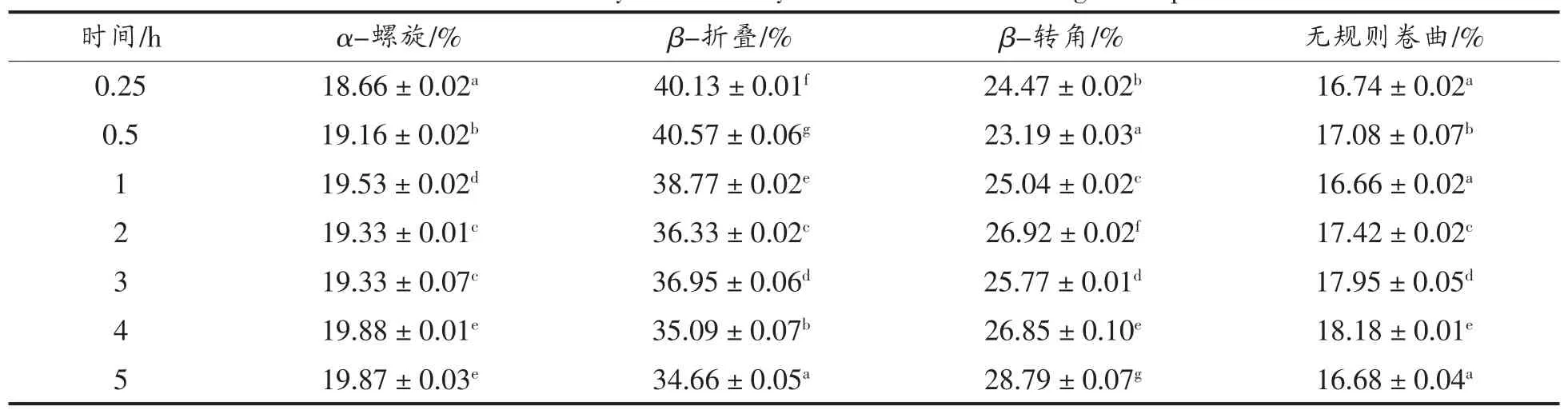
表14 利用酰胺I带拟合SPI-D消化产物二级结构结果Table 14 Contents of the secondary structure by Amide I bands for digestion products of SPI-D
由表14可知,在连续5 h的消化过程中,样品SPI-D大豆分离蛋白的二级结构中α-螺旋结构的含量随着消化时间的延长呈先升高后降低的变化趋势,β-折叠结构的含量在消化反应过程中不断降低,而β-转角结构含量及无规则卷曲含量变化不规律,总体而言,经过长时间的消化反应,β-转角结构含量有所增加。
2)侧链构象分析 SPI-D消化产物的色氨酸谱带相对强度及酪氨酸费米共振线I850/I830分析结果见表15。
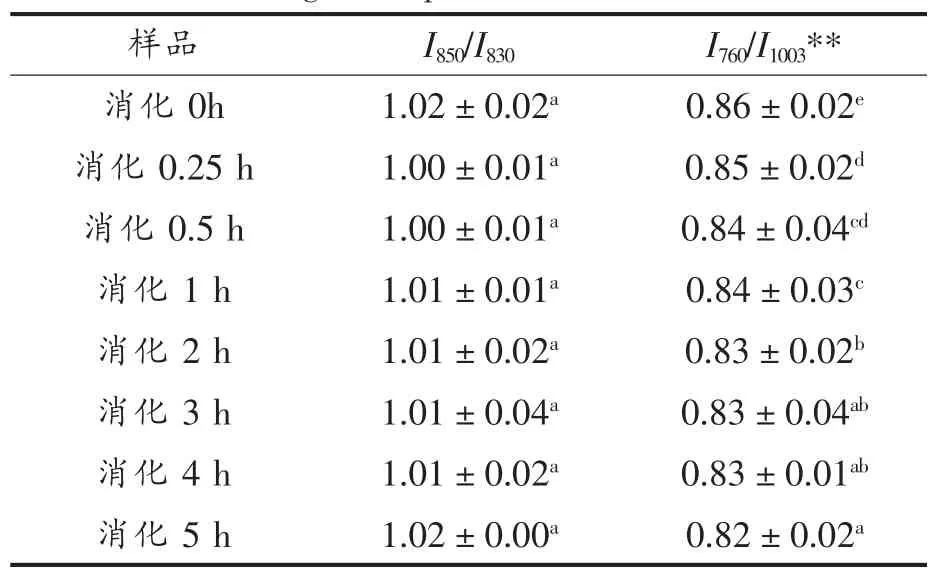
表15 SPI-D消化产物的I850/I830及酪氨酸残基分析结果Table 15 I850/I830and tyrosine residues analysis results of digestion products of SPI-D
由表15可知,样品SPI-D及不同时间的消化产物的I850/I830在1.00~1.02之间,其酪氨酸残基趋向于“暴露式”,酪氨酸费米共振线I850/I830比值及残基暴露的变化趋势不明显。而由表15可知,760 cm-1附近区域的拉曼峰色氨酸谱带强度在整个消化反应中也一直呈降低趋势。
2.3.5 冀豆15号(E)的拉曼光谱分析 样品E(SPI-E)大豆蛋白的拉曼光谱如图15所示,其谱峰的归属见表16。
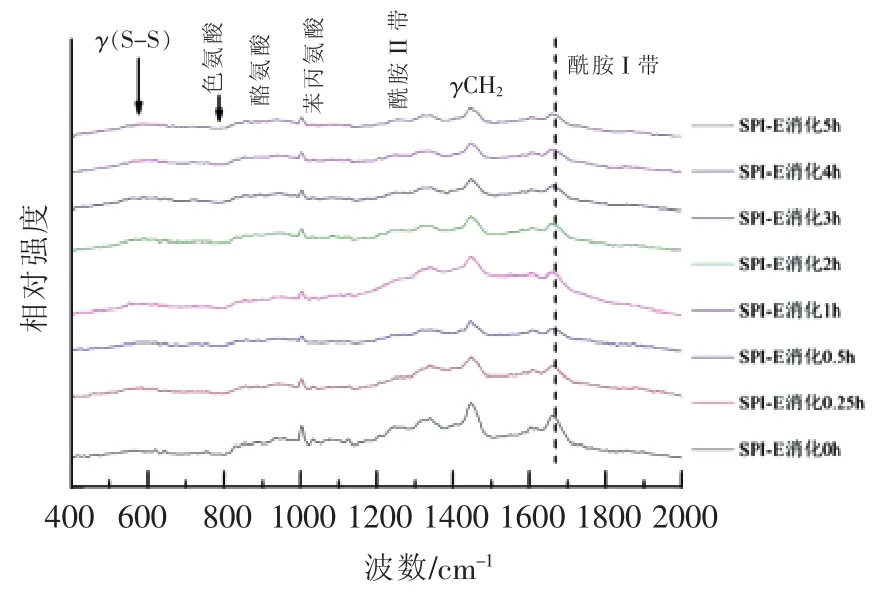
图15 不同消化时间样品E及消化产物的拉曼光谱图Fig.15 Raman spectra of digestion products of SPI-E with different digestion time

表16 SPI-E消化产物的拉曼光谱及特征频率归属Table 16 Raman spectrum and assignment of characteristic bands of digestion products of SPI-E
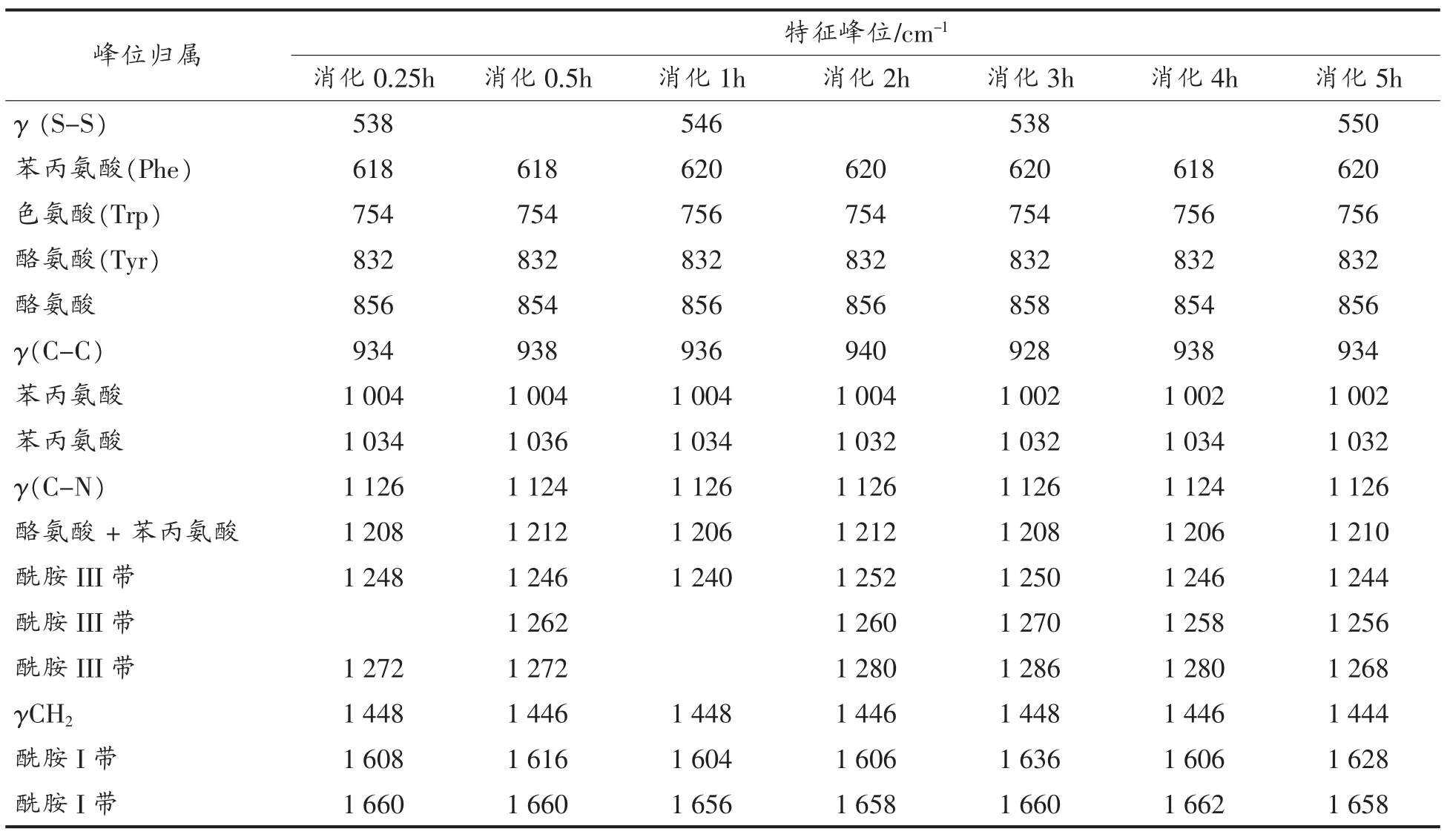
(续表16)
1)主链构象分析 SPI-E消化产物的酰胺I带进行定量分析,分析采用Peakfit 4.12软件完成,结果见表17。
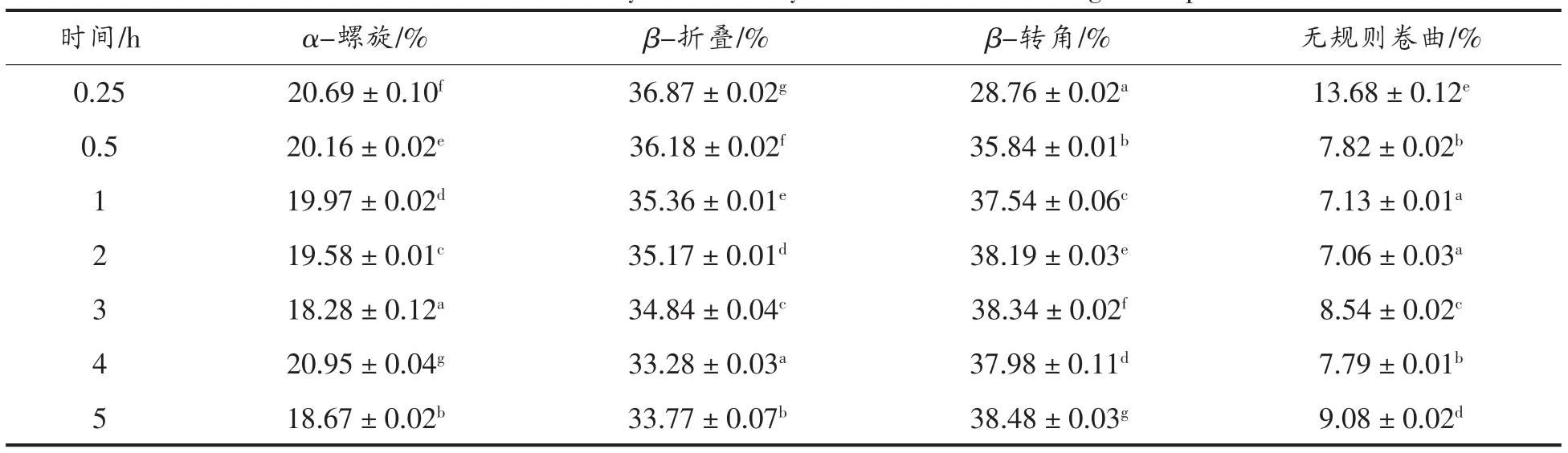
表17 利用酰胺I带拟合SPI-E消化产物二级结构结果Table 17 Contents of the secondary structure by Amide I bands for digestion products of SPI-E
由表17可知,样品SPI-E及消化产物的二级结构中α-螺旋结构的含量随着消化时间的延长呈先下降后上升的波动变化趋势,β-折叠结构的含量在消化反应过程中的不断降低,而β-转角含量在整个消化过程,总体而言呈不断上升趋势,无规则卷曲的总含量有所降低,经过长时间的消化反应,样品SPI-E消化产物的二级结构中的β-转角含量最高。
2)侧链构象分析 SPI-E消化产物的色氨酸谱带相对强度及酪氨酸费米共振线I850/I830分析结果见表18。
由表18可知,样品SPI-E及不同时间消化产物的I850/I830在1.00~1.02之间,其酪氨酸残基趋向于“暴露式”,酪氨酸费米共振线I850/I830比值及残基暴露的变化不明显。而由表18可知,760 cm-1附近区域的拉曼峰色氨酸谱带强度在整个消化反应中也一直呈下降趋势。
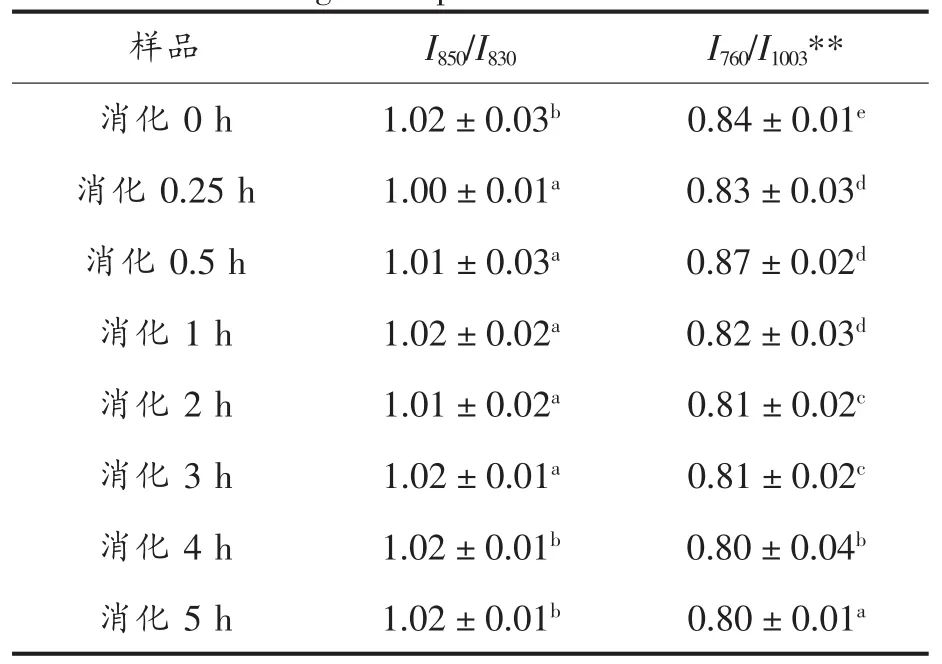
表18 SPI-E消化产物的I850/I830及酪氨酸残基分析结果Table 18 I850/I830and tyrosine residues analysis results of digestion products of SPI-E
5种大豆分离蛋白及消化产物的主链构象拉曼光谱的酰胺I带进行定量分析可知,SPI-B具有最高含量的无规卷曲结构而α-螺旋含量最低;SPI-C具有最高含量的β-折叠和β-转角结构,而在整个消化过程中,5种样品的大豆分离蛋白及消化产物的二级结构中β-折叠结构含量变化均呈下降趋势,其它二级结构元素含量变化不规律[18]。这与红外光谱分析结果基本一致。在对侧链结构影响的研究中发现,5个SPI样品及其消化产物的酪氨酸残基趋向于“暴露式”,随着消化反应的不断进行,不同样品的酪氨酸峰在850 cm-1和830 cm-1处的强度比值(I850/I830)变化存在略微差异,而随着消化反应的不断进行,酪氨酸双峰比值及残基暴露的变化不明显,在本研究经过消化酶解后大豆蛋白的拉曼图谱,5种样品在760cm-1附近区域的拉曼峰强度均有所降低,该区域归属于色氨酸残基的伸缩振动。
3 结论
本文通过对我国5种大豆分离蛋白体外模拟消化模式研究,运用多种蛋白质分析检测手段,主要研究结果如下:大豆分离蛋白及消化产物的红外光谱及拉曼光谱分析二级结构元素含量变化规律基本一致,α-螺旋结构、β-折叠结构与DH呈现出一定相关性。在反应进行0.5 h的短时消化酶解,样品的蛋白质中α-螺旋结构与DH具有极显著的正相关;而样品中β-折叠结构在长时间消化反应过程中与DH的相关性逐渐明显,在反应进行5 h后,β-折叠结构与DH呈现出显著负相关。拉曼光谱结果显示,经过消化酶解后色氨酸残基由包埋的疏水的微环境转为暴露的展开形式,表明色氨酸残基趋近于“暴露”态,这可能是由于消化过程中蛋白质发生变性、分子结构展开导致的。
