白藜芦醇和亚麻籽油复配的纳米结构脂质载体的制备和表征
2019-10-12李彤黄娟王强夏楠夏强*
李 彤 黄 娟 王 强 夏 楠 夏 强 *
(1东南大学生物科学与医学工程学院生物电子学国家重点实验室 南京 210096
2东南大学生物医学工程国家级实验教学示范中心 南京 210096
3苏州纳米科技协同创新中心 江苏苏州 215123)
脂质纳米粒(lipid nanoparticle,NP)是基于脂质的极有效的药物传输系统,主要分为固体脂质纳米粒(solid lipid nanoparticle,SLN)和纳米结构脂质载体(nanostructured lipid carrier,NLC)两种[1]。NLC由SLN改进而成,它以一定比例的液态脂质和固态脂质为混合类脂,代替SLN中的固态脂质作为载体材料[1]。与传统的基于液态脂质的给药系统(乳液、脂质体等)相比,NLC有更多优点:高稳定性、高包封率;保证亲脂性成分被保护、控制和靶向释放,提高了生物利用度,且低毒性,可低价工业化生产等[1]。
ω-3脂肪酸是食品补充剂、医药和营养食品应用中的必需脂肪酸之一[2]。早期,大量的研究报道ω-3脂肪酸有益于预防或治疗认知障碍、心血管疾病、循环系统疾病、免疫功能障碍和炎症[2]。亚麻籽油(Linseed oil)富含ω-3脂肪酸,已成为重要的功能食品成分[3]。然而,由于富含不饱和脂肪酸,所以亚麻籽油容易氧化酸败[3]。通过NLC技术的封装和添加抗氧化剂可有效预防油脂的氧化,从而保护亚麻籽油的功能特性[1,4]。Michotte 等[4]的研究表明:酚类化合物黄酮醇是亚麻籽油中不饱和脂肪酸的有效保护剂。
白藜芦醇(Resveratrol,Res)是一种天然多酚,它对人类健康有很大的益处,如抗氧化,抗炎,神经保护,化学预防和化学治疗效果等[5]。基于抗氧化性质,Res具有清除自由基,抑制脂质过氧化和DNA损伤以及改善内源性抗氧化剂防御的能力[5]。尽管低溶解度和光不稳定性限制了Res的应用,利用纳米技术还是可以克服这些问题[5]。
考虑到亚麻籽油的功能特性和Res的抗氧化性,本文将这两种功能成分共同封装在NLC中,进行一系列体外表征研究。
1 材料与仪器
1.1 材料
白藜芦醇(Res,98%,上海德恩得医药科技有限公司),亚麻籽油(加拿大TA Foods公司),中链甘油三酯(MCT,印度尼西亚Britz公司),单硬脂酸甘油酯(GMS,莘县新星油脂有限公司),六聚甘油单硬脂酸酯(P6,上海日光化学贸易有限公司),水性单甘脂(广州胜欣化工科技有限公司),甘油(Biosharp 公司),1,1-二苯基-2-苦肼基(DPPH,东京化成工业株式会社),硫氰酸铵(上海麦克林生化科技有限公司),2-硫代巴比妥酸(TBA,国药集团化学试剂有限公司)。
1.2 设备与仪器
FB-110Q高压均质机,上海励途机械设备工程有限公司;RW20型数显型悬臂搅拌器,德国IKA公司;EMS-20水浴磁力搅拌器,金坛市岸头仪都仪器厂;JEM-2100透射电子显微镜,日本电子株式会社;a-1900PC紫外可见分光光度计,上海谱元仪器有限公司;D8-Discover X射线衍射仪,德国Bruker公司;DSC-8000差式扫描量热分析仪,美国PerkinElmer公司;N4 Plus亚微米粒度分析仪,美国Beckman Coulter公司;DNP-9052电热恒温培养箱,上海精宏实验设备有限公司;KQ-250DE型数显超声波清洗器,昆山市超声仪器有限公司;ZF-2型三用紫外仪,上海市安亭电子仪器厂。
2 试验方法
2.1 NLC的制备
采用热高压均质法制备NLC[6]。分别称取一定量的单硬脂酸甘油酯、中链甘油三酯、水性单甘脂、六聚甘油单硬脂酸酯,70℃混匀后加入白藜芦醇和亚麻籽油,继续搅拌至形成油相,将同温度的去离子水和甘油混匀后边搅拌边加入到油相中,以上混合物继续搅拌,最后通过预热的高压均质机处理,高温液体冷却后得白藜芦醇和亚麻籽油复配的纳米结构脂质载体(RL-NLC)。
2.2 粒径和PDI的测定
样品稀释后用N4 Plus亚微米粒度分析仪测量其粒径分布,测量温度25℃,测量角度90°,平衡时间10 min。
2.3 微观形貌
样品稀释后滴在铜网上,用1%磷钨酸水溶液负染,风干后放在透射电镜下观察。
2.4 含量及包封率
绘制Res在307 nm处的标准曲线,采用紫外分光光度法测定Res的含量和包封率[7-8]。量取60 μL 样品(RL-NLC),乙醇稀释至25 mL,超声破乳30 min后测得在307 nm处的吸光度,代入标准曲线方程计算出Res的含量W1。
包封率的测量方法为,分别取400 μL样品于超滤离心管中,在10 000 r/min下离心20 min,收集300 μL滤液用乙醇稀释至10 mL,在307 nm处测吸光度并计算出滤液中的Res含量W2,包封率(Encapsulation efficiency,EE)的计算公式为:

2.5 X射线衍射分析(XRD)
通过X射线衍射仪分别得到RL-NLC,Res以及GMS的XRD图谱,X射线源使用铜阳极(CuKa),并在40 kV、30 mA 下操作,扫描速度为0.02°/min,步长为 0.15°,扫描范围为 5°~60°。试验前对RL-NLC进行冷冻干燥处理。
2.6 差示扫描量热分析(DSC)
将GMS和RL-NLC置于铝皿中,用空白铝皿作对照,以5℃/min的速度从20℃加热到90℃,得到升温曲线。
2.7 体外模拟释放
用透析袋法进行体外模拟释放研究,释放介质为水、吐温 80和乙醇(80∶2∶20,V/V)[5]。白藜芦醇乙醇溶液(R-Ethanol)为直接把Res溶解在乙醇中形成的液体。试验时将2 mL RL-NLC或REthanol样品置于截留分子质量为10 ku的经浸泡处理的透析袋中,夹紧两端,然后悬浮于盛有200 mL释放介质的烧杯中,37℃水浴条件下缓慢搅拌。分别在0.5,1,1.5,2,4,6,8,10,12和24 h 时,取出1 mL释放介质,同时补充1 mL同温度的释放介质,稀释并用0.45 μm膜过滤后检测Res的含量,绘制Res的累积释放曲线。
2.8 DPPH自由基清除活性
根据文献中的方法来确定 RL-NLC、REthanol和L-NLC(无Res的亚麻籽油纳米结构脂质载体)的DPPH自由基清除能力[9-11]。将0.1 mL样品和4 mL DPPH乙醇溶液(0.12 mmol/L)混匀,室温避光下反应30 min,测量反应物在517 nm处的吸光度,计算DPPH清除百分比(Scavenging free radical percentage):

式中,D代表DPPH清除百分比;AC代表对照反应的吸光度;AS代表样品反应的吸光度。
2.9 脂质的加速氧化试验
将等量RL-NLC和L-NLC密封放在50℃恒温培养箱中,在第1,3,5,7,9天分析油脂的氧化情况。
2.9.1 脂质的初级氧化产物 脂质氢过氧化物是亚麻籽油中不饱和脂肪酸的初级氧化产物,本文根据Hanna Salminen等[12]的方法进行氢过氧化物的评价。将0.2 mL样品与1.6 mL异辛烷和异丙醇(3∶1,V/V)混合,振摇(10 s,3 次),离心取上层有机液0.2 mL,并加入到2.8 mL乙醇中,再加入20 μL 3.97 mol/L的硫氰酸铵溶液和20 μL亚铁溶液(0.132 mol/L BaCl2与0.144 mol/L FeSO4等体积混合,离心取上清液),室温下反应20 min后测得510 nm处的吸光度。通过绘制的Fe3+标准曲线计算过氧化值(Peroxide value,PV)。
2.9.2 脂质的次级氧化产物 脂质的初级氧化产物易分解为醛、酮、酸等,其中丙二醛(Malondialdehyde,MDA)的性质稳定,可以用来检测脂质被氧化的程度。丙二醛的含量用Sajid Maqsood等[13-14]所述方法测定。将0.2 mL待测样品与4.8 mL TBA反应液(0.375%硫代巴比妥酸,15%三氯乙酸和0.25 mol/L HCl溶液的混合液)混合摇匀,沸水加热20 min以生成粉红色液体,用自来水冷却后,10 000 r/min下离心5 min,收集上清液,测532 nm 处的吸光度。根据绘制的 1,1,3,3-四甲氧基丙烷(丙二醛)标准曲线计算硫代巴比妥酸反应物(TBARS)的浓度。
2.10 光照稳定性
使用紫外灯评价Res的光照稳定性[8]。将5 mL样品等分成5份放在相同规格的透明玻璃瓶中,暴露在365 nm的紫外线下1 h,每隔15 min取出一份样品,在307 nm处测其吸光度。
2.11 储存稳定性
在相同时间间隔下(0,1,2,3月)对储存在25℃避光环境中的RL-NLC进行粒径和包封率的测量,分析评价样品的储存稳定性。
3 结果和讨论
3.1 物理化学性质的表征
测得RL-NLC的粒径为104.9 nm±3.4 nm,PDI为0.216±0.025。PDI用于衡量颗粒的粒径分布宽度,一般来说,PDI越大,表示颗粒大小相差越大,PDI越小,表示颗粒大小越均一,该体系的PDI<0.3,说明RL-NLC具有较窄的粒径分布,均一性较好[15]。
RL-NLC的包封率与Res的生物利用度相关,包封率高的载体的应用价值往往较高。RLNLC的包封率为98.4%±0.2%,说明Res被很好地包裹在脂质颗粒中。
3.2 形态表征
透射电镜结果如图1所示。大部分RL-NLC为规则的球形颗粒,粒径在100 nm左右,没有明显的聚集现象,说明RL-NLC具有很好的单分散性。
3.3 X射线衍射分析(XRD)
图2为RL-NLC、GMS和Res的X射线衍射光谱,可以看出 Res在2θ=6.6°,16.4°,19.2°,22.3°,23.6°,28.3°处有很强的衍射峰,表明Res具有结晶性质[9,15],而RL-NLC中Res的这些峰消失了,这说明Res是以无定形的形式存在于脂质中或是溶解在脂质中的。也可能有一些Res溶解在乳化剂中[15]。
长链脂肪酸 GMS在2θ=19.6°和2θ=23.7°处分别表现出β型(三斜晶体结构)和β′型(正交晶体结构)晶体结构的较强衍射峰,而制备的NLC在2θ=21.5°处也有衍射峰,这是α型(六边形结构)晶体结构的特征,这是因为在NLC的冷却过程中,GMS倾向于无序的α型晶体结构[15]。随着时间和温度的变化,α型会经由β'型转变为β型,但是NLC中液态脂质的加入会阻碍脂质的结晶[15]。
3.4 差示扫描量热分析(DSC)
DSC可用于评价纳米载体中脂质的状态。GMS在61.3℃处出现吸热峰,而RL-NLC的升温曲线中吸热峰为41.5℃,这说明在升温过程中出现了固体脂质的融化现象,由此证明RL-NLC中的脂质基质主要呈固态,具有脂质纳米粒的特征[15]。吸热峰的移动可以证明脂质基质中晶格缺陷的存在,这种晶格缺陷可能是由于液态脂质的加入。
3.5 体外模拟释放
体外模拟释放研究一定程度上可以阐明Res的释放机制。从图4可看出NLC中Res的释放速度比乙醇溶液中慢,24 h后,仅有60.6%±2.0%的Res从NLC中释放出来,而乙醇溶液中释放出的Res高达86.0%±3.1%。NLC中Res的释放缓慢且持续,这说明通过纳米脂质载体对Res进行包裹后,延长了Res的释放时间,两种溶液模拟释放的差异可能跟RL-NLC的结构特征有关,在脂质基质中的Res更不容易被释放出来,因而具有持续和缓慢的特点。缓慢释放能够获得较稳定的药物浓度,使药物的有效作用时间得到延长,从而提高其生物利用度[5]。
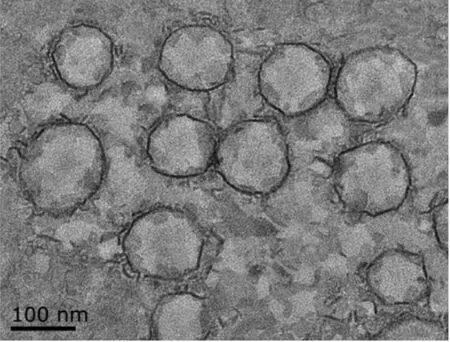
图1 RL-NLC的透射电镜图Fig.1 The transmission electron microscopy of RL-NLC

图2 RL-NLC、GMS和Res的XRD光谱Fig.2 XRD patterns of RL-NLC,GMS and Res

图3 RL-NLC和GMS的DSC升温曲线Fig.3 DSC melting curves of RL-NLC and GMS
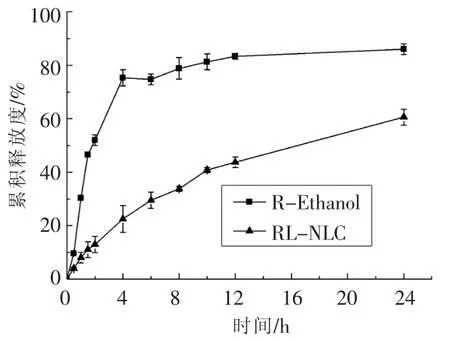
图4 RL-NLC和R-Ethanol 24 h的体外释放曲线(n=3)Fig.4 In vitro release curves of RL-NLC and R-Ethanol
3.6 体外抗氧化活性分析
DPPH自由基清除法是一种简便且有效的用来评价体系抗氧化性能的方法。试验发现(表1),Res乙醇溶液的抗氧化活性约为26.9%,而添加亚麻籽油并制成RL-NLC后,抗氧化活性增加到51.4%左右,无Res的亚麻籽油NLC(L-NLC)只有很小的抗氧化活性。该结果说明,Res和亚麻籽油可能具有协同增效作用。

表1 3种样品的DPPH清除百分比(n=3)Table 1 DPPH radical scavenging activity of three samples(n=3)
3.7 脂质的加速氧化试验
本文研究了3种体系的亚麻籽油抗氧化能力,即无Res的亚麻籽油水包油乳液(L-NE)、无Res的亚麻籽油NLC(L-NLC)与白藜芦醇和亚麻籽油复配的NLC(RL-NLC)。脂质初级氧化产物(PV)和脂质次级氧化产物(TBARS)的含量如图5和图6所示。试验伊始,3种体系的PV值相近,而随着时间的增加,PV值呈现出增加的趋势,但是3种体系的差距已显现出来:同一天的PV值L-NE>L-NLC>RL-NLC,并且Blank-NE的涨幅比其它两种大。第1天时,L-NE的TBARS值小于L-
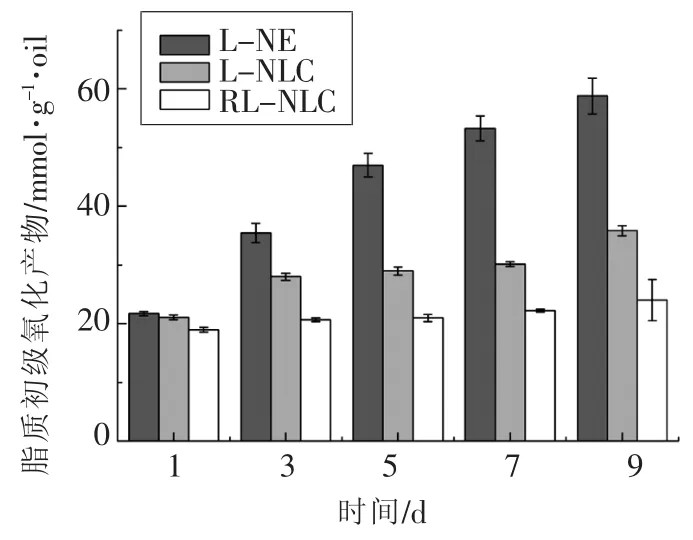
图5 50℃储存期间的脂质初级氧化产物浓度(n=3)Fig.5 Concentrations of primary oxidation products during storage at 50℃(n=3)
3.8 光照稳定性
在紫外光的照射下,正常情况下的反式Res会向顺式Res转变,这一转变可能会降低Res的生物活性,如自由基清除活性和抗炎活性等[8]。本文将制备的RL-NLC和R-Ethanol分别暴露在紫外灯下1 h,每隔15 min测出剩余的Res含量,该值与0 min时的白藜芦醇含量相比得到剩余的反式Res百分比。由图7可以看出,1 h后RL-NLC中的反式Res含量为85.0%±0.4%,而R-Ethanol中仅剩余68.4%±0.8%,这说明本文制备的RLNLC对Res具有保护作用,能延缓Res的降解。
3.9 储存稳定性
25℃下密封避光储存3个月后,RL-NLC的粒径、PDI及包封率如表2所示。RL-NLC的粒径为100 nm左右,并且随着时间的增长而轻微增大,表现出良好的稳定性。在储存过程中,粒径和PDI的增加可能是由于颗粒间的相互碰撞、聚合。NLC的值,这可能是由于制备NLC时的加热处理造成少量的亚麻籽油被氧化。第3天之后的TBARS值表现出和PV值相似的大小规律,并且L-NLC和RL-NLC的TBARS值几乎没有变化。
总而言之,3种体系中亚麻籽油的抗氧化能力表现为L-NE<L-NLC<RL-NLC,造成这种结果的原因可能是:NLC中的脂质被GMS固化,形成亚麻籽油的保护壳,因而具有更好的稳定性,而水包油乳液中的脂质为液态更容易被氧化;Res发挥了其作为抗氧化剂的效果,能有效抑制亚麻籽油的氧化[14]。包封率在3个月后降低为90.5%±0.5%,这说明虽然有少量的Res泄露到了水中,但是大部分Res仍被包裹着。总之,本文研究的RL-NLC可以在25℃避光条件下储存3个月以上。
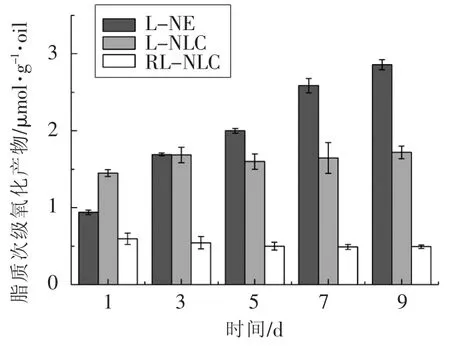
图6 50℃储存期间的脂质次级氧化产物浓度(n=3)Fig.6 Concentrations of secondary oxidation products during storage at 50 ℃(n=3)

图7 暴露在365 nm紫外光下1 h剩余的反式白藜芦醇百分比(n=3)Fig.7 Percentage of remaining trans-resveratrol after direct exposure to UV-light at 365 nm for 1 h(n=3)
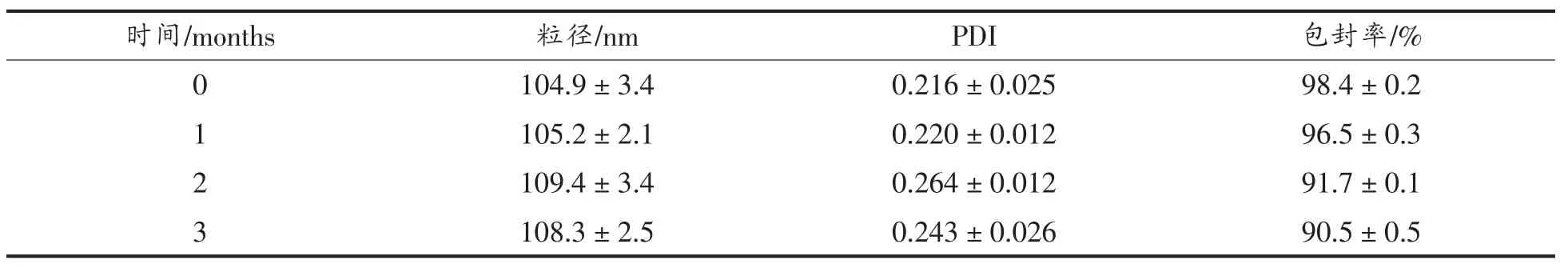
表2 RL-NLC的粒径和PDI(n=3)Table 2 The particle size and PDI of RL-NLC(n=3)
4 结论
使用热高压均质法成功制备出了白藜芦醇和亚麻籽油复配的纳米结构脂质载体,该体系具有良好的物理稳定性、光稳定性和缓慢释放的特点。DPPH自由基清除试验的结果证明了白藜芦醇的抗氧化活性和亚麻籽油对它的促进作用。此外,脂质的加速氧化研究中发现,NLC的固态核结构抑制了亚麻籽油的氧化,并且白藜芦醇的抗氧化作用显著。本文研究的白藜芦醇和亚麻籽油载体,在功能食品领域具有潜在的应用价值。
