海洋酵母自溶突变株生产单细胞蛋白及其组分分析
2019-10-12赵春海李文张池振明王志鹏
赵春海李 文张 瞳 池振明 王志鹏
(1滨州职业学院 山东滨州 256603
2中国海洋大学 山东青岛 266000
3中国水产科学研究院黄海水产研究所 山东青岛 266071)
单细胞蛋白(single cell protein SCP)通常是指来源于藻类、酵母、真菌或细菌细胞的蛋白质,已应用在食品工业和动物饲料工业上。SCP单细胞可以追到1966年,由威尔逊学院卡罗尔命名。单细胞蛋白的发展是随着微生物发酵废料(包括木材、稻草、罐头食品,食品加工废料,纤维、酒精生产下脚料或人类及动物的排泄物)而发展起来的[1-6]。
产单细胞蛋白的微生物种类很多,如多种海洋微藻、细菌、酵母、霉菌[7-9]。作为单细胞蛋白的酵母细胞优于其它微生物细胞。Rhishipal等[10]在印度的柯钦港浅海海岸分离到多株海洋酵母菌,并将其培养在含有虾壳的废料中,经海洋假丝酵母M15转化发酵处理,虾壳终产物中蛋白含量由38.5%增加到70.4%。Brown等[11]发现并分离到几株海洋酵母(Debaryomyces hansenii ACM 4784,Dipodascus capitatus ACM 4779和Dipodascus sp.ACM 4780)的蛋白含量分别为23%,32%,36%,海洋酵母细胞中营养物质丰富,蛋白质的含量高且质量好,除蛋白质外还含有糖类,主要来源于酵母细胞壁的多糖,尤其是还含有一种具有免疫活性的多糖类物质,能增强海产动物的抵抗力;然而其缺少二十碳五烯酸,二十碳六烯酸[11],使海洋酵母单细胞蛋白不能用于种苗的饲养。
目前作者研究发现金黄色引球酵母G7a能够在多种碳源培养基上生长,并能分泌大量菊粉酶到培养基中,其细胞可作为单细胞蛋白的供体,其每升发酵液产生干细胞10.1g,粗蛋白含量53.0g/100g。众所周知,酵母菌含有厚且硬的细胞壁,约有200nm的细胞膜。细胞壁外层主要成分β-1,3和β-1,6甘露聚糖,内层为葡聚糖,间层有一层蛋白质分子。总的来说,动物细胞不能合成相关的酶类去分解酵母菌细胞壁,在动物肠道内很难直接利用酵母细胞,阻碍了大范围的使用。在酿酒酵母、假丝酵母、曲霉、毕赤酵母中都发现自容突变株[12-13],在敏感温度下,这些酵母菌释放包内物质到细胞外和培养基中。这些突变株的共性是:在非耐受温度(通常37℃)下培养便丧失了生存能力。Zhang[13]研究获得一株蛋白质高产菌,命名Z114,经37℃蒸馏水过夜处理,能够释放大量胞内蛋白。
雪莲果是多年生草本植物,其茎含有菊粉和多聚果糖[14-16]。用此植物作为营养物质来培养Z114菌株。为了获得合适的培养条件,通过单因子和正交试验,确定合理的培养条件,并对释放到胞外的蛋白质进行氨基酸组分分析,同时测定脂肪酸、核酸及维生素C的浓度,为一步利用海洋酵母单细胞蛋白质打下良好的基础。
1 材料与方法
1.1 材料与试剂
1.1.1 酵母菌株 本试验自行分离并保存的Cryptococcus aureus G7a[13],Z114 为 G7a 突变株(每升发酵液能产生干细胞达到10.1 g,粗蛋白含量在53.0 g/100 g突变株),酵母菌保存在YPD培养基中,4℃保存。
1.1.2 主要溶液 pH 2.2的柠檬酸-柠檬酸钠缓冲液;0.4 mol/L KOH-甲醇溶液:11.2 g KOH溶于500 mL无水甲醇中;14%BF3-甲醇溶液:30 mL BF3/乙醚加入到75 mL无水甲醇中。
1.1.3 仪器与设备日立835型高速氨基酸自动分析仪,安捷伦气相色谱仪6890。
1.2 方法
1.2.1 雪莲果处理 取100 g雪莲果,去皮,用水蒸煮,100℃ 3 min,水解液过滤,适当稀释60.0,80.0,100.0,120.0,140.0,160.0,180.0和200.0 g/L,115℃灭菌,30 min。
1.2.2 豆饼粉水解液 取32g豆饼粉与250 mL水混合,加入0.25 mol/L盐酸沸腾处理25 min,冷却后用1.0 mol/L氢氧化钠调节pH值到5.5,稀释到200 mL,终质量浓度为160.0 g/L。
1.2.3 多因子正交试验 为了考察各因素之间的相互作用,优化适合Z114蛋白质合成的发酵条件,根据已经研究的结果,选择了对单细胞蛋白影响较大的因素进行试验,通过L9(33)正交表进行组合(表1),结果数据分析通过 Qualitek-4(2000)软件分析[17]。
1.2.4 单细胞积累 取一环保存的菌株接种到液体培养基(YPD)中,培养24 h,到达所需浓度(OD600nm=30.0),取5 mL分别接种到45 mL的三角瓶(25.0 g/L豆饼粉,15.0 g/L硫酸铵,180.0 g/L雪莲果浸出液)28℃,培养3 d。
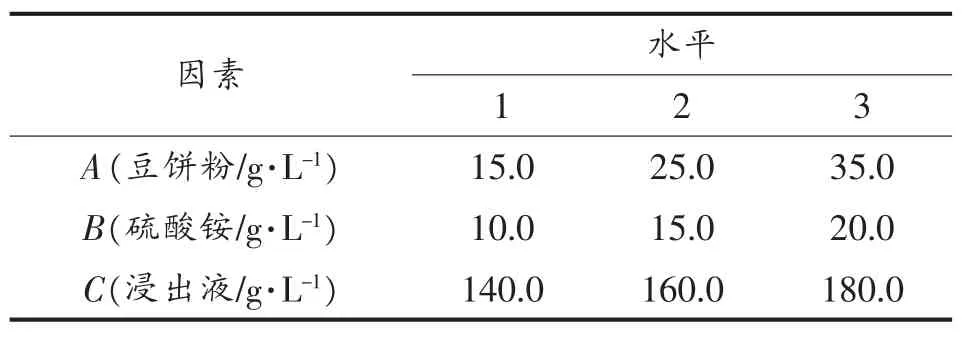
表1 正交因素水平Table 1 L9(33)Orthogonal array design:factors and levels for orthogonal test
1.2.5 自溶突变株释放蛋白质的测定 将所选的自溶突变株接种到优化培养基中培养至24 h后,在4℃,5 000 g离心条件下收集发酵菌体,将菌液用0.9%的生理盐水进行离心洗涤,最后溶解在0.9%的灭菌生理盐水中,使细胞的密度达到108个/mL。上述细胞悬浮液分别28℃和37℃培养过夜,第2天用考马斯亮蓝法测上清中放出蛋白质的含量[13]。
1.2.6 细胞干重的测定 将酵母接种于优化培养基中28℃,170 r/min培养。取10 mL发酵液,在4℃、5 000 g条件下离心用生理盐水洗涤并重复3次,每次离心10 min,获得的细胞放于电热恒温干燥箱内80℃干燥至离心管恒重[12],然后将烘干的菌体用研钵研碎成粉取50 mg的烘干后的细胞在180℃消化1.5 h,通过凯氏定氮进行蛋白质的测定。
1.2.7 总糖和还原糖的测定 还原糖通过赛式方法测定,总糖水解成还原糖加以测定[7]。
1.2.8 氨基酸分析 将烘干至恒重菌粉取40 mg放于安瓿瓶中,吸取1 mL 6 mol/L于安瓿瓶中混匀。将安瓿瓶抽真空10 min立即用酒精喷灯封口。将安瓿瓶放置于烘箱中110℃下维持24 h。打开安瓿瓶进行过滤,然后将样品转移至烧杯或平皿中水浴干燥,加入1 mL蒸馏水再蒸干,如此反复两次,最后加入1 mL pH 2.2柠檬酸-柠檬酸钠缓冲液供仪器测定[18]。
必需氨基酸指数的测定方法:
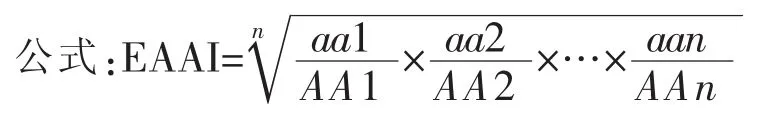
公式中aai——样品中某必需氨基酸占必需氨基酸总量的百分数;AAi——参比蛋白中该必需氨基酸占必需氨基酸总量的百分数。
1.2.9 脂肪酸含量的测定 将菌体烘干至恒重,去10g分别加入KOH-甲醇溶液、BF3-甲醇溶液二次混匀、在此加入正己烷,最后加入饱和NaCl溶液,通过气相色谱仪上进行GC分析[19-22]:注入温度:170℃;注入初始时间:1 min;最后温度230℃;监测器温度:260℃;载气:N2。
1.2.10 核酸与维生素C的测定 DNA和RNA的测定参照Burton的方法,脱氧核糖核酸和核糖核酸分别通过二苯胺和地衣酚法测定[13]。
维生素从细胞中提取维生素C用Hancock方法测定[13]。
2 结果与分析
2.1 不同浓度雪莲果提取物对蛋白质积累的影响
选择不同浓度的雪莲果提取物进行试验测定其对自溶突变株Z114蛋白质合成的影响,分别选择 60.0,80.0,100.0,120.0,140.0,160.0,180.0和200.0 g/L提取物加入生产培养基中,以蛋白质含量为主要指标,结果表明在160.0 g/L下如图所示:细胞粗蛋白含量超过48.85%。
2.2 不同氮源对单细胞影响
为了测定不同氮源对自溶突变株Z114蛋白质合成的影响,分别选了硫酸铵、酵母粉、蛋白胨、豆饼粉为氮源,在4种氮源中,酵母粉(40.0 g/L),豆饼粉(35.0 g/L),蛋白胨(40.0 g/L)含量较高,表明这些氮源含有丰富的氨基酸,比较容易吸收和转化为单细胞蛋白[12]。

图1 不同雪莲果提取物浓度对单细胞蛋白的影响Fig.1 Effects of different yacon extract concentrations on the mutant Z114 accumulation single cell protein
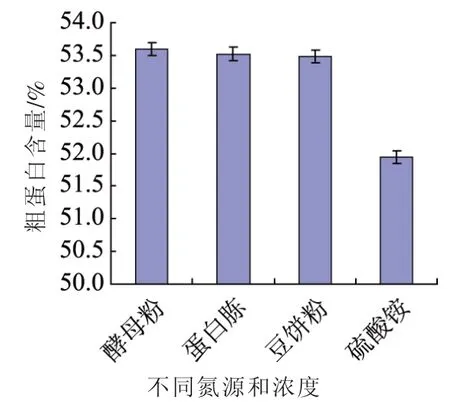
图2 不同氮源对单细胞蛋白的影响Fig.2 Effects of different nitrogen sources on the mutant Z114 accumulation single cell protein
2.3 多因子试验
根据单因子试验结果,培养基中选择了包括豆饼粉、硫酸铵、雪莲果浸出液营养机制,进行多因子正交L9(33)优化试验,其中选择豆饼水解液和雪莲果提取液作为氮源,这两种氮源富含氨基酸与铵且来源于农副产品,供应充足,且两种氮源价格相对低廉[12]。其它条件,温度、pH值、装样量、转速、 接种量分别:28℃、pH 自然、50 mL、170 r/min、10%(种子培养基中细胞浓度为 OD600nm=30.0 mL/100 mL),经过3 d培养,进行细胞分离与蛋白质的测定结果如表2所示。
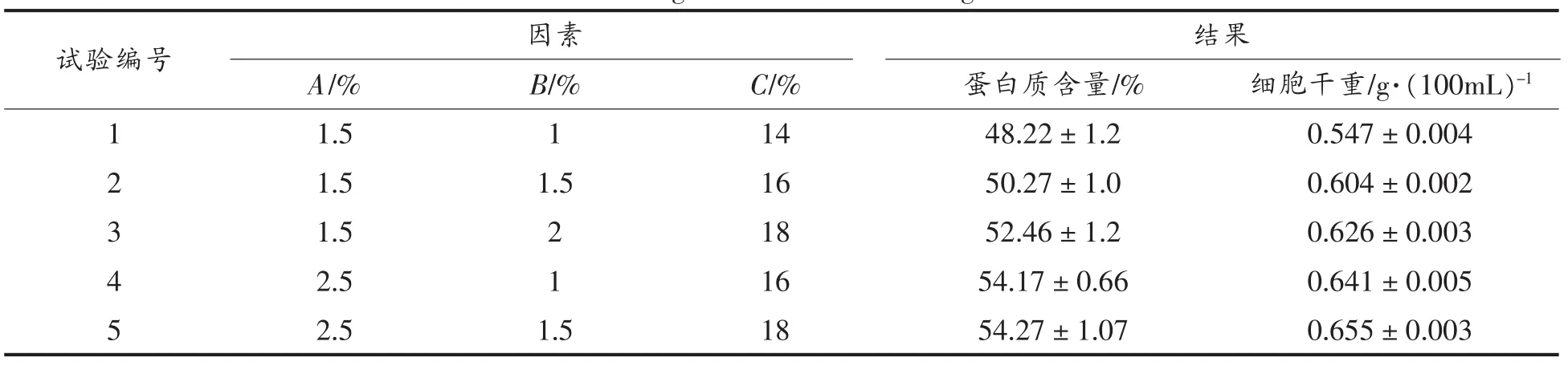
表2 结果分析Table 2 Design and results of orthogonal test

(续表2)
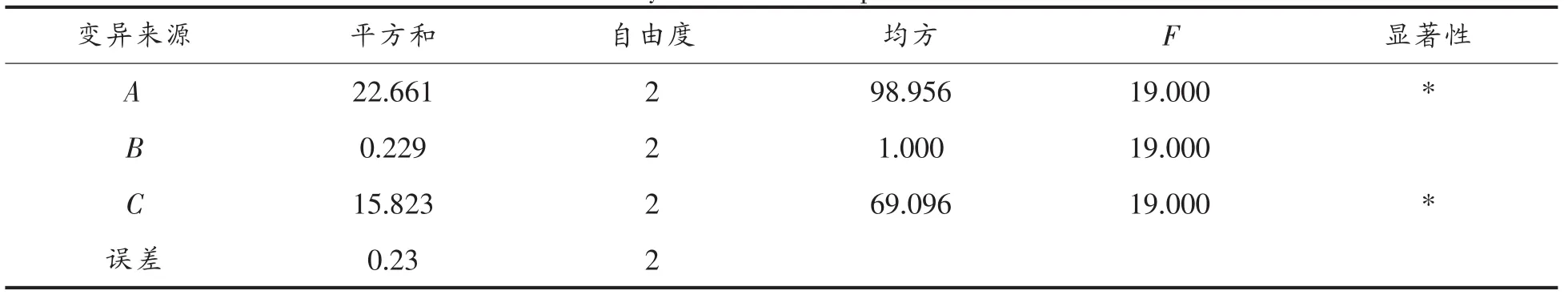
表3 方差分析Table 3 Analysis of the total protein of variance
多因素的结果分析如表2所示,主要因素依次是(A>C>B),最高单细胞浓度达到 54.3%,最佳组合是A2C3B2。并且培养基对蛋白自容无明显影响。
方差分析表明水平间差异显著(F>F0.05=19.00),A(豆饼粉)、C(浸出液)两因素对蛋白影响显著。
2.4 细胞生长曲线和单细胞关系
在培养基优化主要成分确定基础上,测定了Z114细胞生长于单细胞蛋白积累随时间变化曲线,结果如图2所示,经过培养45 h发酵,细胞中蛋白含量为59.1%。提取分离的细胞在蒸馏水中悬浮培养分别经过28和37℃过夜处理,测定胞内蛋白的释放率,结果表明在37℃蛋白释放达到61.84%,对照组28℃只有4.25%释放率。
2.5 还原糖的变化
分别测定了发酵培养基中初始培养基中总糖和还原糖浓度,以及发酵结束后培养基中残留总糖和残留还原糖,结果发现G7a菌株总糖和还原糖的利用率分别为75.55%,81.69%,突变株Z114总糖和还原糖的利用率分别为71.11%和80.28%。还原糖的变化如表4所示,大部分糖都被利用。残糖含量较低,不会对环境造成污染。
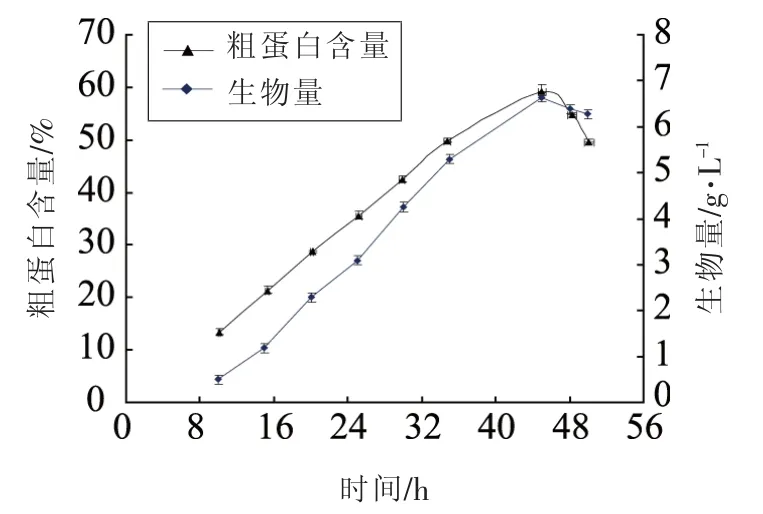
图3 细胞生长与蛋白生产曲线Fig.3 Time course of cell growth and single cell protein production
2.6 氨基酸分析
氨基酸组分分析表明G7a和自溶突变株利用雪莲果提取物生产的单细胞蛋白都含有高浓度的必需氨基酸,尤其含有赖氨酸,蛋氨酸,亮氨酸,非必须氨基酸中天冬氨酸和谷氨酸含量较高含量在(2.6%~13.68%),结果与本实验室之前研究结果相似。菌株G7a和其自溶突变株氨基酸指数分别为1.03和1.29,表6也表明在酵母细胞中大部分必需氨基酸含量都高于联合国粮食及农业组织规定标准。
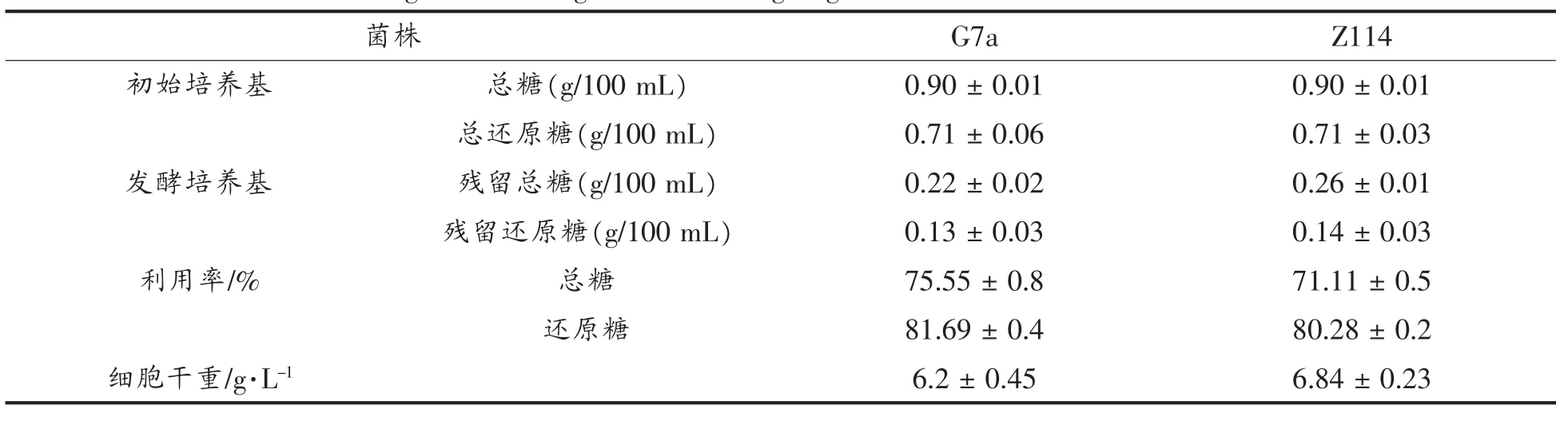
表4 培养基中总糖和还原糖的变化Table 4 The change of total sugar and reducing sugar in the initial media and fermented media
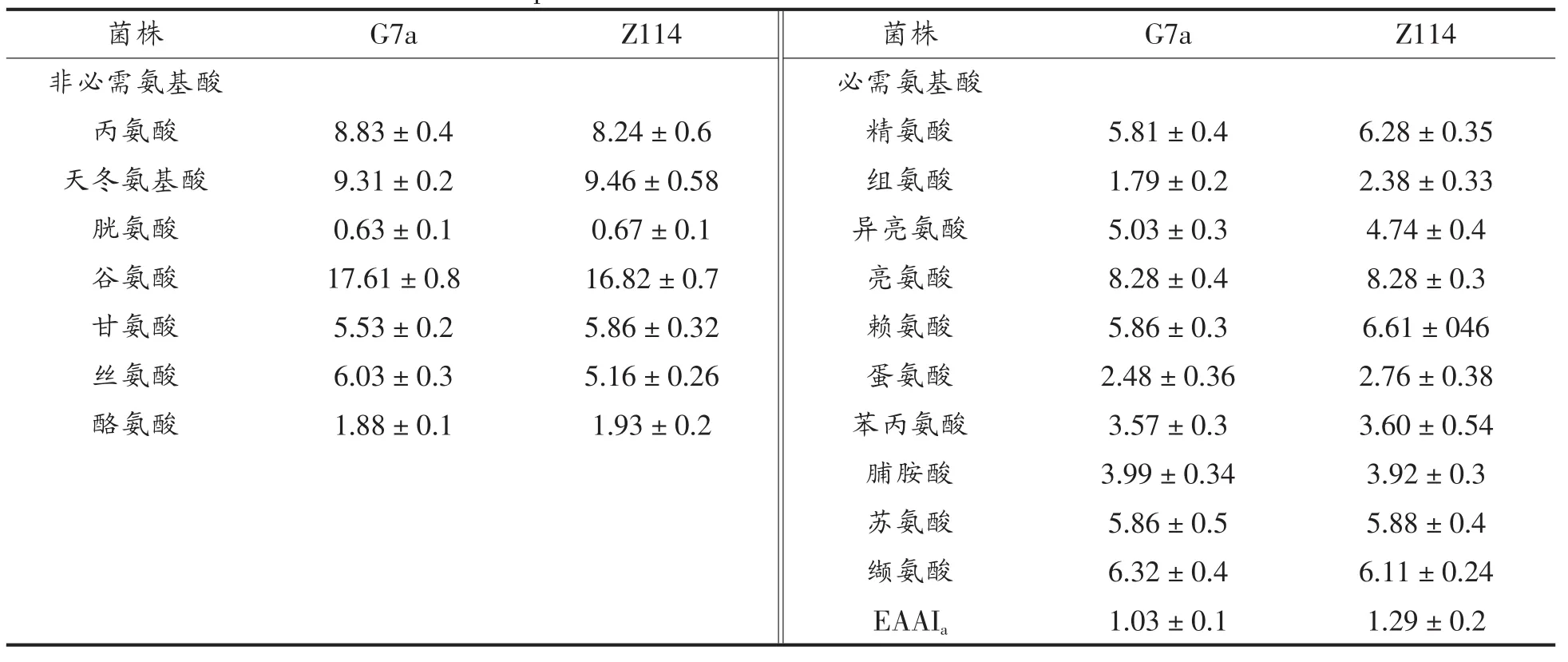
表5 蛋白质中氨基酸组分分析Table 5 Amino acid compositions of total amino acids of strain G7a and the mutant Z114
2.7 脂肪酸分析
以雪莲果提取物为主要营养成分,测定了野生型和突变株在发酵生产的单细胞蛋白中脂肪酸的组成,结果表明无论在野生型和突变型中都含有少量的 C17:0脂肪酸,并含有大量的 C16:0,C18:0,C18:1,C18:2脂肪酸。
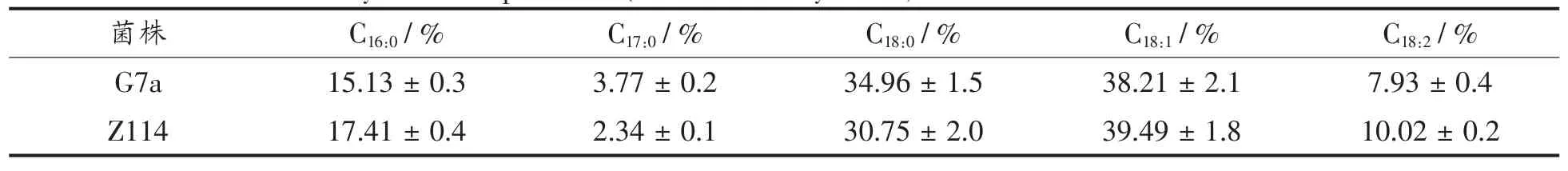
表6 野生型菌株与突变株细胞中脂肪酸分析Table 6 Fatty acid compositions(%of total fatty acids)of strain G7a and the mutant Z114
2.8 核酸与维生素C分析
核酸含量测定显示突变株在雪莲果提取物中发酵生产单细胞蛋白核酸含量在2%左右,可以作为饲料使用[24],维生素C具有多种生理功能是很多生物生长所必需的,经过雪莲果提取物培养的突变株细胞维生素C含量如表7所示达到2.3 mg/100 g。

表7 G7a和Z114菌株细胞中核酸和维生素C浓度Table 7 Nucleic acids content and ascorbic acid content of G7a and Z114
3 讨论
当细胞培养在160.0 g/L雪莲果提取物时,每100 g恒重的干细胞可以获得48.85 g粗蛋白,通过正交试验最终确定发酵条件为温度、pH值、装样量、转速、接种量,分别为:28℃、pH自然、50 mL、170 r/min、10%,雪莲果提取质量浓度为180.0 g/L,豆饼粉水解液质量浓度为25.0 g/L,硫酸铵质量浓度为15.0 g/L,如表所示在此条件下培养45 h粗蛋白浓度59.1%,目前研究表明单细胞蛋白含量在39%~73%[22],也说明自溶突变株为雪莲果提取物为主要碳源积累单细胞蛋白达到较高的水平,经过37℃过夜处理蛋白释放达到61.84%,对照组28℃只有4.25%释放率,也证明以雪莲果提取为主要营养物质并未影响突变株粗蛋白的释放。
糖的利用率试验表明,不论是野生型还是突变菌株都能够充分利用雪莲果提取物进行细胞生长,同时用于单细胞蛋白质的合成。氨基酸组分分析表明自溶突变株利用雪莲果提取物转化合成了大量必需氨基酸,其中亮氨酸、赖氨酸、苯丙氨酸含量比Brown等[11]的研究有一定提高。
研究结果表明:在雪莲果提取物为氮源的培养过程中,核酸的含量很低,在2%左右,与之前研究结果相似[7,9,13],文献报道酿酒酵母核酸含量在7%~10%[23],作为单细胞蛋白的成分之一,核酸对于水产动物[24]、家畜动物的肠道吸收都有一定促进作用[25]。同时维生素C含量达到2.3 mg/100 g,说明突变株在雪莲果提取物中生产的蛋白营养丰富。脂肪酸组分分析表明野生型和突变菌株都含有 大量的 C16:0,C18:0,C18:1,C18:2但是缺少两种海洋生物所必需多不饱和脂肪酸(C20:5,C22:6),也说明海洋酵母菌不能合成这两种脂肪酸。
众所周知,雪莲果茎中含有高浓度的菊粉,在研究中我们发现以自溶突变株为研究对象,雪莲果浸出液可以作为培养基产生单细胞蛋白,在发酵结束时,总糖和还原糖含量都很低,表明突变株可以利用菊粉,在培养45 h后,粗蛋白和释放蛋白分别为59.1%和61%,同时单细胞蛋白中还有动物必需氨基酸和其它营养成分,突变株细胞可以作为单细胞蛋白应用到生产中。
