低氧训练对大鼠小肠微生物的影响
2019-10-11韩天雨胡扬于加倍
韩天雨 胡扬 于加倍
北京体育大学(北京 100084)
高原地区自然环境具有低氧浓度和低气压的特点,研究表明[1,2],世居平原者暴露于高海拔地区(≥2500m)易于出现多种器官受损,急性高原暴露者胃肠道发病率显著高于世居高原者,其中消化系统表现最严重,尤其是肠道。高原训练中的运动员同时受到运动和缺氧双重刺激。研究表明[3],短期激烈以及长期显著的环境条件改变,均可导致人体微生态系统变化,引起肠道菌群生存环境出现异常,使得正常菌群种类和数量减少,进而导致肠道微生态失调、菌群平衡被打破等后果。
肠道细菌对宿主的健康意义重大[4],不仅仅是帮助消化吸收营养物质,人体免疫系统的正常工作也需要肠道菌群的参与。低氧环境会导致肠道内微生物群落的组成结构发生改变,进而导致肠黏膜机械屏障受损肠道通透性增加,甚至发生功能障碍;随着肠道通透性的增加,细菌及其抗原可以轻易地通过肠黏膜,激活免疫细胞诱发异常免疫反应,大量炎性因子被释放入血液及周边组织中[5]。与此同时,异位至小肠组织中的细菌过度生长还会导致肠道机械运动发生异常,糖类及脂类营养物质吸收代谢发生异常,最终引发腹痛、腹胀、呕吐、腹泻等一系列消化系统症状[6]。
综上,本研究在实验室环境中对大鼠进行低氧及运动干预,旨在阐明低氧应激及低氧、运动复合应激对大鼠肠道微生物的影响,为高原训练提供科学指导。
1 对象与方法
1.1 实验动物与分组
研究对象为8周龄清洁级雄性SD大鼠120只,体重240~260 g,购自军事医学科学院实验动物中心[许可证号:SCXK(军)2012-0004],饲养于北京体育大学科学研究中心动物实验室[许可证号:SYXK(京)2016-0033],恒温(22℃~25℃)恒湿(75%),12小时昼夜交替,自由进食饮水。实验动物研究方案已通过北京体育大学运动科学实验伦理委员会批准(2016010)。
适应性饲养1周后,采用分层随机抽样法按体重随机分为,常氧安静组(normal oxygen sedentary,NOS组),常氧运动组(normal oxygen exercise,NOE组),低氧安静组(low oxygen sedentary,LOS组),低氧运动组(low oxygen exercise,LOE组),每组30只。
1.2 研究方法
1.2.1 低氧剂量及训练方案
正式干预前所有大鼠进行为期5天强度递增的跑台适应性训练。适应性训练结束后24 h将各低氧组大鼠转入氧浓度为12.7%(对应4000 m海拔氧浓度)的低氧房饲养,各运动组大鼠开始正式运动干预,低氧运动组大鼠在氧浓度为12.7%的低氧房中进行训练,训练方案根据Bedford实验动物中等强度运动模型设计[7],速度24 m/min(≈70%最大摄氧量),每天训练45 min。
1.2.2 实验动物组织分离与处理
各组大鼠分别在开始运动干预后第3、6、9天的末次训练后24 h取材(消除末次运动影响),每组取材10只。用3%的戊巴比妥钠(剂量为30 mg/kg)麻醉大鼠,以瞳孔反射消失确认为深度麻醉。为保障研究人员正常安全工作、避免大鼠复氧应激,麻醉后将大鼠转入2000 m海拔氧浓度低氧房完成取材工作。沿腹正中线切口打开腹腔,腹主动脉取血处死大鼠,用玻璃分针钝性游离小肠后,用手术刀截取空肠段,将空肠置于无菌培养皿中提取肠内容物,最后将肠内容物保存于无菌冻存管中待测。
1.2.3 肠内容物全基因组DNADNA提取
将肠内容物混匀,称取100 mg样品至裂解液中,试剂盒为PowerSoil DNA Isolation Kit(美国MO BIO),提取过程严格按照试剂盒操作规程进行。得到DNA原液用NanoDrop2000进行质检,质控标准为1.8≤OD260/OD280≤2.0、浓度≥30 ng/μl。合格样品放置-20℃保存。
1.2.4 微生物多样性分析
微生物多样性分析由北京百迈客生物科技有限公司完成,主要步骤如下。
建库测序:质检后的合格样品文库用Illumina HiSeq 2500型测序仪对16SrRNA的V3-V4可变区进行测序。高通量测序所得原始图像数据文件首先进行碱基识别(Base Calling)分析转化为原始测序序列(Sequenced Reads),以FASTQ格式存储结果,其中包含测序序列(Reads)的序列信息及其对应的测序质量信息。
数据预处理:根据PE reads之间的Overlap关系,将Hiseq测序得到的双端序列数据拼接(Merge)成一条序列Tags,同时对Reads的质量和Merge的效果进行质控过滤。主要有以下三个步骤:
(1)PE reads拼接:使用 FLASH v1.2.7软件,按照最小overlap长度为10 bp,overlap区允许的最大错配比率为0.2,对每个样品的reads进行拼接,得到的拼接序列即原始Tags数据(Raw Tags);
(2)Tags过滤:使用 Trimmomatic v0.33软件,对拼接得到的 Raw Tags进行过滤,参数为设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后长度小于Tags长度75%的Tags,得到高质量的Tags数据(Clean Tags);
(3)去除嵌合体:使用UCHIME v4.2软件,鉴定并去除嵌合体序列,得到最终有效数据(Effective Tags)。
信息分析:划分操作分类单元(operational taxonomic unit,OTU)、多样性及差异性分析。
1.3 统计学方法
数据采用SPSS(version 19.0)软件进行描述性统计,实验数据以平均值±标准差表示。
微生物多样性分析中,使用QIIME(version 1.8.0)软件中的 UCLUST对Tags在 97% 的相似度水平下进行聚类、获得OTU,并基于细菌和真菌分类学数据库对OTU进行分类学注释;在此之后生成不同分类水平上的物种丰度表,选出属分类学水平上丰度最高的OTU的序列作为代表序列,多重序列比对后构建系统进化树,进行主成分分析。使用Mothur(version v.1.30)软件,对样品Alpha多样性指数进行评估,为比较样品间的多样性指数,分析时将样品所含序列数进行标准化,在97%相似度水平下进行,并计算香农指数(Shannon index)。利用Metastats软件对组间的物种丰度数据进行t检验;得到P值,通过对P值的校正,得到q值;最后根据P值或q值筛选出导致两组样品组成差异的物种。P值为假阳性概率值,是统计学中常用的判定值,当P<0.05时表示差异显著;q值为假发现率评估值,指本次计算可信度。
2 结果
2.1 测序概况及肠道微生物多样性
所有样品测序后总共得到2697529条16SrRNA序列(Reads),双端Reads拼接、过滤后共产生2206002条高质量测序标签(Clean tags),平均每个样品产生73533条Clean tags。
Alpha多样性结果如表1所示,各组样品文库覆盖率均大于99.9%,表明样本中序列中检出率极高,测序结果可以代表了样本中微生物的真实情况。在细菌研究中,通常将相似度高于97%的条目划归为一组OTU,Shannon指数和Simpson指数用于衡量群落多样性,Chao1和Ace指数用于衡量群落丰度。相同取材时间点中,相较于NOS组,仅LOE组在干预后3天时,OTU数、ACE指数、Chao1指数出现显著下降(P<0.05),提示为期3天的低氧与运动的复合应激可能导致大鼠小肠内微生物群落丰度下降,而随着干预的延续,类似的效应并未继续出现。
样品稀释性曲线及香农曲线如图1所示,稀释性曲线末端不断趋于平坦,说明本测序的数据量足够反映样品中绝大多数微生物的物种信息;而香农曲线表明,随检测条目数的增加,所有样品所检测出的OTU数量不再呈上升趋势,表明本次测序质控较好,检测序列数量已饱和,足够反映样品中物种多样性。

表1 Alpha多样性指数统计
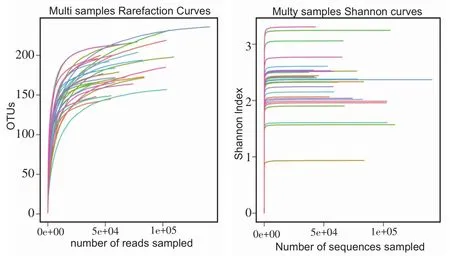
图1 样品稀释曲线(左)、香农曲线(右)
2.2 低氧训练中大鼠肠道微生物物种分布情况
不同于人类粪便或肠内容物样本,实验动物肠内容物全基因组DNA测序聚类后得到的OTU被标记为“Unassigned或Other”的比例更高。各分类学水平下物种分布如图2所示,在不考虑尚未定义OTU所代表微生物群落的情况下,干预后第3天时,NOS组大鼠包含8个门,NOE组包含9个门,LOS组包含9个门,LOE组包含9个门;干预后第6天时,NOS组大鼠包含7个门,NOE组包含9个门,LOS组包含9个门,LOE组包含8个门;干预后第9天时,NOS组大鼠包含9个门,NOE组包含10个门,LOS组包含9个门,LOE组包含8个门。

表2 干预后3天时门分类学水平下优势物种占比(%)

表3 干预后第6天时门分类学水平下优势物种占比(%)
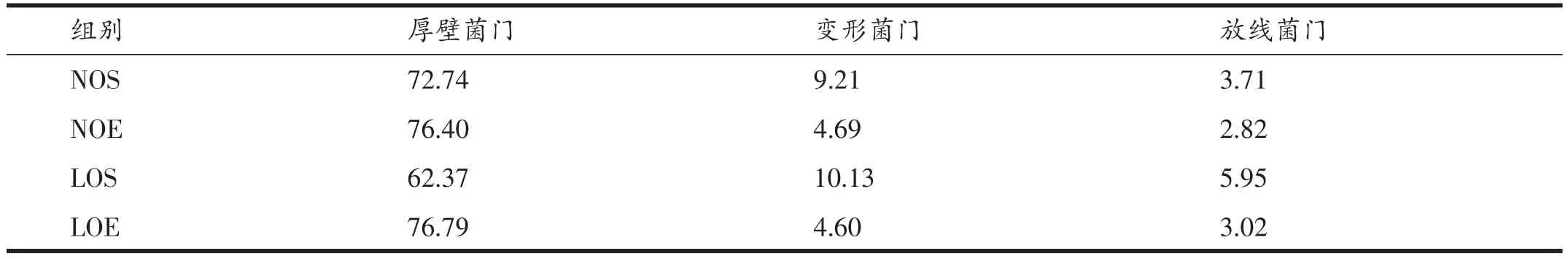
表4 干预后第9天时门分类学水平下优势物种占比(%)

图2 各分类学水平下物种分布柱状图
在不考虑尚未定义OTU所代表微生物群落的情况下,各时间点门分类学水平下优势物种占比如表2、3、4所示,大鼠肠内容物中在门水平上优势的物种分别是厚壁菌门、变形菌门、放线菌门。
2.3 低氧训练中大鼠肠道微生物分类学统计
图3所示为 OTU在属分类学水平上的系统进化树,结果表明,属水平上具有较高丰度的物种主要集中于厚壁菌门、放线菌门及变形菌门中。厚壁菌门中,属水平上丰度最高的是乳酸菌属,此外还包括葡萄球菌属、链球菌属、Incertae_Sedis菌属、Allobaculum菌属、Turicibacter菌属、Blautia菌属相对丰度较高。变形菌门中Pannonibacter菌属、假细胞菌属丰度较高;放线菌门中,节细菌属相对丰度较高;拟杆菌门中,Cloacibacterium菌属相对丰度较高。
2.4 低氧训练中大鼠肠道微生物群落相对丰度变化
在门分类学水平上,分别比较不同取材时间点优势门类中NOS组与NOE组、NOE组与LOE组、NOS组与LOE组之间的差异。结果如表5、表6、表7所示,干预后3天时,NOS组厚壁菌门的相对丰度显著低于LOS组(P<0.05);干预后第6天时,NOS组厚壁菌门相对丰度仍显著低于LOS组(P<0.05),NOS组变形菌门及放线菌门相对丰富显著低于LOE组(P<0.05,P<0.01)。结果提示,低氧暴露作为一个独立的影响因素会导致大鼠肠道微生物构成发生显著改变,低氧与运动的复合应激也会导致此效应。

图3 系统进化树

表5 干预后3天时门分类学水平下主要细菌相对表达量

表6 干预后6天时门分类学水平下主要细菌相对表达量

表7 干预后9天时门分类学水平下主要细菌相对表达量
在属分类学水平上,相对丰度超过1%的菌属分别是:乳酸菌属、节杆菌属、假单胞菌属,组间相对丰度差异结果如表8、表9、表10所示。结果显示,干预后3天时,NOS组假单胞菌属相对丰度显著高于LOE组(P<0.01);干预后6天时,NOS组节杆菌属相对丰度显著低于LOE组(P<0.05);干预后9天时,NOS组假单胞菌属相对丰度显著高于LOS组(P<0.05)。

表8 干预后3天时属分类学水平下主要细菌相对表达量

表9 干预后6天时属分类学水平下主要细菌相对表达量

表10 干预后9天时属分类学水平下主要细菌相对表达量
3 分析与讨论
3.1 实验动物低氧干预剂量的选择
以往研究认为[18],世居平原者进驻高原环境中发生肠道微生物变化或腹泻,主要影响因素来自两方面,一方面是高原特殊的环境因素,另一方面是饮食变化或饮食卫生因素。此外,高原环境还具有昼夜温差大、空气干燥、日照强度高、重力略低于平原等特点。所以高原训练中运动员除了低氧和运动应激外,还处于一个充满诸多变量的环境中,为了排除这些因素的影响,采用模拟高原训练实验动物模型的研究十分必要。
高原是以低压低氧为特点的特殊地理环境。研究表明[19],低氧是高原环境引发一系列生理应激(例如,血液流变性降低、血液中红细胞及血红蛋白数量增多、骨骼肌丢失、肠胃功能紊乱[20]等)的根本原因,低压会进一步加剧这些生理应激,对于高原训练来说,这些应激反应有利有弊,需根据项目特点选择适宜的海拔高度。相应的,用实验动物模拟高原训练的研究中核心问题也是低氧干预剂量即模拟海拔高度的选择。运动员高原训练的海拔选择既要保证一定的低氧刺激,又要注意刺激强度不能过高,否则会影响训练强度。在实验动物的低氧干预剂量选择时需要考虑一个额外因素,相较于人类及其他高级哺乳动物,大鼠等啮齿类动物对低氧的耐受能力更强,习服周期更短[21]。因此,大鼠等啮齿类实验动物进行低氧训练需选择相对于人类而言更高的低氧干预剂量,以往研究多选择低氧干预剂量为3500~4500 m海拔对应的氧浓度。为摸索合适的低氧干预剂量,本实验室在前期研究中分别在平原环境动物房(海拔48 m)及模拟2500 m、4000 m、5000 m三个不同海拔相对应氧浓度的低氧动物房,对无训练经历的SD大鼠进行为期1个月干预,期间每日观察大鼠安静时呼吸节律、自主活动度,记录大鼠体重动态变化,检测血液红细胞及血红蛋白数,并采用抗阻爬梯训练(坡度85°,梯长1.2 m)评估大鼠在不同氧浓度环境中的运动能力。结果发现,相较于平原状态,大鼠在模拟2500 m海拔氧浓度环境中仅在干预开始后三天内出现体重滞长,随后便逐步增加并在五天内达到与平原组大鼠相当的体重水平,在该氧浓度下大鼠可以轻松完成5组(每组3次,间歇30 s,组间间歇5 min)100%体重负重的爬梯训练;大鼠在模拟4000 m海拔氧浓度环境中出现体重下降现象,一直持续至干预后第9天,此后体重逐步回升,至干预后第14天恢复至干预前水平,在该氧浓度下大鼠可以完成5组(每组3次,间歇30 s,组间间歇5 min)60%体重负重的爬梯训练,且未达到力竭;大鼠在模拟5000 m海拔氧浓度环境中表现出明显的呼吸急促和嗜睡,在简单刺激和鼓励条件下不能完成5组无负重的爬梯训练。综上所述,本研究选择4000 m海拔对应的氧浓度作为大鼠低氧训练干预剂量,是一个既能保持有效低氧刺激又能保障一定训练强度的剂量。
3.2 低氧训练导致大鼠小肠内容物微生物构成改变
胃肠道系统是动物微生物寄居的最大“温床”[8],微生物在功能上具有很高的活跃度[9],例如有研究表明肠道菌群与大脑之间的复杂关系是维持机体生理学稳态的主要影响因素之一[10]。肠道菌群的定植由宿主主导的内源性因素和外界环境主导的外源性因素共同驱动。高原训练的运动员同时受到缺氧与运动的双重应激会引发肠道微生物的数量以及构成变化,甚至引发一系列的功能障碍。肠道的主要功能是营养物质的消化、吸收、转运,调节水及电解质平衡,执行这些功能的核心结构是肠上皮组织、黏膜屏障,肠腔内容物中包含细菌及各类抗原,上皮组织的作用就是防止内容物中致病菌等有害物质穿越肠壁进入血液及内部组织[11]。缺氧会诱发严重的原发性肠黏膜损伤,使细菌和内毒素穿越肠壁发生移位,严重的应激或损伤状态下甚至会出现细菌和内毒素侵入肠壁浆膜(直接进入腹腔)、肠系膜淋巴结、门静脉及其他远端的器官,严重者还会引发全身炎症,这可能是导致高海拔地区出现多器官功能障碍的主要因素之一[5]。
Adak在模拟低压低氧暴露的动物实验中发现[12],持续30天、每天持续8小时,模拟4800 m高原环境的低压低氧干预导致雄性SD大鼠需氧菌群体密度显著降低,在缺氧应激30天后专性厌氧菌(双歧杆菌、乳酸杆菌、拟杆菌)和大肠杆菌数量显著增加。缺氧条件下,肠腔内某些微生物来源的酶(如α-淀粉酶,葡糖淀粉酶,蛋白酶,碱性磷酸酶和β-葡萄糖醛酸酶)活性也升高。此外,低氧引起丙二醛的形成,同时显著减弱过氧化氢酶、谷胱甘肽过氧化物酶、超氧化物歧化酶活性和降低肠上皮细胞中的还原型谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)比值。同时,组织形态学结果显示肠上皮屏障被破坏,并伴有淋巴细胞浸润的胰腺炎和萎缩性结构出现。该研究认为,高海拔暴露中,缺氧是胃肠道微生物改变的重要诱因,并在随后导致小肠功能障碍及有关的上皮功能障碍。
本研究中大鼠小肠内容物测序结果表明,在门水平的优势群落分别是厚壁菌门、变形菌门及放线菌门,在可控环境中,低氧暴露导致大鼠小肠内容物厚壁菌门的相对丰度显著上升,而低氧训练导致大鼠放线菌门、变形菌门的相对丰度显著下降。与以往研究不同的是,各个取材时间点中,常氧环境中饲养的大鼠与低氧环境中饲养的大鼠相比,肠杆菌属、双歧杆菌属、乳酸杆菌属的相对丰度均未出现显著差异。造成这种不同的原因推测是由于干预方式的不同导致,上文所述研究中采用低压低氧的干预方式,而本研究采用常压低氧的干预方式,因为已有研究表明[13],高原环境引发的急性高山病等一系列应激反应(包括胃肠道应激)的核心原因是低氧,而低压是加剧这些反应的因素。故本研究结果表明,低氧暴露和模拟高原训练均会导致大鼠小肠中微生物构成发生显著改变,其中低氧作为独立的影响因素,是导致大鼠肠道微生物构成发生显著改变的重要原因。
3.3 肠道微生物改变的可能影响
肠道微生物系统自身具备代谢功能,其构成发生改变可能致使“菌膜屏障”被破坏,致使代谢产物发生改变,进而导致肠黏膜损伤,发生细菌异位,影响机体健康状况。此外,微生物构成改变本身还可能导致机体对食物的能量采集状况发生改变[22]。Katouli等[14]认为细菌异位的出现取决于肠道微生态是否平衡,肠道微生物失调后导致细菌过度生长,宿主肠黏膜屏障受到物理破坏。还有研究同样认为[15],肠道菌群失调导致肠黏膜屏障功能受损,并增加细菌异位;正常的肠道菌群,尤其是肠黏膜附近的菌膜,可以通过其定植抗性阻止其他细菌定植,占据它们繁殖的环境生态位置。Dalwai和Stecherand在文章中也表述过相似观点[16,17],大鼠肠道微生物构成发生显著变化伴随发生细菌异位和肠屏障受损,而异位的细菌会引发内毒素过量释放,导致肠屏障完整性被破坏并进一步增加细菌异位,这被认为是肠屏障损伤的病理生理学重要原因。虽然不同于以往研究采用放血或药物的方式建立肠道菌群失衡模型,但低氧训练作为一种外源性影响因素,在可控环境中同样导致大鼠肠道微生物构成发生显著变化。本研究发现,大鼠在低氧环境中,小肠内容物微生物中厚壁菌门的相对丰度发生了较大波动。厚壁菌门中包含多种益生菌,很多菌属的代谢均能产生丁酸,丁酸是短链脂肪酸中的一种,可以抑制炎症细胞因子形成,被认为是保护肠黏膜的重要脂肪酸之一,还可以反过来增加乳酸杆菌数量、减少大肠杆菌数量。故推测,低氧应激导致大鼠小肠内容物中厚壁菌门相对丰度改变导致短链脂肪酸生成受阻是低氧导致肠黏膜受损的可能机制之一。
4 结论
低氧应激未导致大鼠小肠内容微生物多样性发生改变,但低氧或低氧训练作为唯一变量,导致大鼠肠道微生物构成发生显著变化。低氧干预导致大鼠肠道微生物中厚壁菌门相对丰度显著升高,低氧训练导致大鼠肠道微生物中放线菌门、变形菌门相对丰度显著下降。
