基于多参数MRI的前列腺癌计算机辅助检测方法
2019-10-11谌先敢刘海华李亮潘宁
谌先敢 ,刘海华 ,李亮 ,潘宁
(1中南民族大学 生物医学工程学院, 武汉 430074;2中南民族大学 医学信息分析及肿瘤诊疗湖北省重点实验室, 武汉 430074;3武汉大学人民医院放射科, 武汉 430060)
前列腺癌已经成为排名第二的威胁男性健康的癌症.在美国,约有1/6的男性在其生命周期内中被诊断患有前列腺癌,1/36的男性死于该疾病[1].经直肠活检(Transrectal ultrasound, TRUS)和前列腺特异性抗原(Prostate specific antigen, PSA)血液检查是目前重要的诊断方法[2].与上述两种方法不同,多参数磁共振成像检查可以检测前列腺的解剖结构和功能,这已成为前列腺癌的更好诊断方法[3].与前列腺癌诊断相关的MRI序列由T2加权成像(T2WI),扩散加权成像(DWI),动态对比度增强(DCE),磁共振光谱(MR光谱)等组成,放射科医师综合这些不同类型的序列进行诊断.在前列腺癌的MR图像诊断过程中,需要经验丰富的放射科医生分析各种MRI序列数据,劳动量十分巨大.而且,在诊断过程中,人为疏忽和感知错误也会造成一定的误诊[2],不同放射科医生对同一病例的判断也会由于经验不同而存在一定的差异.对于经验不足的放射科医生来说,根据各种MRI序列对前列腺癌进行诊断非常具有挑战性.
计算机辅助检测(Computer-aided detection, CAD)是指利用计算机对医学图像进行分析,将获得的结果提供给医生作为“参考”.在诊断过程中,CAD系统可以帮助放射科医师处理多参数MRI序列,以改善决策,减少由于阅片者不同造成的差异并节省阅片时间.近年来,关于前列腺癌的计算机辅助诊断,产生了许多高质量的研究工作.CAMERON提出一种定量的特征模型:将特征组成更高水平的特征:形态,不对称,生理参数,尺寸,使用多参数MRI用来进行前列腺癌的检测[4].KWAK使用来自T2和高b值DWI的LBP纹理特征来进行前列腺癌的检测[5].WIBMER使用T2WI和ADC序列的Haralick纹理特征来检测前列腺癌和区分Gleason分数[6].还出现了几篇综述文献对本领域的工作进行了总结.LIU综述回顾了多参数MRI前列腺癌检测CAD[7].高歌介绍CAD在前列腺癌诊断中的进展[8].
前列腺癌的CAD通常由多个阶段的步骤组成.在第一阶段,从体素点分类产生的概率图检测候选病灶.在第二阶段,从每个候选病灶中提取基于区域的特征,并执行最终的病灶分类,获得每个候选病灶的癌症概率值.大多数研究人员的工作集中在CAD的体素点分类阶段.但是,我们重点关注区域分类阶段.在一些基于区域的方法中,候选病灶由放射科医师描绘,然而这种方式会因为病灶分割的差异而带来最终诊断的差异.在本文中,我们训练了一个点分类器用于自动候选病灶检测.在获得候选病灶之后,从候选病灶提取纹理特征,纹理特征已经被证实对前列腺癌的诊断是有帮助的.为了提高CAD系统的性能,还需要表征放射科医师知识的高级特征.
本研究的目的是研究一种计算机辅助检测方法来评估前列腺可疑病灶的恶性程度.该系统的主要新颖之处在于,该方法可以自动检测前列腺中的可疑病灶,并且提出了一种新的特征来辅助纹理特征以提高CAD系统的性能.
1 基于多参数MRI的计算机辅助检测方法
图1显示了计算机辅助检测方法的流程图.该方法包括多个步骤,最终得到前列腺中可疑病灶的恶性概率.首先,对不同的MRI序列进行预处理,并在T2加权图像上对前列腺进行分割,并且使用分割结果来限制前列腺中的候选病灶的检测.接下来,从不同的MRI序列中提取体素点特征并执行体素点的分类,得到每个体素点的恶性概率值,在此基础上得到候选病灶.最后,提取候选病灶的区域特征,输入分类器,得到候选病灶的恶性概率.下面将更详细地解释每个步骤.
体素点分类的目的是排除病例中的非癌样本点并找到可能的癌症样本点以获得候选病灶,这可以降低后续候选病灶分类的分类难度,候选病灶分类的目的是找到真正的癌症病灶.
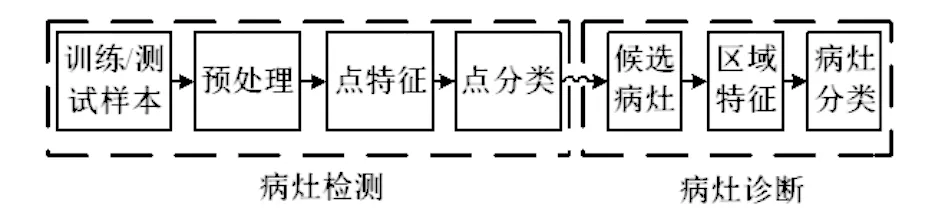
图1 计算机辅助检测方法的流程图
1.1 预处理与前列腺分割
我们需要从不同的MRI序列中提取特征,例如T2加权(T2)MRI,扩散加权(DW)MRI和来自DWI的表观扩散系数(ADC).然而,三个MRI序列的分辨率和大小不同.为了从不同MRI序列的人体的相同位置提取特征,需要将不同的MRI序列预处理为相同的分辨率和大小.DWI被放大并剪切,使其分辨率和大小与T2MRI相同.
放大方法通过双三次插值实现,其中插值像素值是最近的4×4邻域中的像素的加权平均值.放大率是DWI中的像素间隔参数与T2中的像素间隔参数的比值,其中像素间距参数表示图像中的实际物理空间中的两个相邻像素的距离.DWI的分辨率与放大后的T2分辨率相同.放大图像的中心点作为新图像的中心,并且图像中超出范围的部分被剪切,因此新DWI在剪切后具有与T2相同的尺寸.放大和剪切后,三种不同的MRI序列具有相同的分辨率和大小,然后不同MRI序列中相同位置的像素通常对应于人体中的相同部分.
前列腺分割可以降低癌症检测和诊断的复杂性.通过一些前列腺分割方法可以实现前列腺的自动分割.为了使检测结果不受前列腺分割方法的影响,我们使用手动分割结果作为掩模来限制对前列腺癌的检测.经验丰富的放射科医师在T2加权MRI上描绘了前列腺的手动分割结果.T2加权MRI上的前列腺分割结果可以扩展到其他MRI序列(DWI和ADC).
1.2 体素点特征提取
在预处理步骤之后,我们从MRI序列计算体素点特征.纹理已经被证明在区分癌症和非癌症方面是有效的,我们通过计算以体素点为中心的k×k小块中的纹理特征来表征体素点特征.纹理特征分为一阶统计特征和二阶统计特征.一阶纹理特征将体素点与某个全局值进行比较,包括均值,中值,标准差和平均绝对偏差.二阶纹理特征测量图像中像素间亮度的分布,其由灰度共生矩阵计算,包括对比度,相关性,能量和均匀性.这些特征中的每一个都是根据不同的MRI序列计算的:T2,DWI和ADC.
一阶纹理特征曾在文献[4]中被使用,其中均值,中位数和标准差特征是直接计算的.特征图像中的每个体素点(i,j)是Ni,j上的函数的结果,Ni,j是原始图像I中体素点(i,j)周围的滑动窗口的体素点的集合.
fmean(i,j)=mean(Ni,j),
(1)
fmedian(i,j)=median(Ni,j),
(2)
(3)
平均绝对偏差特征图像是原始图像和平均特征图像之间差异的绝对值:
fabsdev(i,j)=|I(i,j)-mean(Ni,j)|,
(4)
二阶纹理特征计算如下:首先,MRI序列上的信号被缩放到0-255灰度级.然后,计算以像素点为中心的5×5小块中的像素的灰度共生矩阵,并且将灰度共生矩阵的纹理描述符用作像素的特征:能量,对比,相关性,同质性.二阶纹理特征是根据共生矩阵计算得到,由下式给出:
(5)
(6)
(7)
(8)
其中,p(i,j)是共生矩阵的值.
1.3 体素点分类
在测试阶段,从每个患者的三个MRI序列都提取体素点特征.将提取的体素点特征送到训练好的模型,每个体素点得到相应的恶性概率值,0表示没有前列腺癌,1表示前列腺癌.在本节中,我们使用SVM分类器进行了实验.由于此步骤旨在获得候选病灶,而不是前列腺癌的诊断,我们不分析该分类器的性能.概率图的示例如图2和图3所示.图2是良性病例,图3是癌症病例.
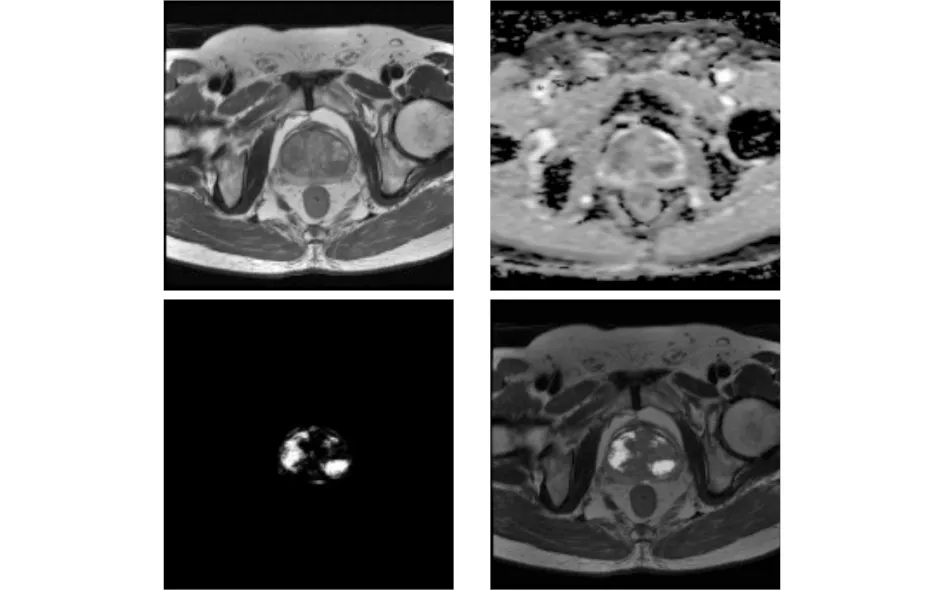
图2 良性病例.T2序列(左上),ADC序列(右上),概率图(左下)、T2与概率的叠加图(右下)
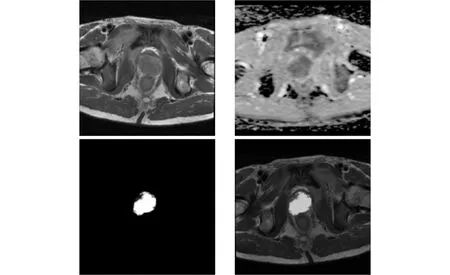
图3 癌症病例.T2序列(左上),ADC序列(右上),概率图(左下)、T2与概率的叠加图(右下)
从图2和图3可以看出,概率图的高值部分与ADC序列的低值部分大致一致,这与放射科医师根据ADC序列描绘候选病灶的原则一致.因此,可以从概率图获得令人满意的候选病灶.
1.4 候选病灶探测
根据图像上每个体素点的概率,首先将该区域确定为可能的候选病灶,其中恶性概率大于某个阈值.然后去除小于n的像素数的候选病灶,其中n是从MRI观察到的最小肿瘤的像素数.消除比大多数肿瘤小的候选病灶可以被认为可以产生最终的一组肿瘤候选病灶.
前列腺中候选病灶之外的区域实际上被识别为非癌区域,并且候选病灶是否被判断为癌症,其由随后的病灶诊断部分确定.
1.5 基于区域的特征提取
计算每个候选病灶的区域特征,包括原始多参数MRI信号,纹理特征和我们设计的新特征.
(1)原始多参数MRI信号
最直接的特征包括来自T2,ADC,DWI序列的MRI信号强度值.PI-RADS(Prostate Imaging, Reporting and Diagnosis System)方案中重要的T2生物标志物包括周边区域(PZ)中的“均匀高信号强度”和“均匀低信号强度”区域,以及过渡区(TZ)中相同的两个区域.DWI测量水分子通过周围组织扩散的能力,b值可以改变采集过程中的扩散程度.不同b值的DWI用于估计ADC.与导致信号延迟的DWI(导致水分子可以扩散的暗区)不同,ADC测量组织扩散的速率,因此差的扩散区域看起来很暗.原始DWI和ADC值在PI-RADS被使用.
(2)纹理特征
纹理特征分为一阶和二阶统计特征,与第1.3节的体素点特征计算步骤相同.一阶纹理特征包括均值,中值,标准差和平均绝对偏差.二阶纹理特征由共生矩阵计算,包括对比度,相关性,能量和同质性.候选病灶区域中所有像素的平均值用来作为区域特征.
(3)我们设计的新功能
通过分析前列腺癌和良性前列腺增生的病例,我们发现两者的区别:良性前列腺增生的病灶是分散的,前列腺癌的病灶更加集中.根据这一特点,本文提出了一种新的特征,称为病灶-凸包比.
病灶-凸包比,即病灶与其凸包的面积比,表示为Fr.在图4中,图像的前列腺中存在三个候选病灶,并且包含三个候选病灶的不规则形状是凸包.对于一个集合H,包含H的所有凸集的集合被称为H的凸包,并且凸包可以被想象为围绕所有点的橡皮筋.候选病灶的总面积表示为Ac,凸包的总面积表示为Ah,然后病灶和凸包的比值Fr为:
(9)
对于多个候选病灶的患者,良性病灶一般较为分散,病灶与凸包的比例较小,恶性病灶一般集中,病灶与凸包的比例较大.因此,病灶和凸包的比例可以用作良性和恶性病灶之间区别的指标.
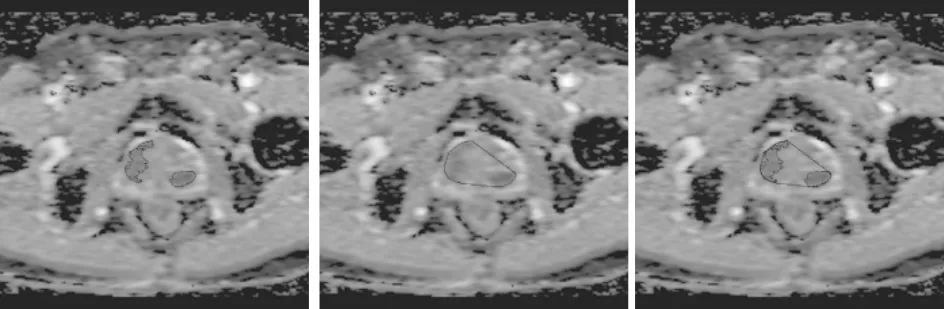
图4 良性病例
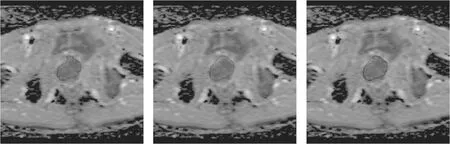
图5 恶性病例
1.6 候选病灶分类
在提取基于区域的特征之后执行候选病灶分类.使用三个分类器以获得最佳性能,SVM分类器,RandomForest分类器和GentleBoost分类器.我们在分类后获得每个候选病灶的0到1之间的癌症可能性,0表示没有前列腺癌,1表示前列腺癌.
2 数据集和实验
2.1 数据集
我们的数据集包括2016年8月至2017年2月期间在武汉大学人民医院放射科就诊的49名患者.每位患者有三个MRI序列:T2,DWI和ADC.这些患者PSA升高,所有癌症患者都有活检证实的前列腺癌,用3.0T MR扫描仪(GE)获取图像.前列腺和恶性肿瘤由专家放射科医师描绘.根据TRUS活检报告,所有前列腺癌病例均为确诊恶性肿瘤.
在我们的实验中,每位患者的MR数据包括T2(尺寸512×512,像素间距0.4297×0.4297),DWI(尺寸256×256,像素间距1.1719×1.1719)和ADC(尺寸256×256,像素间隔1.1719×1.1719)由MR扫描仪生成.在前列腺分割的步骤中,需要将所有MR数据处理为相同的分辨率和大小,使得从不同MRI序列的相应位置获得的特征来自身体的相同位置.
经验丰富的前列腺放射科医师的诊断结果与MR引导的活组织检查样本的组织病理学相结合,用于建立病灶定位的参考标准.工作流程如下:首先,放射科医师筛选了前列腺癌的MR检查.当未发现前列腺癌的证据时,患者被认为是健康的.其次,记录放射科医师认为恶性的所有位置.在那些位置,进行活组织检查并建立随后的组织病理学以确定这些发现的真实性质.病理学家不知道成像结果.
2.2 训练和测试
我们的主要兴趣是检测恶性前列腺癌.良性前列腺增生未标注.在体素点分类的步骤中,放射科医师的肿瘤标注内的所有像素被用作前列腺癌样本,其受到前列腺分割结果的限制.将非癌症病例的前列腺分割结果中的所有像素用作良性样品,其不需要放射学家的标注.
从数据集中随机选择16例(8名癌症患者和8名非癌症患者).这些案例用于训练CAD的体素点分类器;而其他情况(33例)的数据集被输入训练好的体素点分类器以获得恶性概率,从中获得候选病灶.
将具有候选病灶的这些数据(33个病例)随机进行1000次训练/测试分组,使得相同的患者不会同时用在训练和测试阶段.将具有候选病灶的癌症病例作为阳性样品.将具有候选病灶的非癌症病例作为阴性样品.这些阳性样品和阴性样品分别用于训练和测试候选分类器.将这1000个划分的分类结果的平均AUC(曲线下面积)值作为最终结果.
在某些情况下没有候选病灶,这意味着这些病例的前列腺中的所有体素点在体素点分类阶段被判断为非癌性的.因此,在候选病灶分类阶段不考虑这些没有候选病灶的病例.这33例中有1例无候选病灶,因此实际上有32例用于候选病灶的分类.
2.3 实验
使用ROC方法以评估CAD系统的检测精度.通过1000次随机训练/测试划分的实验设置来估计CAD系统的性能.进行了三种实验以评估CAD系统的性能.
(1)使用不同分类器的性能
体素点分类的目标是获得候选病灶而不是前列腺癌的诊断,因此不分析这些分类器在此阶段的表现.为了获得最佳性能,基于ROC曲线下的面积在候选水平评估三种不同的分类器.
(2)候选病灶分类中MR序列的重要性
为了确定MRI序列对整体分类结果的重要性,我们在候选病灶水平上进行了实验.使用不同的分类器,基于ROC曲线下面积,我们建立了每个MRI序列和几个联合MRI序列的分类性能.也就是说,使用单个MRI序列或两种MRI序列计算特征,例如仅使用T2特征或仅使用DWI特征,或两者都用.
(3)添加新特征前后的性能
在前列腺癌的诊断中,纹理特征已被证明是有效的.为了改善性能,仍然需要对候选病灶进行高级描述.我们设计了一个新的特征来描述候选病灶:病灶-凸包比.为了确认该特征的有效性,我们设计了实验:在添加新特征之前和之后,分别测试了系统的性能.
3 结果
3.1 分类器的比较
我们使用ROC分析来比较候选病灶分类中的不同分类器.我们在1000种不同的训练/测试集划分中测试了这些不同分类器的性能.将这1000种划分的AUC值的平均值作为最终结果.表1提供了使用不同分类器的结果.该表的每个数字显示了在一些MRI序列上使用分类器的分类性能.可以看出,SVM分类器比其他两个分类器表现更好.
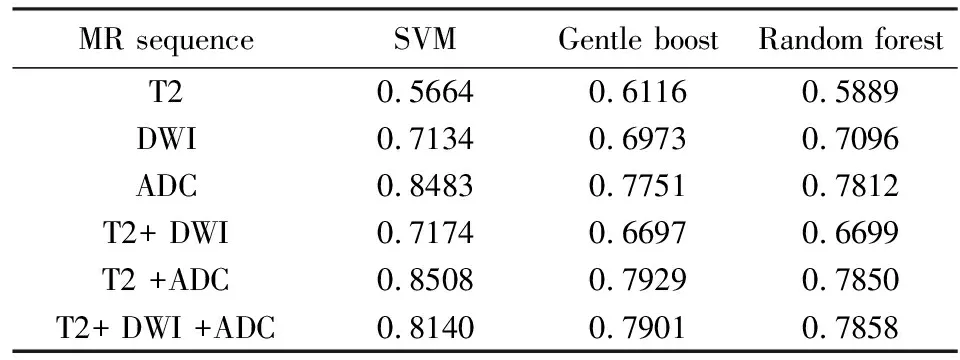
表1 分类器比较和MRI序列重要性实验的AUC结果
3.2 MRI序列的重要性
基于使用三种不同分类器的分类性能的每个MR序列的排名也在表1中显示出来.可以看出,ADC序列在候选分类中比单个T2或DWI序列更重要.这意味着ADC序列在诊断过程中起着最重要的作用,这与放射科医师根据ADC序列描绘候选病灶并通过ADC序列确定良性或恶性病灶的原则一致.另外,我们可以看到多种MR序列的性能在候选病灶分类中超过单个MR序列,表明多种MR序列超过单个MR序列.最佳性能来自T2和ADC序列的组合.
3.3 新特征的有效性
病灶-凸包比的良性和恶性病例分别如图4和图5所示.图4是良性病例,其中良性前列腺增生(BPH)病灶分散.然而,前列腺癌(PCa)病灶更加集中,这可以从图5中看出.
计算32例候选病灶的病灶-凸包比.图6是32例的病灶-凸包比的箱型图.每个箱都标有它所代表的案例的名称.很明显,BPH和PCa的新特征之间存在显着差异.
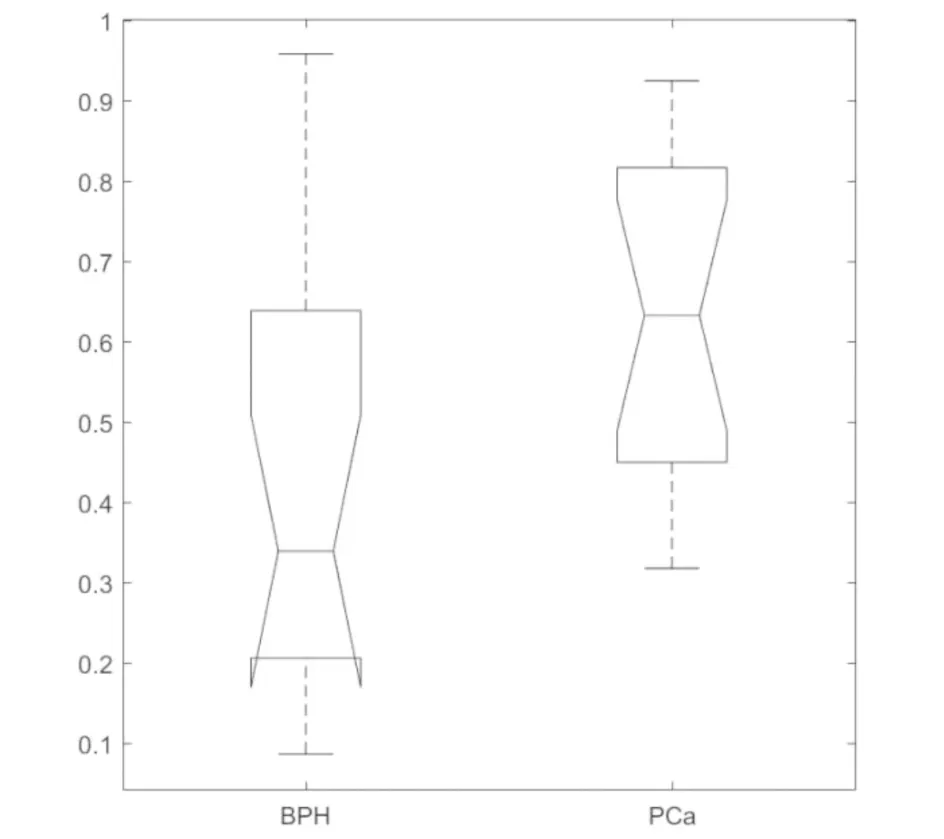
图6 32例的新特征的箱型图
为了验证新特征的有效性,我们在添加新特征之前和之后测试该方法的性能.表2中显示了添加新特征之前和之后的AUC分类结果.第二行和第四行的值大于第一行和第三行的对应值,这意味着CAD系统的性能在添加新特征后得到了改善.
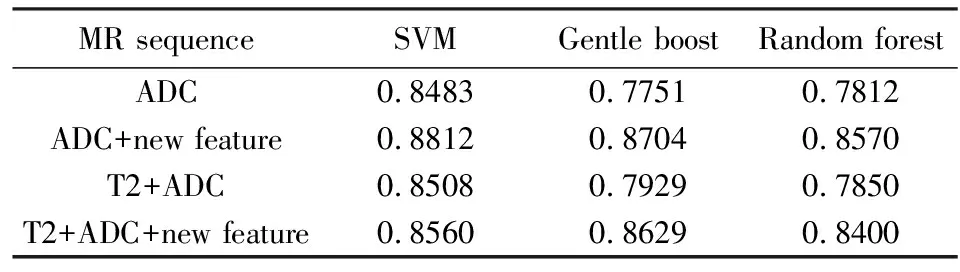
表2 添加新特征前后的AUC结果
4 结语
介绍了一种从MRI序列中检测前列腺癌的CAD方法.在数据集上评估该方法的性能,其AUC为0.8812.在前列腺癌的诊断中,多参数MRI通常被用作定量检查方法.在这项研究中,研究了每个MRI序列的重要性,并设计了新的特征来改善方法的性能.
该研究的局限性在于ROC评估偏向于放射科医师.因为可以通过MR引导的活组织检查清楚地定义癌区域,并且大多数正常区域必须依赖于放射科医师的意见.我们看起来正常的一些地区仍有一些风险实际上是癌症.此外,实验数据集不大,训练像素分类器的病例数量为16,用于训练和测试候选分类器的病例数量为32,需要拥有更多数据的数据集以进一步验证本方法.
研究了一种用于检测前列腺癌的计算机辅助检测方法,包括体素点分类,候选病灶检测和候选病灶分类.该系统可以帮助放射科医师检测前列腺癌位置,并且它将是放射科医师的潜在有价值的工具.
