基于金纳米棒纳米载体的智能释药体系的制备
2019-10-11孙宏浩马正虎秦汤赵晓双
孙宏浩,马正虎,秦汤,赵晓双
(湖北工业大学 生物工程与食品学院,教育部发酵工程重点实验室,湖北工业微生物学重点实验室,“111”细胞调控与分子药物学科创新引智基地,武汉 430068)
盐酸阿霉素(DOX)作为治疗实体瘤最为有效的药物之一,在临床上通常被用来治疗多种类型癌症,如急性白血病、恶性淋巴瘤、乳腺癌、肺癌和卵巢癌等[1,2].但是,药物对作用部位生物利用度低,特异靶向性差,导致化疗效果不理想[3,4],且具有全身毒副作用[5],极大地限制了药物的治疗剂量[6].此外,传统单一抗癌治疗法对肿瘤组织的渗透和转移及多重耐药性(MDR)肿瘤细胞系等情况治疗效果较差[7].为克服这些困难,出现了多重治疗策略协同作用的新型纳米载体与药物输送系统(DDS)相结合的治疗方法,探索更安全、更有效、更方便的药物控制释放系统,研发多功能纳米粒子并将其作为传递药物的重要载体,是未来癌症治疗关注的焦点.
作为一种与化疗协同治疗肿瘤的手段,光热疗法可以改变细胞膜的流动性,增强肿瘤细胞的通透性,使DOX容易进入肿瘤细胞并保持较高的药物浓度,显著提高肿瘤的治疗效果[8,9].近年来,作为微创抗癌治疗策略之一,近红外激光用于热疗(PTT)获得越来越多的关注,并在肿瘤治疗中广泛应用.金纳米棒具有良好的生物相容性和高的光热转换效率,在基于PTT的肿瘤治疗中是理想的光治疗剂[10-14].
本文合成了一种新型的多层结构的多功能纳米载体GNR@SiO2-DOX@CouC12-HA (GSDCH),有效用于PTT与化疗协同治疗肿瘤.以金纳米棒为内核,在金纳米棒的表面包覆一层介孔二氧化硅(MSNs)用于载药,MSNs具有均匀且可调谐的粒径、孔径及较大的比表面积和孔容积,其表面易于进行功能化修饰且具有良好的生物相容性.将复合粒子羧基功能化之后通过静电吸附作用载入DOX,带有2个C12支链的温敏性脂质体和光敏性香豆素作为封堵剂和光控开关结合在纳米粒子上.最后,在纳米粒子表面修饰的透明质酸(HA)使纳米载体具有靶向于CD44受体过度表达的肿瘤细胞的功能,且透明质酸(HA)使得纳米载体具有较好的胶体稳定性.乳腺癌细胞(Hela细胞)能对GSDCH有更高效的细胞摄取,在808 nm近红外激光照射下,金纳米棒将光能转换成热能,智能光控开关被开启并释放出DOX,采用光热疗法协同治疗肿瘤具有较好的治疗效果.
1 实验部分
1.1 试剂和仪器
正硅酸四乙酯(CTAB)、正硅酸乙酯(TEOS)、硼氢化钠(NaBH4)、5-溴水杨酸(5-BrSA)、抗坏血酸(AA)、浓盐酸(HCl,35%)、氯金酸(HAuCl4)(上海化学试剂有限公司);氢氧化钠(NaOH)、无水乙醇(国药集团化学试剂有限公司);所有试剂均为分析纯.透射电子显微镜(TEM,FEI Tecnai G220型,200 kV);二氧化碳恒温培养箱(DHP-9272型,上海一恒);激光粒度分析仪(Zetasizer-Nano ZS型,英国马尔文仪器).
1.2 纳米载体的制备
1.2.1 GNRs的制备
取10.3 μL的氯金酸(10 mg/mL)和0.5 mL CTAB溶液(0.2 mol/L)混合均匀,搅拌下加入0.1 mL硼氢化钠溶液(0.227 mg/mL),搅拌30 s后于30 ℃下静置,新配好的种子液务必在0.5~2 h内使用.称取1.8 g CTAB和0.22 g 5-溴水杨酸加入至100 mL圆底烧瓶中,随后加入95 mL去离子水,将圆底烧瓶置于水浴锅中60 ℃件下搅拌溶解,溶解完毕后,向其中加入3 mL硝酸银溶液(4 mmol/L)和1 mL HCl溶液(1 mol/L),将溶液冷却至30 ℃.再向溶液中加入2.06 mL氯金酸(10 mg/mL),30 ℃下静置15 min,剧烈搅拌下加入0.4 mL抗坏血酸(0.064 mol/L)和80 μL先前配制的种子液,30 ℃下过夜.
1.2.2 GNR@SiO2的制备
取10 mL金纳米棒的溶液(1 mg/mL)于38 ℃水浴锅中,加入400 μL的氨水调节该溶液pH至10~11.取80 μL TEOS溶解到1.92 mL无水乙醇中,每隔0.5 h向金纳米棒溶液中加入200 μL该溶液,直至滴加完毕,反应48 h.反应结束后将该溶液在10000 r/min条件下离心30 min,分散于15 mL盐酸乙醇溶液[V(HCl)∶V(C2H5OH)=1∶9],冰水浴中超声30 min,重复以上操作3次,再用乙醇和水各洗涤1次后分散于10 mL乙醇中.
1.2.3 GNR@SiO2-COOH的制备
向10 mL介孔二氧化硅包埋的金纳米棒复合材料(GNR@SiO2)的乙醇分散液,加入400 μL氨水,将溶液的pH调至约10,加入2 mL含有15 mg APTES-COOH的水溶液,室温搅拌过夜.待反应结束,将反应产物10000 r/min离心30 min,用乙醇和超纯水分别洗涤2次,洗涤完毕后,将沉淀物分散于10 mL PBS中保存.
1.2.4 DOX的装载
取10 mL羧基功能化的GNR@SiO2-COOH的PBS分散液(粒子质量约为10 mg),向其中加入2.4 mg盐酸阿霉素(DOX),室温避光搅拌48 h,11000 r/min离心30 min至上清液无色透明,将沉淀物重新分散在10 mL超纯水中保存.
1.2.5 GNR@SiO2-DOX@CouC12的制备
取20 mL载药的羧基功能化的GNR@SiO2-DOX的水分散液,在室温搅拌下加入100 mg 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl),15 min后加入30 mg 4-二甲氨基吡啶(DMAP),室温下搅拌.向该溶液中加入50 mg F127,搅拌10 min后,滴加2 mL含有30 mg烷基化羟甲基香豆素的氯仿溶液,搅拌形成乳液后,室温搅拌过夜,产物用超纯水离心(10000 r/min,30 min)洗涤2次,使用10 mL超纯水分散保存.
1.2.6 GNR@SiO2-DOX@CouC12-HA的制备
取10 mL复合纳米粒子的氯仿分散液,加入50 mL含有20 mg烷基化透明质酸的水溶液,室温下搅拌过夜.将产物用超纯水离心(10000 r/min,30 min)洗涤3次,分散在10 mL超纯水中保存.
1.3 APTES-COOH的制备
取2.5 g(25.5 mmol)马来酸酐置于25 mL单口圆底烧瓶中,冰浴条件下逐滴加入5.5 mL(23.5 mmol)APTES,快速搅拌,直至反应物变成白色膏状固体,4 ℃下保存.
1.4 7-(双十二烷基胺)-4-羟甲基香豆素的合成
7-(双十二烷基胺)-4-羟甲基香豆素的合成路线图见图1.
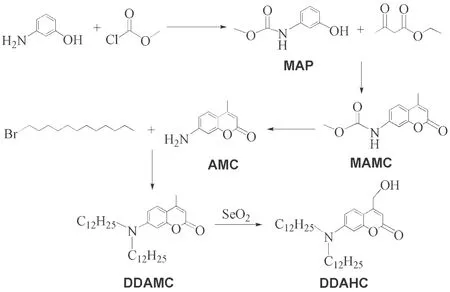
图1 7-(双十二烷基胺)-4-羟甲基香豆素的合成路线
1.4.1 7-氨基-4甲基香豆素的合成
参照文献[16],合成7-氨基-4甲基香豆素(AMC).称取11 g间氨基酚和12.5 g碳酸氢钾,加入75 mL乙酸乙酯和5 mL超纯水,搅拌均匀,在冰水浴的条件下向上述混合溶液中滴加9 mL氯甲酸甲酯,持续搅拌1 h,再加入25 mL超纯水,继续搅拌3 h.反应结束后分液,弃去水相,将有机相依次用超纯水、1 mol/L的硫酸溶液、水与饱和氯化钠溶液洗涤,用适量无水硫酸镁干燥,过滤后将溶剂蒸干,将所得到的固体用苯重结晶得到间甲酯氨基苯酚(MAP).
称取11.5 g间甲酯氨基苯酚与12.5 mL乙酰乙酸乙酯混合,将所得到的悬浮液分多次加至30 mL浓硫酸中控制温度为60 ℃,加入完毕后,搅拌2 h,再向该溶液中加入150 mL冰水混合物,继续搅拌至晶体析出,过滤分离,依次用超纯水和乙醚洗涤滤饼,干燥后得到7-甲酯氨基-4-甲基香豆素(MAMC).
取14 g MAMC加入到30 mL 45%氢氧化钾水溶液中,在85 ℃下搅拌20 min.待MAMC完全溶解后,加水稀释至100 mL,再在冰水浴中搅拌,用盐酸调节溶液pH至约5~6,再用氨水调节溶液pH至8左右,持续搅拌直至产物完全结晶析出.过滤,依次用水和乙醚洗涤滤饼,干燥后得到7-氨基-4-甲基香豆素(AMC).
1.4.2 7-(双十二烷基胺)-4-甲基香豆素的合成
取3.99 g(22.8 mmol)AMC与16.65 mL(0.069 mol)溴代十二烷溶解于250 mL DMF中,再加入18.9 g(0.137 mol)碳酸钾,80 ℃下搅拌12 h,反应完毕后过滤,蒸发溶液除去DMF,向溶液中加入大量丙酮,冰水浴搅拌直至固体完全析出.过滤,得到7-(双十二烷基胺)-4-甲基香豆素(DDAMC).
1.4.3 7-(双十二烷基胺)-4-羟甲基香豆素
取1.0 g(1.96 mmol)DDAMC和0.44 g(3.93 mmol)二氧化硒分散于50 mL二甲苯中,剧烈搅拌回流24 h,反应完毕后,过滤,减压浓缩得到深褐色油状物.用35 mL甲醇将所得油状物溶解后,加入0.15 g(3.92 mmol)硼氢化钠,搅拌4 h.反应结束后,使用1 mol/L的盐酸水溶液调节pH至中性.使用氯仿萃取3次,合并后用无水硫酸镁进行干燥,真空干燥得到7-(双十二烷基胺)-4-羟甲基香豆素.
2 结果与讨论
2.1 透射电镜检测
采用种子生长法制备的金纳米棒和介空二氧化硅包覆的金纳米棒的TEM图见图1.由图1a可见,金纳米棒内核为杆状,粒径约为13 nm×50 nm,粒径均一且分散性好;由图1b可见,包覆了一层厚度为10~15 nm介孔二氧化硅的椭球形的金纳米棒,外层二氧化硅壳具有介孔结构.

a)GNR的TEM图;b)GNR@SiO2的TEM图
2.2 Zeta电位的测定
对GNR(G),GNR@SiO2(GS),GNR@SiO2-COOH(GSC),GNR@SiO2-DOX(GSD),GNR@SiO2-DOX@CouC12(GSDC),GNR@SiO2-DOX@CouC12-HA (GSDCH)的电位变化图见图3.由图3可见,由于GNRs表面存在CTAB,GNR的电位为(+45±3.6)mV.由于Si-OH的离子化,包覆二氧化硅之后,GS的电位降至(-20.5±1.0)mV.随着与羰基的成功结合,GSC的电位降至(-39.6±3.5)mV.载入DOX,GSD 的电位为(-14.8±3.0)mV,这是由盐酸阿霉素所带的正电荷引起的变化.由于存在大量的氨基,结合香豆素后,GSDC 的电位变成(+31±2.3)mV.引入 C16-HA后,GSDCH的电位又转变成负电位(-10.1±5.1)mV.鉴于C16-HA 链带负电荷,这个结果表明HA被成功包覆上.
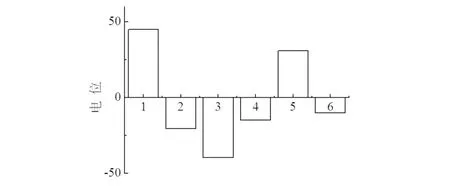
1)GNR;2)GNR@SiO2;3)G3.GNR@SiO2-COOH; 4)GNR@SiO2-COOH+DOX;5)GNR@SiO2-DOX@CouC12; 6)GNR@SiO2-DOX@CouC12@HA
2.3 UV-vis-NIR检测
GNRs,GNR@SiO2,GSC,GSD,GSDC 和 GSDCH 的紫外-可见光-近红外吸收光谱图见图4.由图4紫外-可见光-近红外吸收光谱可见,GNR的纵向表面等离子体共振(LSPR)峰出现在785 nm处且横向表面等离子体共振(TSPR)峰出现在514 nm处.当二氧化硅层包覆在所合成的棒状金纳米粒子上后,其LSPR峰蓝移至768 nm处,结果显示金纳米棒成功包覆了二氧化硅层.经过层层组装之后,LSPR峰最终红移至 802 nm处,纯的DOX的紫外吸收在480~500 nm.当载入DOX 时,TSPR 峰剧烈增强并且在480~500 nm范围处出现肩峰,结果显示DOX被成功载入复合物中.
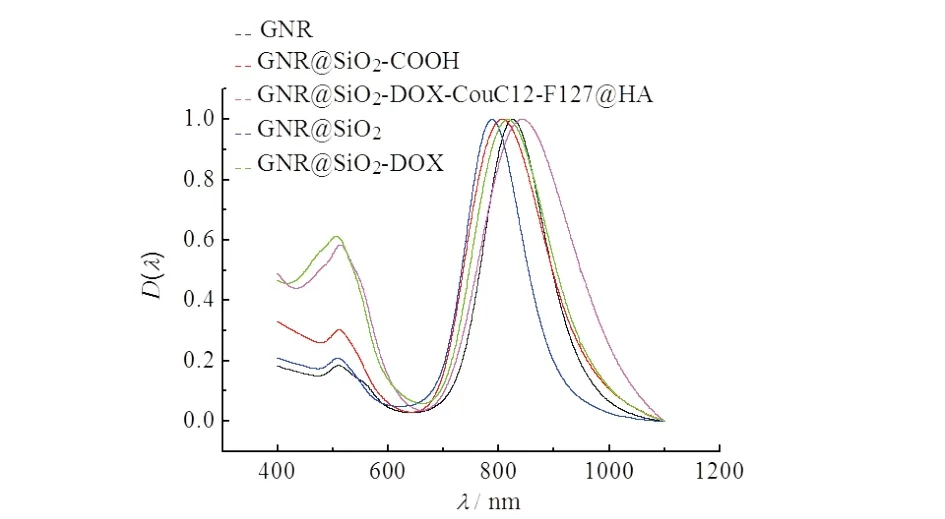
图4 UV-vis-NIR吸收光谱
2.4 复合纳米材料的光热升温曲线
金纳米棒的光热性能具有重要的意义,GNR和GNR@SiO2在不同功率的808 nm的近红外激光照射下温度的变化见图5.
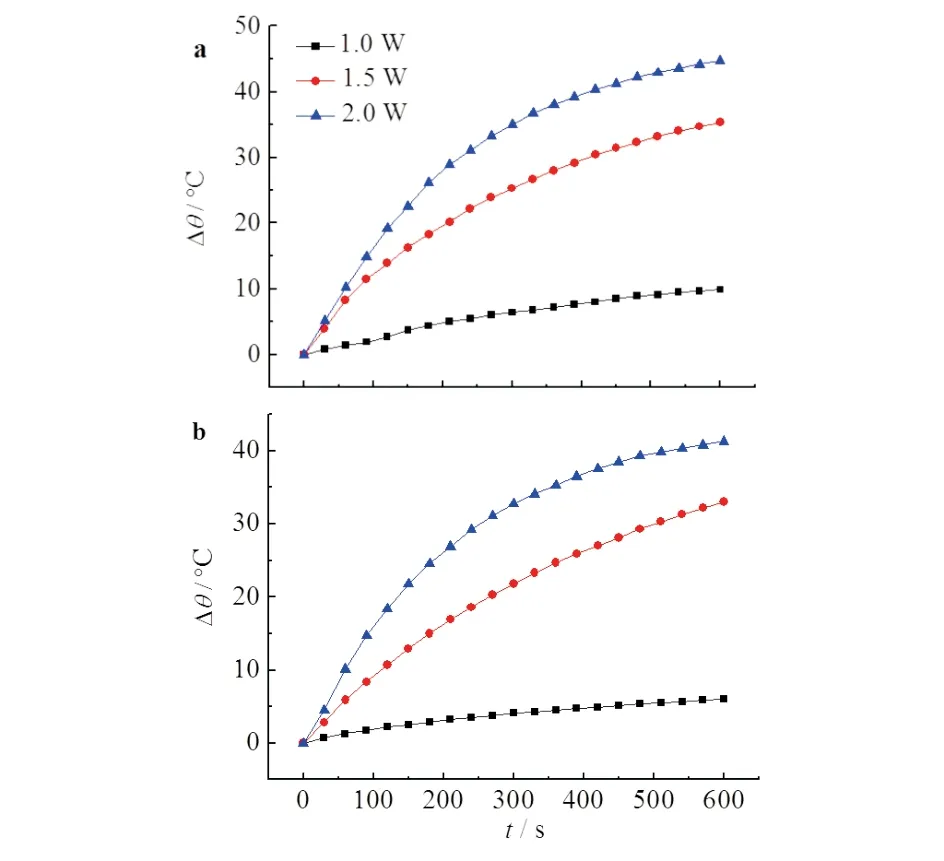
a)金纳米棒; b)二氧化硅包埋的金纳米棒
由图5可见,在2 W的光照下,在300 s时GNR和GNR@SiO2的温度分别上升了41.4 ℃和41.3 ℃.说明该材料具有优异的光热性能,癌细胞在42 ℃以上的高温下会发生凋亡[12],故金纳米棒的光热性能可用于肿瘤热疗.
2.5 纳米载药体系的生物相容性评价
理想的抗肿瘤药物要满足高效低毒,本文通过MTT法探讨了游离的DOX对Hela细胞及MCF-7细胞的毒性,结果见图6.由图6a可见:细胞与单独DOX共孵育时,随着DOX浓度的增加,细胞存活率明显降低,但仍高于50%,在Hela细胞中,光照增加了游离DOX的细胞毒性.
金纳米棒和载入DOX的金纳米棒对Hela细胞以及MCF-7细胞的毒性见图6b.由图6b可见,金纳米棒的浓度增加至200 μg/mL时,Hela细胞与MCF-7细胞的存活率均在80%以上,说明GNR对Hela细胞和MCF-7细胞均无明显毒性,具有较好的生物相容性.载入DOX之后,随着GSCH浓度的增加,Hela细胞与MCF-7细胞的细胞存活率均有所下降,但Hela细胞的存活率显著下降,表明该纳米材料对Hela细胞具有靶向性.
综上可知:未加纳米材料,游离的DOX对细胞无靶向性;而将DOX载入纳米材料后,Hela细胞的存活率远低于MCF-7细胞,纳米材料表现出明显的靶向性.
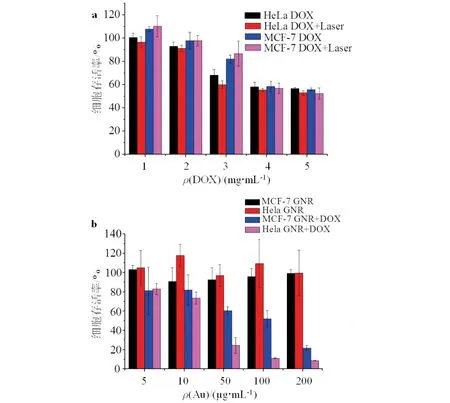
a)游离DOX细胞毒性;b)GNR在Hela细胞和MCF-7细胞中的细胞毒性
3 结论
(1)本文研制了一种特殊的肿瘤靶向多功能纳米载体,这种纳米载体以金纳米棒(GNR)为核,其表面包覆了一层介孔二氧化硅并在介孔中负载药物,介孔二氧化硅表面通过酸醇缩合修饰一层近红外(NIR)激光敏感的香豆素衍生物,香豆素亲油膜将药物包封在介孔内的同时亦是智能的控制开关.
(2)DOX被巧妙地载入内部介孔二氧化硅中并用香豆素层封堵,除了作为长期稳定剂外,外部的透明质酸也可使这种载药纳米载体选择性地靶向于Hela细胞或CD44受体过度表达的肿瘤区域.
(3)该纳米技术结合了光热性质和药物传递性质,具有可控性和靶向释药特性,表现出优越的生物相容性和抗癌功效.这种靶向纳米载体为临床应用光热协同疗法提供了具有潜力的药物传递系统.
