臭氧微气泡对活性艳红X-3B污染废水的处理
2019-10-11孙杰夏慧龚定芳
孙杰,夏慧,龚定芳
(中南民族大学 资源与环境学院,武汉 430074)
臭氧(O3)作为一种强氧化物质,被广泛应用于提高饮用水的色度与口感、去除饮用水和废水中的有机和无机化合物[1].臭氧在水中溶解度相对较低,导致气液传质速度较低,限制了其氧化的反应速率,这与气液反应器的混合程度、水中臭氧衰减的动力学和产生的臭氧气泡的数量和大小有关[2,3].臭氧具有选择氧化性,使其与一些有机化合物的反应非常缓慢,如芳香烃化合物[1],多数情况下,臭氧氧化并不能将有机物完全矿化为CO2,只能生成部分氧化产物,如醛类、有机酸和酮类[4].为有效提高臭氧氧化过程,发展了O3/H2O2、UV/O3、超声波/O3和利用金属离子、金属氧化物或活性炭的臭氧催化氧化等高级氧化技术[5],其目的是为了产生比O3分子氧化性更强的羟基自由基.
微气泡是直径为10~50 μm的气泡,它较直径为毫米级别的传统气泡,具有更大的比表面积和气泡密度,在液相中具有更低的上升速率和更高的内压[6].所以微气泡能强化气液传质过程,有效提高臭氧传质速率和臭氧利用率.郑天龙等[7]发现微气泡-臭氧体系的气含率、臭氧传质系数和臭氧平均利用率分别是微孔-臭氧体系的11倍、3倍和1.5倍.CHU等[8,9]证实微气泡臭氧传质系数是传统气泡的1.8倍,且微气泡系统中的臭氧利用率始终保持在 99%以上.微气泡不仅在污水处理中应用广泛,在污染土壤的处理[10]和海域底部污泥的净化处理[11]中也具有良好的应用前景.
本文以活性艳红X-3B模拟污染废水研究臭氧微气泡技术,考察了X-3B浓度、溶液初始pH值及臭氧通量对降解反应的影响,简要分析臭氧微气泡的主要活性物种,为臭氧微气泡技术的工业应用提供参考.
1 实验部分
1.1 材料和仪器
活性艳红X-3B、Na2S2O3、NaOH、HCl、Na2CO3、异丙醇、叔丁醇、对苯醌、硫脲、普氧(纯度99.9%)、KI、H2SO4、可溶性淀粉(AR).
紫外可见分光光度计(UV1800,上海凤凰光学科仪);精密酸度计(pHs-3C, Multi340i, WTW, Germany);电子天平(CP214, 奥豪斯);总有机碳仪(MultiN/C3100, 德国耶拿分析仪器);超微米气泡发生装置(XZCP-K-0.75,云南夏之春);臭氧发生器(CFY-3,杭州荣欣电子).
1.2 实验装置
实验装置如图1所示,以普氧为气源(纯度99.9%),利用臭氧发生器将氧气转换为臭氧,通过气体流量计控制进入微气泡发生器的气体(臭氧与氧气的混合气体),气体与进入反应器的液体一起从出口喷出,产生含有大量微气泡的气液混合物.反应器有效容积为13 L.
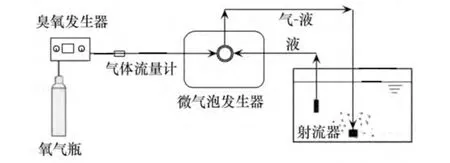
图1 实验装置示意图
1.3 实验方法
配制不同浓度的X-3B溶液,调节溶液至实验所需pH值,通过气体流量计控制氧气通量,对应产生的臭氧量用碘量法测得,在上述装置中进行臭氧微气泡氧化实验,在一定的时间间隔下取样,用紫外可见分光光度计对样品进行测定,X-3B的最大吸收波长为538 nm.
根据与吸光度之间的标准曲线计算溶液中的X-3B质量浓度,并按式(1)计算X-3B的去除率(R):
R= (1-Ct/C0)×100,
(1)
式中,C0和Ct分别为反应初始和反应进行t时刻溶液中的X-3B质量浓度,mg/L.
2 结果与讨论
2.1 溶液pH值的变化对X-3B降解的影响
配制X-3B溶液为100 mg/L,调节臭氧浓度为5.4 mg/L(氧气流量为0.3 L/min),改变溶液初始pH值,反应中X-3B的去除率与反应时间的关系图如图2所示.由图2可见:反应30 min,X-3B的脱色率几乎均能达到100%,且酸性条件下的脱色速率最快,因此溶液最适初始pH值为5,碱性条件下的脱色速率略高于中性条件.
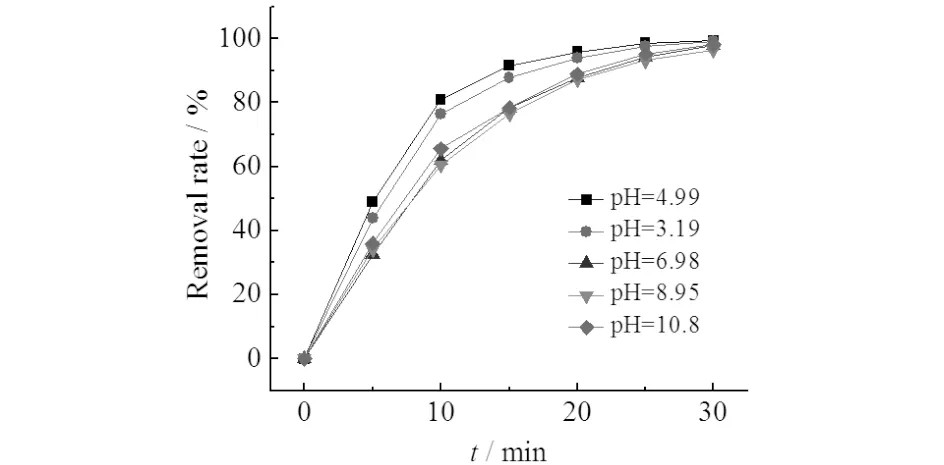
图2 不同初始pH值下微气泡臭氧氧化处理X-3B中的脱色率
在反应过程中溶液pH值的变化如图3所示.由图3可见:溶液pH值随反应进行,均有不同程度的减小,由于臭氧微气泡降解X-3B的过程中,苯环被破坏产生了一系列中间产物,如小分子有机酸,小分子有机酸的积累导致溶液pH降低[12,13].
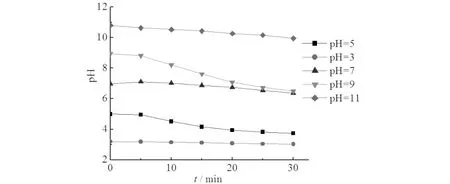
图3 不同初始pH值下微气泡臭氧氧化处理X-3B中溶液pH值变化
2.2 X-3B初始浓度对去除率的影响
配制不同浓度的X-3B溶液,用HCl和NaOH溶液调节反应溶液初始pH值为5,调节臭氧浓度为5.4 mg/L(氧气流量为0.3 L/min),X-3B初始浓度对去除率的影响结果见图4.由图4可知:增加X-3B的初始浓度,降解速率减慢,当X-3B浓度为50,100 mg/L时,反应20 min ,脱色率均为95%以上;而当X-3B初始浓度为200 mg/L时,20 min仅能去除78.03%.说明在臭氧浓度一定时,随着X-3B初始浓度的增加,脱色反应消耗的臭氧量也随之增加,臭氧投加量成为反应的限制因素.

图4 不同X-3B初始浓度下微气泡臭氧氧化处理X-3B中的脱色率
不同X-3B初始浓度下,臭氧微气泡降解X-3B时溶液pH值的变化如图5所示.由图5可知:溶液pH值在降解中均有所下降,说明30 min内中间产物小分子有机酸后续氧化的速率较慢,导致小分子有机酸的积累,与反应前30 min溶液中TOC去除率较低一致.
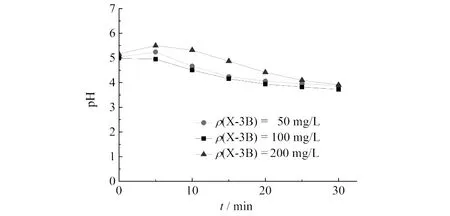
图5 不同X-3B初始浓度时微气泡臭氧氧化处理中溶液pH值变化
2.3 臭氧通量对X-3B降解的影响
配制X-3B浓度为100 mg/L,调节反应溶液初始pH值为5,改变氧气通量分别为0.2, 0.3, 0.4 L/min,对应臭氧浓度分别为4.80, 5.40, 5.52 mg/L,观察X-3B去除率的变化如图6所示.由图6可见:随着臭氧浓度的增加,X-3B脱色速率加快,当臭氧浓度由4.80 mg/L增至5.52 mg/L时,反应5 min后X-3B脱色率从33.09%提高到54.88%,由于臭氧能直接破坏X-3B中的生色基团,增加臭氧浓度,加快了臭氧与生色基团的反应,使得脱色速率加快.
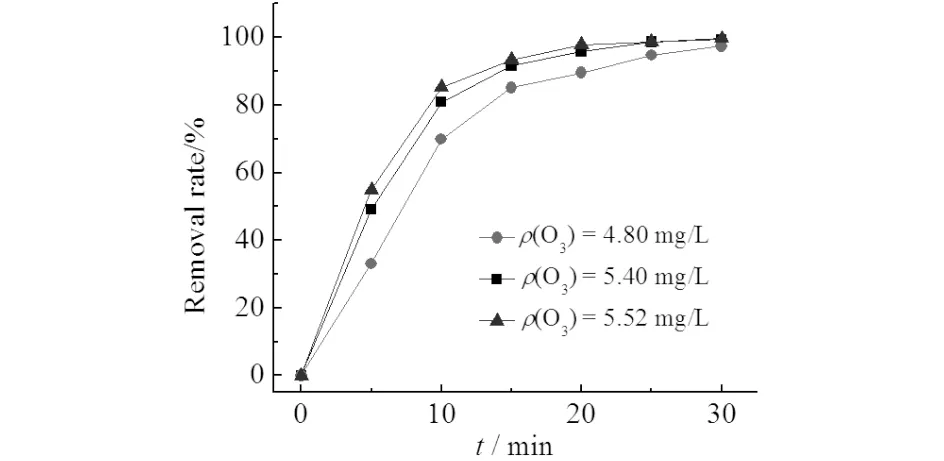
图6 微气泡臭氧氧化处理X-3B中的脱色率
反应过程中溶液pH值的变化如图7所示.由图7可知:溶液pH在反应中均有所降低,且臭氧浓度越大,pH值变化越大,由于臭氧投加量增多后,反应中产生的小分子有机酸更多,导致pH值降低更多.
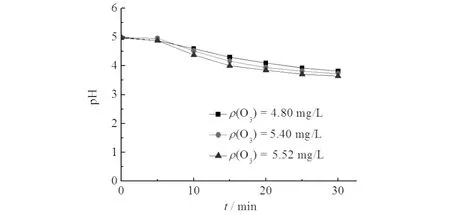
图7 微气泡臭氧氧化处理X-3B溶液中pH值变化
2.4 一级动力学分析
脱色反应按照准一级动力学进行,其一级动力学速率方程见式(2).
(2)
式中,C0和Ct分别为反应初始和反应进行t时刻溶液中的X-3B质量浓度,mg/L.
根据准一级动力学反应方程,对臭氧微气泡氧化过程中X-3B浓度随反应时间(t为0~30 min)的变化进行拟合,结果如表1所示.
由表1可知:pH、X-3B浓度、O3浓度为各初始值时,活性艳红X-3B在臭氧微气泡中的降解过程均符合拟一级动力学反应规律,拟合相关系数R2均大于0.95,相关性良好;改变体系的初始pH值,发现酸性条件下反应速率常数大于中性及碱性条件,说明X-3B在酸性条件下降解速率较快;增加X-3B初始浓度,反应速率常数减小,增加O3浓度,反应速率常数增大,说明X-3B初始浓度越小,O3浓度越大时,X-3B的去除速率越快.因此,当体系初始pH值为5,O3浓度为5.52 mg/L,X-3B初始浓度为50 mg/L时,活性艳红X-3B的反应速率最大.
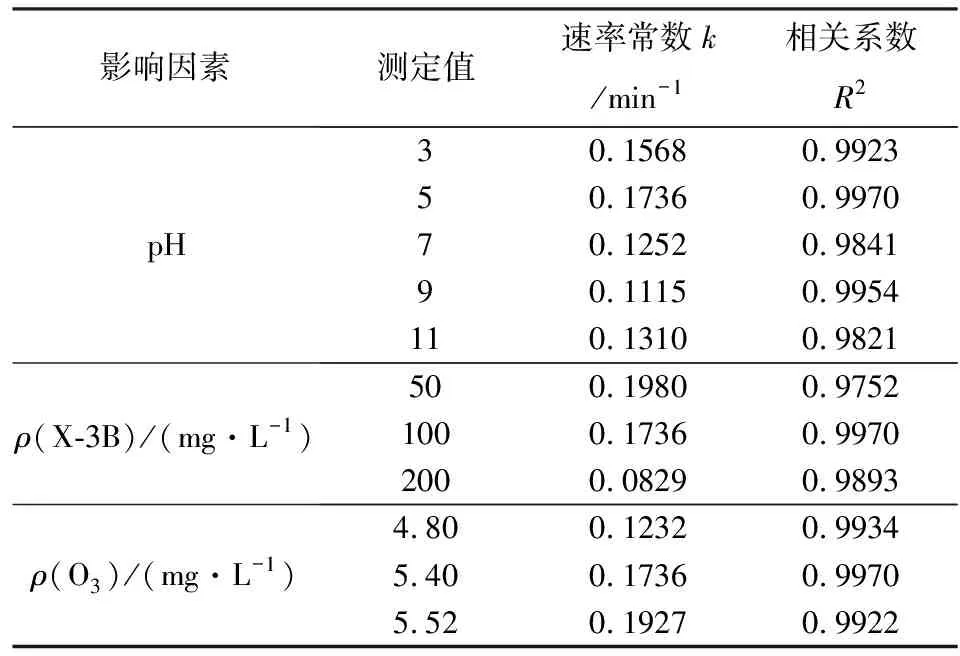
表1 活性艳红X-3B的反应动力学分析
2.5 自由基对X-3B降解的影响
研究表明:异丙醇[14]能够捕获羟基自由基,对苯醌[14]能够捕获超氧负离子,硫脲[15]能同时捕获羟基自由基和超氧负离子,故可采用猝灭法探究体系中产生的自由基.
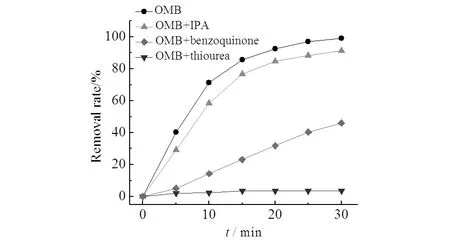
图8 自由基对微气泡臭氧氧化处理X-3B的影响
2.6 结果分析
配制X-3B溶液浓度为100 mg/L,调节溶液初始pH值为5,调节臭氧浓度为5.4 mg/L(氧气流量为0.3 L/min),对1~30 min反应溶液进行紫外可见光谱扫描,结果如图9所示.由图9可知:苯环和萘环的吸收峰在235, 330 nm处附近,450~600 nm处较宽的吸收峰由共轭结构的分子引起,使染料呈现红色.反应后的活性艳红X-3B溶液,脱色效果十分明显,在538 nm处的吸收峰值迅速下降,30 min后吸光度值下降了99%以上,由于染料的偶氮基团被攻击,导致X-3B共轭结构断裂,分子结构破坏,产生了一些中间产物.
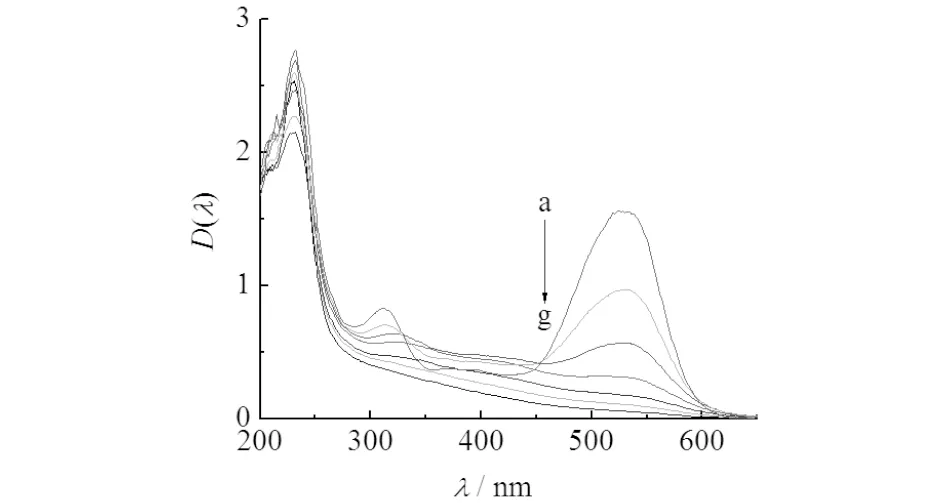
a)0 min; b)5 min; c)10 min; d)15 min; e)20 min; f)25 min; g)30 min
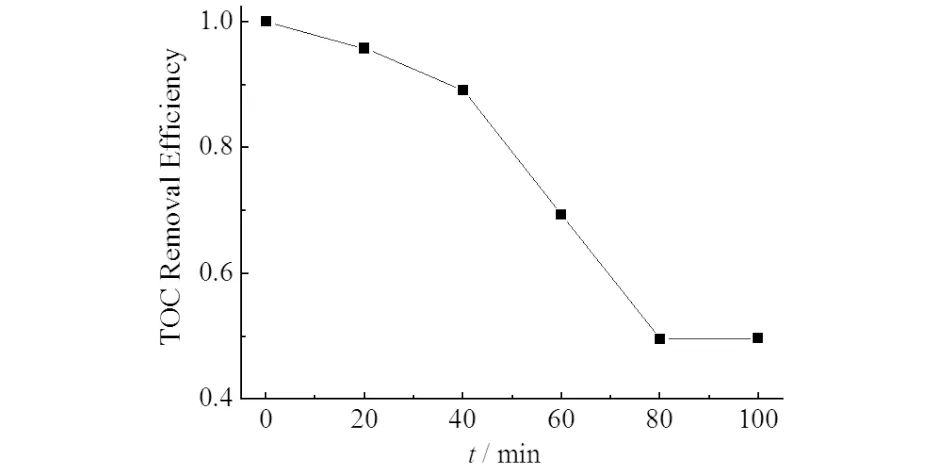
图10 臭氧微气泡降解X-3B过程中的TOC去除率
3 结论
(1)体系pH值会影响臭氧微气泡氧化降解X-3B,酸性条件和碱性条件下,臭氧微气泡氧化降解能力均高于中性条件,且酸性条件下X-3B降解率最高,反应最适初始pH值为5,反应30 min后X-3B降解率为99.43%
(2)增加氧气通量和降低活性艳红X-3B溶液的初始浓度,X-3B的降解速率均明显上升,当臭氧浓度为5.52 mg/L(氧气流量为0.4 L/min),X-3B溶液初始浓度为100 mg/L,溶液初始pH值为5时,处理30 min的脱色率99.74%,降解中由于中间产物小分子有机酸的积累,使溶液pH值呈降低趋势.
(3)动力学分析表明pH、X-3B浓度、O3浓度为各初始值时,活性艳红X-3B在臭氧微气泡中的降解过程均符合拟一级动力学反应规律.
