箭根薯地上部分化学成分研究
2019-10-11何隽马蕊邵倩陆颖冯涛李正辉
何隽,马蕊,邵倩,陆颖,冯涛,李正辉
(中南民族大学 药学院,武汉 430074)
蒟蒻薯科(Taccaceae)植物分为浆果的蒟蒻薯属(Tacca)和蒴果的裂果薯属(Schizocapsa),有60余种,分布于热带地区.中国有2属6种,分布于东南至西南部[1].箭根薯(TaccachantrieriAndre)为蒟蒻薯属多年生草本植物,其小苞片线形,下垂状如虎须,故又名为“老虎须”,分布于云南、海南、广东、广西等地,生于水边或雨林荫湿处,是集赏花、观叶、药用为一体的珍稀植物[1].块状根茎入药,有清热解毒、消炎止痛的功效,用于治疗刀伤、胃及十二指肠溃疡、肝炎、高血压、胃痛等[2].
箭根薯中含有丰富的甾体类化合物,根据其结构特点主要分为3类:箭根薯酮内酯类(taccalonolides)、醉茄内酯类(withanolides)和螺甾烷类(spirostanol sapogenins)[3].其中箭根薯酮内酯类是一类具有新颖的6-6-6-5-6五元环骨架的C28甾体,最先从裂果薯(T.plantaginea)中分离得到[4],目前也仅从蒟蒻薯科分离得到.箭根薯酮内酯类化合物属于结构新型(甾体类)的微管抑制剂,具有干扰微管-微管蛋白动力学稳定性的作用.该类化合物与紫杉醇具有类似的作用特点,可以诱导和促使微管聚合,使细胞凋亡[5].为了寻找新颖的箭根薯酮内酯类化合物,对该植物的地上部分进行了化学成分研究,发现了12个化合物,其中化合物1为一个新的二氢查耳酮化合物,通过一维、二维核磁共振、高分辨质谱、红外、紫外以及多种波谱手段来确定其结构为1-(1,3-benzodioxol-5-yl)-3-(2,4-bimethoxyphenyl)-1-propanone (1)(图1).通过波谱学数据及理化性质确定其他已知化合分别为1-(3,4-dimethoxyphenyl)-3-(2,4,6-trimethoxyphenyl)-1-propanone (2),alusenone (3),erythrabyssin II (4),phaseolin (5),warangalone (6),(2S)-5-hydroxy-7,3′,4′-trimethoxyflavan (7),(2S)-5-hydroxy-7,3′,5′-triamethoxyflavan (8),(2S)-4′-hydroxy-5,7,3′-trimethoxyflavan (9),diosgenin (10),stigmasterol (11)和cycloneolitsol (12)(图3).
1 实验部分
1.1 样品、试剂和仪器
箭根薯(TaccachantrieriAndre)2017年采于云南省西双版纳,由中国科学院昆明植物研究所陈瑜老师鉴定,标本保存于中南民族大学药学院(标本号:SNU20170615).
1H和13C NMR由Bruker AM-600(德国)测定,内标为TMS,化学位移(δ)单位ppm,偶合常数(J)的单位为Hz;ESI MS和HR-ESI MS由Bruker HCT/Esquire(德国)测定;紫外色谱图由Shimadzu UV-2401 PC光谱仪(日本岛津公司)测定;红外色谱图由Bruker Tensor 27 FT-IR光谱仪测定,用溴化钾压片;高效液相色谱仪为分析型和制备型高效液相色谱Agilent 1200 系列 .
分离材料:柱层析硅胶(80~100目及200~300 目)、薄层层析硅胶(GF254)和硅胶H(青岛海洋化工厂);Sephadex LH-20(瑞士Amersham Biosciences公司);反相硅胶Chromatores(日本Fuji公司);分析型HPLC为Agilent 1260,色谱柱为Agilent Zorbax SB-C18柱(4.6 mm × 150 mm),粒径5μm;半制备型HPLC为Agilent 1260,色谱柱为Agilent Zorbax SB-C18柱(9.4 mm×150 mm),粒径5μm.中压MPLC(Biotage公司).显色方法为254和365 nm紫外灯下观察荧光,10%硫酸乙醇溶液加热显色.
1.2 提取和分离
箭根薯地上部分18 kg晾干后粉碎,用90 L甲醇提取3次,每次48 h,浓缩物用乙酸乙酯萃取,萃取液减压浓缩后得浸膏700 g.用1400 g硅胶(80~100目)拌样,以3600 g硅胶(80~100目)进行柱层析,氯仿∶甲醇梯度洗脱,用TLC进行检测,合并相同馏分,划分为A~E制备.
C段(79 g)经中压色谱(填充RP-18,甲醇/水:50%到100%)粗分得4个馏分,其中第二馏分(15 g),经正相硅胶(200~300目)石油醚:丙酮(20∶0~0∶1)洗脱,得3个组分:2-1;2-2;2-3.2-1(4g)经200~300目正相硅胶(200~300目)石油醚:乙酸乙酯(40∶1)层析得化合物10(50 mg);其中2-2(0.0578 g)经过Saphadex LH-20(甲醇)柱层析,再经高效液相 (色谱柱SB-C18,5 μm,9.4 mm×150 mm),流动相60%乙腈/水,纯化得化合物8(3 mg)和9(2 mg);
第3馏分(4.5 g),经正相硅胶(200~300目)石油醚:乙酸乙酯(20∶0~0∶1)层析,得5个组分:3-1;3-2;3-3;3-4;3-5.其中3-2经制备HPLC(色谱柱SB-C18,21.2 mm×150 mm ,流动相67%甲醇/水),纯化得化合物1(4 mg)和2(2 mg);3-3经制备HPLC(色谱柱SB-C18,21.2 mm×150 mm ,流动相45%甲醇/水),纯化得化合物3(4 mg)和7(4 mg);3-4经半制备HPLC纯化(色谱柱SB-C18 5 μm,9.4 mm×150 mm ,流动相640%-60%乙腈/水)得到化合物4(2 mg)、5(2 mg)和6(1 mg);3-5经正相硅胶柱(200~300目)石油醚:乙酸乙酯(30∶1~20∶1)层析,重结晶得到化合物12(5 mg).
第4馏分(10 g),经Saphadex LH-20(1∶1氯仿/甲醇)层析,得到3个组分,其中第1组分经正相硅胶(200~300目)石油醚∶乙酸乙酯(30∶1~0∶1)洗脱,得到结晶,通过洗结晶得到化合物10(9 mg)和化合物11(5 mg).
2 结构鉴定
2.1 化合物1结构解析及波谱数据
化合物1为无色油状物,易溶于氯仿、丙酮、甲醇等有机溶剂,硫酸乙醇显色反应呈橙红色.通过高分辨质谱推测出分子式为C18H18O6(m/z:331.11737 [M + H]+,计算值为331.11761),不饱和度为10.紫外光谱(CH3OH)λmax(log ε): 230.0(2.51),268.3(2.51),312.5(2.68)处的吸收峰显示结构中含有苯环.红外(IR)光谱数据Vmax(cm-1): 3858,2947,2833,1645,1454,1114,1031显示结构中含有羟基、羰基和苯环结构单元.
1H NMR图谱中可以明显观察到两个甲氧基信号(δH3.78,3.74),一个亚甲二氧基信号[6.04(overlapped,2H)],5个烯碳质子信号[δH7.61(dd,J=8.2,1.8 Hz,1H),7.45(d,J=1.8 Hz,1H),6.83(d,J=8.2 Hz,1H),6.18(d,J=2.4 Hz,1H),6.04(overlapped,1H)].13C NMR图谱显示化合物1有18个碳,通过DEPT图谱可以确定1结构中有2个甲氧基、3个亚甲基(其中一个为亚甲二氧基)、5个次甲基和8个季碳信号(表1).以上数据显示化合物1可能为二氢查尔酮,同已知化合物taccabulin C非常相似.与已知化合物taccabulin C[6]的核磁数据对照发现,化合物1多了一个亚甲二氧基取代,少了一个甲氧基(图1).在HMBC图谱中δH6.04(overlapped,2H)与C-3和C-4有相关,确定该亚甲二氧基链接在C-3位和C-4位(图2).在HMBC图谱中发现δH3.79(s,3H)与δC156.3(C-2′,s)相关,δH3.7,4(s,3H)与δC159.0(C-4′,s)相关确定两个甲氧基分别连在C-2′位和C-4′位(图2).进一步分析化合物1的2D NMR图谱,确定化合物1结构中的其他结构片段和已知化合物taccabulin C一致,最终1的结构确定,并命名为1-(1,3-benzodioxol-5-yl)-3-(2,4-bimethoxyphenyl)-1-propanone(1).

图1 化合物1和taccabulin C的结构
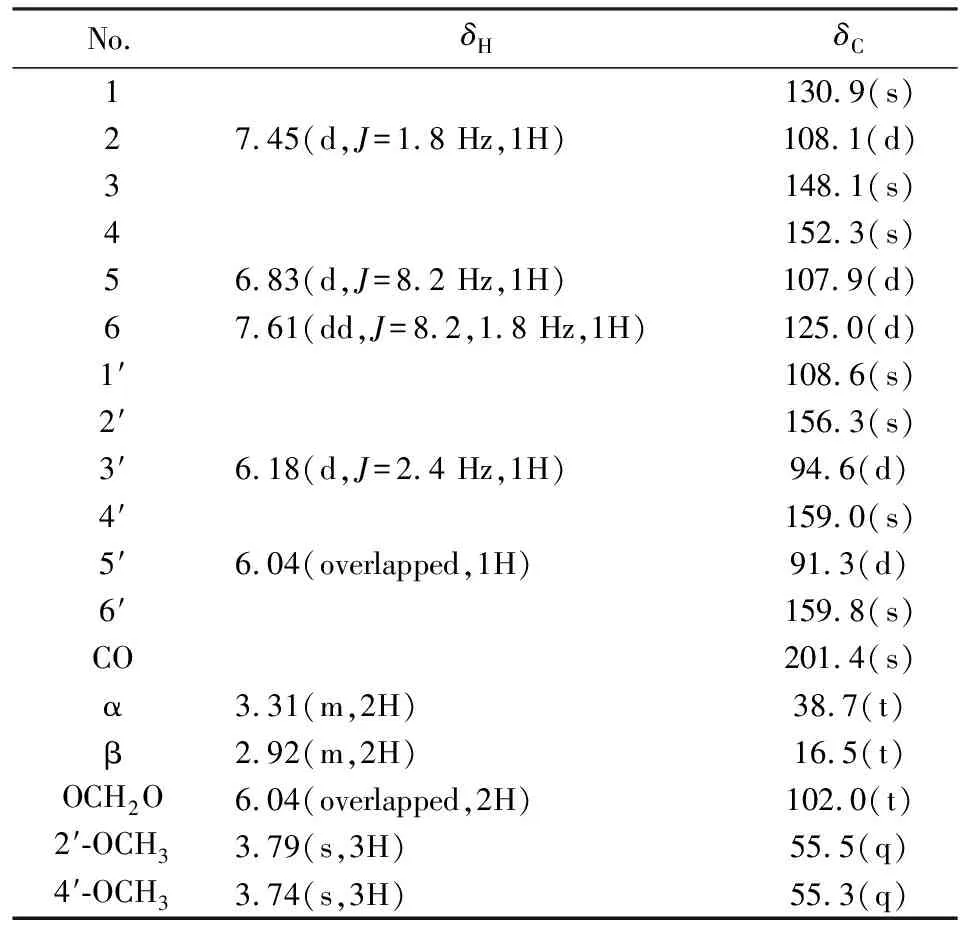
表1 化合物1的1H NMR和13C NMR数据

图2 化合物1的主要2D NMR相关示意图
2.3 已知化合物理化性质及波谱数据
1-(3,4-Dimethoxyphenyl)-3-(2,4,6-trimethoxyphenyl)-1-propanone(2),C20H24O6,黄色粉末.1H NMR(600 MHz,CDCl3):δH7.64(dd,J=8.4,1.7 Hz,1H),7.55(d,J=1.7 Hz,1H),7.26(s,2H),6.87(d,J=8.4 Hz,2H),3.95(s,3H),3.94(s,3H),3.82(s,3H),3.78(s,6H),3.05(m,2H),2.98(m,2H).13C NMR(150 MHz,CDCl3):δC199.7(s),159.7(s),158.9(s),158.9(s),153.0(s),148.9(s),130.5(s),123.0(d),110.4(d),110.0(d),90.5(d),56.2(q),56.1(q),55.7(q),55.5(q),38.4(t),18.7(t).ESI-MSm/z: 361 [M + H]+.以上波谱数据与文献[7]报道一致.
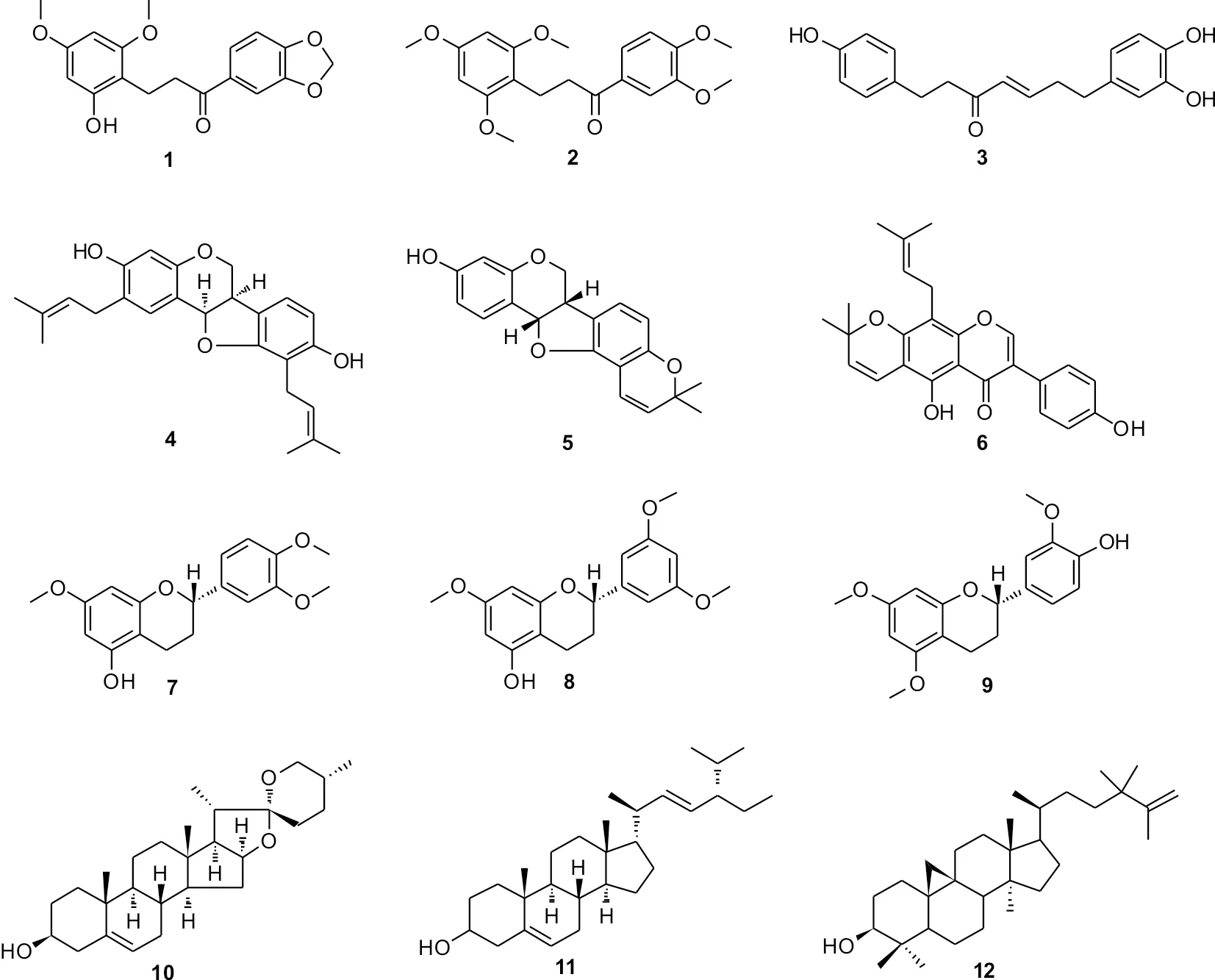
图3 箭根薯地上部分分离得到的化合物
Alusenone(3),C19H20O4,黄色油状.1H NMR(600 MHz,CDCl3):δH7.24(d,J=8.1 Hz,2H),6.99(d,J=8.4 Hz,2H),6.82(d,J=8.1 Hz,1H),6.58(m,2H),5.74(d,J=2.0 Hz,1H),5.70(dd,J=15.4,1.7 Hz,1H),3.06(t,J=6.7 Hz,2H),2.68(q,J=7.1,6.1 Hz,4H),2.33(m,2H).13C NMR(150 MHz,CDCl3):δC200.9(s),154.5(s),148.8(s),148.6(d),143.2(s),137.6(s),134.0(s),131.2(d),130.9(d),123.6(d),122.3(d),114.9(d),114.2(d),44.0(t),33.2(t),32.8(t),31.4(t).ESI-MSm/z: 313 [M + H]+.以上波谱数据与文献[7]报道一致.
ErythrabyssinII(4),C25H28O4,黄色油状.1H NMR(600 MHz,CD3OD):δH7.08(s,1H),6.82(d,J=7.9 Hz,1H),6.25(d,J=4.8 Hz,2H),5.30(d,J=6.9 Hz,2H),5.18(ddt,J=7.4,6.0,1.5 Hz,1H),4.10(qd,J=7.5,3.5 Hz,1H),3.42(d,J=10.7 Hz,1H),3.36(ddd,J=11.1,6.8,4.8 Hz,1H),3.24-3.11(m,4H),1.72(d,J=1.4 Hz,3H),1.70(d,J=1.3 Hz,3H),1.68(d,J=1.3 Hz,3H),1.59(d,J=1.3 Hz,3H).13C NMR(150 MHz,CD3OD):δC160.0(s),157.4(s),157.1(s),132.5(d),124.1(d),123.8(d),123.4(s),122.7(d),119.3(s),112.6(s),108.2(d),103.4(d),79.6(d),67.7(t),41.5(d),28.5(t),26.0(d),26.0(d),23.7(t),17.9(q),17.8(q).ESI-MSm/z: 393 [M + H]+.以上波谱数据与文献[8]报道一致.
Phaseolin(5),C20H20O6,黄色油状.1H NMR(600 MHz,CDCl3):δH7.32(dd,J=8.3,2.0 Hz,1H),7.00(d,J=8.0 Hz,1H),6.50(m,1H),6.46(d,J=9.9 Hz,1H),6.31(m,1H),6.28(d,J=8.1 Hz,1H),5.63(d,J=9.9 Hz,1H),5.49(d,J=6.6 Hz,1H),4.22(ddd,J=9.4,4.0,1.5 Hz,1H),3.54(m,1H),3.47(m,1H),1.39(s,3H),1.36(s,3H).13C NMR(151 MHz,CDCl3):δC160.4(s),158.1(s),156.7(s),154.9(s),133.3(d),130.8(d),125.1(d),121.0(s),117.4(d),112.6(d),110.8(d),109.5(d),107.2(s),104.1(d),80.5(d),77.0(s),67.6(t),41.0(d),28.1(q),27.9(q)ESI-MSm/z: 323 [M + H]+.以上波谱数据与参考文献[9]一致.
Warangalone(6), C25H24O5.1H NMR(600 MHz,CDCl3):δH13.06(s,1H),7.89(s,1H),7.37(d,J=8.4 Hz,2H),6.86(d,J=8.3 Hz,2H),6.73(s,1H),5.63(d,J=10.0 Hz,1H),5.18(m,1H),3.40(s,2H),1.81(s,3H),1.68(s,3H),1.47(s,6H).13C NMR(150 MHz,CDCl3):δC181.4(s),157.0(s),155.9(s),154.9(s),154.8(s),152.7(d),131.8(s),130.4(d),130.4(d),128.1(d),123.3(s),123.1(s),122.0(d),115.9(d),115.7(d),115.7(d),107.5(s),105.9(s),105.5(s),77.9(s),28.2(q),28.2(q),25.8(q),21.3(t),17.9(q).ESI-MSm/z: 405 [M + H]+.以上波谱数据与文献[10]报道一致.
(2S)-5-Hydroxy-7,3′,4′-trimethoxyflavan(7), C18H20O5,黄色粉末.1H NMR(600 MHz,CD3OD):δH6.99(d,J=2.0 Hz,1H),6.84(dd,J=8.1,2.0 Hz,1H),6.78(d,J=8.1 Hz,1H),6.09(d,J=2.3 Hz,1H),6.04(d,J=2.4 Hz,1H),3.85(s,3H),3.77(s,3H),3.72(s,3H),3.30(s,22H),2.69(m,1H),2.60(m,1H),2.13(m,1H),1.94(m,1H).13C NMR(150 MHz,CD3OD):δC160.9(s),160.0(s),157.7(s),148.9(s),147.2(s),134.9(s),120.0(d),116.0(d),110.9(d),104.5(s),94.6(d),92.0(d),79.1(d),56.4(q),55.8(q),55.6(q),30.8(t),20.4(t).ESI-MSm/z: 317 [M + H]+.以上波谱数据与文献[11]报道一致.
(2S)-5-Hydroxy-7,3′,5′-triamethoxyflavan(8), C18H20O5,黄色粉末.1H NMR(600 MHz,CDCl3):δH6.94(d,J=22.8 Hz,3H),6.10(dd,J=27.8,2.2 Hz,2H),5.63(s,1H),4.89(dd,J=10.7,1.6 Hz,1H),3.91(s,3H),3.80(s,3H),3.75(s,3H),2.78(ddd,J=16.8,5.7,2.4 Hz,1H),2.63(ddd,J=17.2,11.7,6.3 Hz,1H),2.15(m,1H),2.01(m,1H).13C NMR(150 MHz,CDCl3):δC161.7(s),158.9(s),156.7(s),156.9(s),144.2(s),104.5(s),93.6(d),92.9(d),80.1(d),56.3(q),55.8(q),55.6(q),30.8(t),20.4(t).ESI-MSm/z: 317 [M + H]+.以上波谱数据与文献[12]报道一致.
(2S)-4′-Hydroxy-5,7,3′-trimethoxyflavan(9), C18H20O5,黄色粉末.1H NMR(600 MHz,CDCl3)δ 6.96(s,1H),6.92(s,2H),6.11(dd,J=28.0,2.3 Hz,2H),5.65(s,1H),4.89(dd,J=10.7,1.8 Hz,1H),3.91(s,3H),3.80(s,3H),3.76(s,3H),2.78(ddd,J=16.8,5.7,2.5 Hz,1H),2.63(ddd,J=16.7,11.7,6.3 Hz,1H),2.17(ddt,J=13.7,6.3,2.3 Hz,1H),2.01(dtd,J=13.7,11.4,5.7 Hz,1H).13C NMR(150 MHz,CDCl3):δC159.4(s),158.7(s),156.5(s),146.7(s),145.5(s),133.7(s),119.5(d),114.4(d),108.8(d),103.4(s),93.5(d),91.5(d),78.1(d),56.0(q),55.6(q),55.5(q),29.7(t),19.6(t).ESI-MSm/z: 317 [M + H]+.以上波谱数据与文献[13]报道一致.
Diosgenin(10), C27H42O3,白色粉末.1H NMR(600 MHz,CDCl3):δH5.35(m,1H),4.42(m, 1H),3.95(dd,J=11.0,2.6 Hz,1H),3.51(m,1H),3.30(d,J=11.0 Hz,1H),2.29(m,1H),2.23(m,1H),1.08(d,J=7.2 Hz,3H),1.02(s,3H),1.00(d,J=7.0 Hz,3H),0.78(s,3H).13C NMR(150 MHz,CDCl3):δC140.9(s),121.6(d),109.9(s),81.0(d),71.9(d),65.3(t),62.0(d),56.6(d),50.1(d),42.4(t),42.2(d),40.4(s),39.9(t),37.3(t),36.8(s),32.2(t),31.9(t),31.7(t),31.5(d),27.2(d),26.1(t),25.9(t),21.0(t),19.6(q),16.5(q),16.2(q),14.5(q).ESI-MSm/z: 415 [M + H]+.上波谱数据与文献[14]报道一致.
Stigmasterol(11), C28H46O,白色晶体.1H NMR(600 MHz,CDCl3):δH5.35(m,1H),5.14(dd,J=15.1,8.7 Hz,1H),5.01(dd,J=15.1,8.8 Hz,1H),3.52(m,1H),1.84(ddt,J=11.9,7.6,3.4 Hz,3H),1.61(s,3H),1.02(d,J= 6.6 Hz,3H),1.01(s,3H),0.70(s,3H).13C NMR(150 MHz,CDCl3):δC140.9(s),138.5(d),129.5(d),121.9(d),72.0(d),57.0(d),56.1(t),51.4(t),50.3(d),42.5(s),42.4(t),40.6(s),39.8(t),37.4(t),36.7(s),32.1(d),31.8(t),29.1(t),25.5(t),24.5(d),21.4(t),21.2(d),19.5(q),19.1(q),12.4(q),12.2(q).ESI-MSm/z: 413 [M + H]+.以上波谱数据与文献[15]报道一致.
Cycloneolitsol(12), C32H54O,白色粉末.1H NMR(600 MHz,CDCl3):δH4.69(d,J=37.9 Hz,2H),3.29(p,J=4.4 Hz,1H),1.98(m,1H),1.88(m,1H),1.76(m,1H),1.69(d,J=1.3 Hz,2H),1.67(m,2H),1.49(dd,J=12.3,4.9 Hz,1H),1.01(d,J=3.2 Hz,6H),0.96(s,3H),0.95(s,3H),0.88(s,3H),0.85(d,J=6.4 Hz,3H),0.81(d,J=1.9 Hz,3H),0.55(d,J=4.1 Hz,1H),0.33(d,J=4.3 Hz,1H).13C NMR(150 MHz,CDCl3):δC152.5(s),109.4(t),79.0(d),52.2(d),48.9(s),48.1(d),47.2(d),45.3(s),40.6(s),38.8(s),37.4(t),36.7(s),35.7(t),32.9(t),32.1(t),30.8(t),30.5(t),30.0(t),28.2(t),27.7(q),27.4(q),26.6(t),26.2(t),26.1(t),25.6(q),21.2(t),20.1(s),19.5(q),19.4(q),18.6(q),18.1(q),14.1(q).ESI-MS m/z: 455 [M + H]+.以上波谱数据与文献[16]报道一致
3 结语
通过对箭根薯(T.chantrieri)地上部分化学成份的研究,分离纯化获得12个化合物,包括2个甾体、8个黄酮类、1个双苯庚烷类和1个三萜类化合物,其中化合物1为新的二氢查耳酮化合物.但研究没有从箭根薯地上部分分离得到箭根薯酮内酯类物质,推测这类物质主要分布在其地下部分,这与文献报道相符.本研究成果丰富了箭根薯植物的化学成分结构类型,为进一步开发该属植物提供了新的物质基础.
