大蒜中有机硫化合物及其分析方法
2019-10-10翁瑞盛晓婧刘平香张继光邱静钱永忠
翁瑞,盛晓婧,刘平香,张继光,邱静,钱永忠
大蒜中有机硫化合物及其分析方法
翁瑞1,盛晓婧2,刘平香1,张继光2,邱静1,钱永忠1
(1中国农业科学院农业质量标准与检测技术研究所/农业农村部农产品质量安全重点实验室,北京 100081;2中国农业科学院烟草研究所/ 农业农村部烟草质量安全风险评估实验室,山东青岛 266101)
大蒜是在我国广泛种植和食用的农产品,具有抗菌、抗炎、抗氧化等多种营养健康功能。这些主要得益于大蒜中的有机硫化合物,包括蒜氨酸等风味前体化合物、大蒜素等硫代亚磺酸酯和大蒜烯等硫醚类挥发性化合物等。这些有机硫化合物或各自具有其生物活性,或多种化合物相互协同,共同产生同一种生理功效。但有机硫化合物普遍具有易酶解或稳定性差等特点,且不同类别有机硫化合物的化学性质差异也较大,目前对大蒜中有机硫化合物的分析方法仍然存在局限性,现有报道多是对某类化合物进行总量测定,或是针对个别化合物进行测定,尚未有研究对大蒜中的有机硫化合物进行全面系统的分析。因此,本研究分别对大蒜中主要风味前体化合物、硫代亚磺酸酯和硫醚类挥发性化合物的分析方法进行了分类讨论和综述,包括其样品前处理方法和检测方法。
大蒜;有机硫化合物;分析方法;特征性营养成分
1 大蒜中有机硫化物
大蒜(L)是在我国广泛种植的食用农产品,因其抗癌功效[1-2]等健康益处受到大众的喜爱。研究表明,大蒜可显著降低胆固醇水平、抑制血小板聚集、降低血压,从而显著降低心脑血管疾病的患病几率,此外还具有抗菌抗炎[3]、抗氧化[4]等多种功效。这些营养功效主要得益于大蒜中的有机硫化合物(Organic sulfur compounds)。其中,大蒜素可显著降低生物体内活性氧含量,表现出抗氧化能力[5],并且能够与细菌生长所必需的半胱氨酸的巯基结合,破坏细菌的蛋白质代谢过程,具有较强的抗菌、抗病毒、消炎作用[6];蒜氨酸可抑制糖尿病并发症的发生[7];S-烯丙基-L-半胱氨酸具有抗氧化和自由基清除作用,可以清除过氧化氢,抑制低密度脂蛋白氧化,减少氧化性低密度脂蛋白诱导的细胞损伤[8]。大蒜中的有机硫化合物各自具有其生物活性,或多种有机硫化合物相互协同,产生同一种生理功效[9]。
有机硫化合物是大蒜等葱属植物的特征性营养品质成分,尤其大蒜被公认是有机硫化合物含量最丰富的食物。大蒜中有机硫化合物主要包括风味前体化合物、硫代亚磺酸酯(TS)和硫醚类挥发性有机硫化合物(表1)。其中,完整的大蒜鳞茎中的有机硫化合物主要是含硫氨基酸,包括半胱氨酸、少量的蛋氨酸、γ-谷氨酰肽(γ-GP)和S-烷(烯)基半胱氨酸亚砜(ACSO)等。细胞中的ACSO与蒜氨酸酶被液泡膜隔开,当鳞茎组织被破坏时,细胞质中的ACSO会在液泡中蒜氨酸酶的催化作用下水解生成TS。此过程反应迅速,在36—40℃下的大蒜水溶液中ACSO可立即水解,反应时间仅为5—20 s[10]。TS化学性质极不稳定,在不同温度、pH等环境下可反应生成大蒜烯、烯丙基硫醚、乙烯二噻烯等挥发性有机硫化合物,形成大蒜独特的辛辣气味。研究表明,当大蒜素在20℃下暴露20 min时,会转化为66%的二烯丙基二硫化物(DADS)、14%的二烯丙基一硫化物DAS、9%的二烯丙基三硫化物(DATS)和二氧化硫等[11]。除上述代谢路径外,γ-GP还可代谢为S-烯丙基半胱氨酸(SAC)、S-烯丙基巯基-L-半胱氨酸等[12]。大蒜中有机硫化合物的代谢路径如图1所示。
有机硫化合物极不稳定,且不同类别有机硫化合物的化学性质差异较大,因此,目前对大蒜中有机硫化合物的分析方法仍然存在局限性,尚未有研究对大蒜中的有机硫化合物进行全面系统的分析。
2 主要硫化物的分析方法
2.1 风味前体化合物
完整大蒜中含量较高的风味前体化合物包括蒜氨酸、γ-L-谷氨酰-S-(反-丙烯基)-L-半胱氨酸(GSPC)、γ-L-谷氨酰-S-烯丙基-L-半胱氨酸(GSAC)等,其含量分别为20.84—45.60 mg∙g-1、30.04—42.34 mg∙g-1和18.95—26.49 mg∙g-1;γ-L-谷氨酰-S-甲基-L-半胱氨酸(GSMC)、甲基蒜氨酸、环蒜氨酸和异蒜氨酸含量次之,含量均低于5 mg∙g-1(干重)[13]。S-烯丙基-L-半胱氨酸(SAC)、S-甲基-L-半胱氨酸(SMC)和S-(反-丙烯基)-L-半胱氨酸(SPC)在刚收获大蒜中含量较低,但在发酵等加工过程中其含量会大幅升高[14]。大蒜中风味前体化合物的组成受到大蒜品种、生长环境、硫肥、采收条件等多种因素的影响[15]。
针对大蒜中风味前体化合物分析的研究工作主要有两个主流思路。一是通过对TS、丙酮酸、氨等下游代谢产物的检测间接获得风味前体化合物的含量,尤其以间接测定丙酮酸为主。当大蒜组织被破坏时,风味前体化合物在蒜氨酸酶的作用下生成TS时,伴随有丙酮酸的产生,因此大蒜中丙酮酸的含量与风味前体化合物含量呈正相关关系[16]。丙酮酸测定最常用的方法是SCHWIMMER和WESTON于1961年提出的分光光度法[17],当向大蒜提取溶液中加入过量的2,4-二硝基苯肼时,2,4-二硝基苯肼会与丙酮酸的羰基发生特征反应,并在420 nm下产生显色反应。但此方法测定的是大蒜中的丙酮酸总量,包括蒜氨酸酶作用下生成的丙酮酸及大蒜组织经由三羧酸循环产生的内源性丙酮酸。在大蒜中,内源性丙酮酸含量通常只占到2%左右[18],所以在通过测定丙酮酸间接推断ACSO含量时,通常可忽略内源性丙酮酸。此间接测定方法较简单,但无法获得风味前体化合物的轮廓信息;而且鉴于环蒜氨酸不会在蒜氨酸酶的作用下转化成为大蒜素,因此测定丙酮酸无法获得环蒜氨酸的含量信息。
另一种是对大蒜中蒜氨酸酶活性进行抑制后,直接对被破坏大蒜组织中的风味前体化合物进行检测分析。大蒜中的蒜氨酸酶有两种,反应底物分别为蒜氨酸、异蒜氨酸(最适pH为4.5)和甲基蒜氨酸(最适pH为6.5)。研究发现,在pH 1.5—3(胃中消化液pH)条件下,蒜氨酸酶会发生不可逆的失活[19]。因此,可采用酸抑制法,即通过加入一定量的酸调节溶液(pH<3)抑制蒜氨酸酶的活性[13],甲醇-水-甲酸(50﹕50﹕1,v/v/v)溶液体系即可充分抑制蒜氨酸酶的活性[20]。除酸抑制法外,鉴于蒜氨酸酶为蛋白酶,能够使蛋白质变性的因素也可导致蒜氨酸酶失活。一是热力灭酶法应用较为普遍,包括将未剥皮大蒜放入沸水中煮7 min的煮沸法[14]和将剥皮大蒜直接加热20 min[21]的直接加热法。二是冷冻处理法,将大蒜直接放入液氮中保存[22]。三是微波法,先将大蒜放入水中,再进行微波加热[23]。陈倩娟等[24]发现,在300 kW功率下微波3 min时,蒜氨酸酶的抑制效果最好。四是有机试剂处理法,一般使用90%的乙醇溶液处理30 min,液料比为4﹕1时效果最好[24]。五是酶抑制剂法,使用羟甲氧基胺半盐酸盐[25]或K+、Mg2+、Cu2+等金属离子[26]均可抑制蒜氨酸酶的活性。

表1 大蒜中的有机硫化合物
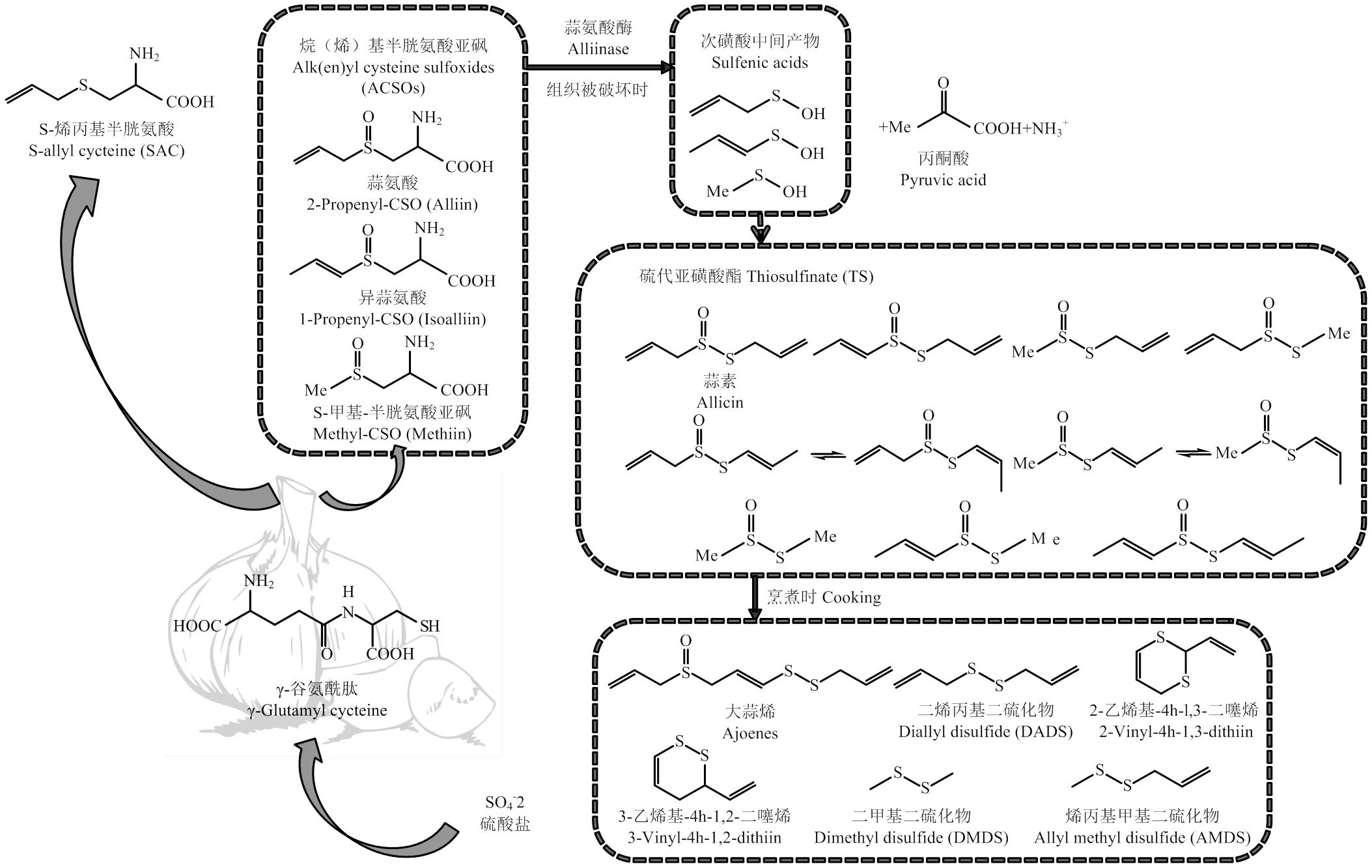
图1 大蒜中含硫化合物的合成及转化途径
分析方法中,最早应用于检测大蒜中风味前体化合物的是薄层色谱法[27]。受限于较差的分离和定量能力,高效液相色谱(HPLC)与紫外或荧光检测联用技术渐渐取代了薄层色谱法,成为风味前体化合物分析中的主流方法。传统的HPLC方法大多需要繁杂的净化步骤,或使用邻苯二甲醛、叔丁基硫醇[10,28]、芴甲基氯甲酸酯[29]、丹磺酰氯[30]、异硫氰酸苯酯[31]等对风味前体化合物进行柱前衍生化,以除去样品基质的干扰。衍生化反应还可大幅提高风味前体化合物的消光系数,显著提高检测灵敏度。除衍生化方法外,ARNAULT等[32]还使用庚烷磺酸为离子对试剂,在超低pH下实现了对蒜氨酸和保留行为更强的二肽的分离,并将此方法应用于对SAC、蒜氨酸和大蒜素的分析,但此方法无法对异蒜氨酸和S-甲基-L-半胱氨酸亚砜进行分析。
尽管HPLC方法可以实现风味前体化合物高准确性、高重复性的检测分析,其分辨能力仍然有限,很难实现对痕量蒜氨酸类似物的分析,尤其是非对映异构体。基于此考虑,Keusgen等[27]通过将蒜氨酸酶固定在电极上,对风味前体化合物进行生物传感检测,简化了HPLC方法中的柱前衍生化及分离步骤,可实现对大蒜相关样品的高通量分析。MIRON等[33]基于蒜氨酸与2-硝基-5-硫代苯甲酸酯[34]及蒜氨酸和大蒜素与4-巯基吡啶的反应建立了检测大蒜中蒜氨酸、大蒜素及蒜氨酸酶活性的分光光度法。HORIE等[23]使用毛细管电泳技术对蒜氨酸、S-甲基半胱氨酸亚砜和丙酮酸进行了分析,KUBEC等[35]使用芴甲基氯甲酸酯对风味前体化合物衍生化后使用胶束电动毛细管色谱对其进行了测定。ZHU等[36]和KIM等[14]通过液相色谱串联质谱(LC-MS/MS)的多重反应检测模式(MRM),不需要进行衍生化等繁琐的前处理过程,也最大程度地避免了基质效应。此外,气相色谱(GC)因其高灵敏度和分辨率,也被应用于大蒜中风味前体化合物的分析。但ACSO热稳定性较差,而GC分析通常伴随高温,且使用GC进行分析时通常需要进行衍生化,操作繁琐,因此,使用GC对大蒜中风味前体化合物进行分析一直备受争议,也并未得到广泛应用。
2.2 硫代亚磺酸酯
存在于大蒜完整鳞茎细胞质中的非挥发性风味前体化合物在大蒜组织被破坏(如咀嚼、粉碎等)时,会在蒜氨酸酶的作用下转化为化学性质极不稳定的次磺酸中间产物,随后迅速代谢为TS。大蒜中的TS主要为二烯丙基硫代亚磺酸酯(大蒜素),含量为1.48—5.32 mg∙g-1;烯丙基甲基硫代亚磺酸酯(AMThs)含量次之,为0.97—2.67 mg∙g-1;烯丙基(反-丙烯基)硫代亚磺酸酯(ATPThs)含量较低,为0.16—0.44 mg∙g-1(鲜重)[37]。
TS为水溶性化合物,因此可直接使用水溶液对其进行提取。除此之外,也有研究使用甲醇[32]、二氯甲烷[38]等进行提取。近些年来,因为“环境友好”理念的普及,固相微萃取[39]、分散液液微萃取[40]、超临界流体萃取[41]等方法也逐渐得到应用,尤其超临界流体萃取法。所谓超临界流体是温度、压力在其临界状态以上的流体状态,此时的黏度和扩散系数接近气体,而密度和溶剂化能力接近液体。由于有机硫化合物在有机溶剂中仍具有较高的反应活性,而超临界流体萃取过程中没有有机溶剂的参与,并且始终与氧气和高温环境隔绝,因此可有效降低大蒜中有机硫化合物的氧化和分解。
大蒜素是大蒜中最典型的一类TS,约占TS总量的70%—80%,它也被认为是表征大蒜营养品质的关键性指标。根据英国药典记载,当且仅当蒜粉中大蒜素含量超过4.5 mg∙g-1时,蒜粉才能表现出应有的生物活性[42]。但大蒜素的半衰期受浓度、温度和贮存溶剂影响极大,非常不稳定[43],因此分析难度也较大。
CAVALLITO等[44]通过甲醇提取后,第一次分离和表征了大蒜中的大蒜素。随后FREEMAN等[45]使用前文所说的间接测定方法,通过分析检测丙酮酸间接获得了TS的含量,MIRON等[34]通过TS和二硫代二硝基苯甲酸的显色反应测定了TS的总量。但这些方法都只能获得TS的总含量,无法获得各TS化合物的指纹信息。考虑到色谱方法的高分辨率,GC方法开始逐渐应用于对大蒜中TS的分析。但在1964年,BERNHARD等[46]指出,使用GC测定得到的化合物很多都是因高温导致的非真实信息,随后BRODNITZ等[11]使用气相色谱-质谱(GC-MS)技术建立了大蒜提取物中大蒜素的检测分析方法,论证了大蒜素在高温下的分解转化现象,证实了这一结论。因此,尽管GC方法具有出色的定性定量能力和分辨率,仍不适用于大蒜素等热不稳定化合物的分析。为了规避GC导致的热分解,研究兴趣渐渐转向HPLC方法,通过正相和反相HPLC对大蒜提取物[37]、加工产品[47]以及血液等生物样品[40]中的大蒜素等TS进行分析,BOCCHINI等[48]将反相HPLC和柱后光化学反应器联用,不仅提高了检测的选择性和灵敏度,也大幅提高了回收率。此外,RITOTA等[49]还利用高分辨魔角旋转核磁共振技术(HRMAS-NMR)分析了意大利不同地区白皮蒜和紫皮蒜中糖类、有机酸、脂肪酸、多不饱和脂肪酸及有机硫化合物等的含量,将组学的技术应用到大蒜的溯源中,并采用固相微萃取(SPME)和GC-MS技术对大蒜中的大蒜素等TS类有机硫化合物进行了确证性检测。
2.3 硫醚类挥发性有机硫化合物
目前已有大量研究报道了大蒜烯、烯丙基硫醚、乙烯二噻烯等硫醚类挥发性有机硫化合物的提取方法,其中最早使用的是蒸馏法,包括蒸汽蒸馏、水蒸馏、微波辅助蒸馏等。但尽管大蒜烯、烯丙基硫醚、乙烯二噻烯等挥发性有机硫化合物相较于TS化学稳定性具有很大改善,但对温度仍具有敏感性,在蒸馏操作中若遇到高温,仍会分解,导致不真实信息的产生。因此,溶剂萃取法开始得到应用。鉴于挥发性有机硫化合物大都具有极弱的极性,使用溶剂通常为正己烷[50]、二氯甲烷[51]等。但此方法较为费时且需要消耗大量有机溶剂,因此近些年研究重心渐渐转向固相微萃取、分散液液微萃取、超临界流体萃取、低温冷阱萃取等[39-40,52]。
大蒜中硫醚类挥发性有机硫化合物的定量检测目前主要采用HPLC方法[53]。LOCATELLI等[39]研究发现,采用SPME-GC和SPME-HPLC-UV检测同一个大蒜油样品中的DAS、DADS和DATS含量,会有不同的相对定量结果,GC检测结果表明,DADS占总含量的80%以上,DAS约占10%,DATS含量较低;而HPLC检测结果表明,DADS和DATS分别占到了总含量的50%和40%以上,DAS含量较低。究其原因,可能是由于DADS耐热性较差,GC检测过程中温度相对较高,从而使其发生转化所引起,因此,常规的GC及其质谱联用技术并不适合该类物质的检测。ABU-LAFI等[54]采用“低温”GC-MS及柱头进样和HPLC技术研究了新鲜大蒜中低温提取物的成分,发现主要有2-乙烯基-4H-l,3-二噻烯、3-乙烯基-4H-1,2-二噻烯和二苯基二硫化物3种含硫化合物,而在高温水浴(100℃)条件下的大蒜提取物中,该类化合物会被分解为其他挥发性含硫化合物。除色谱方法外,KIMBARIS等[55]也采用傅立叶变换拉曼光谱技术实现了大蒜中二甲基二硫醚等多种有机硫化合物的快速、简单、无损检测。
3 小结与展望
大蒜是一种具有多种营养和药用作用的食用农产品,它的多种功效主要归功于其含有的有机硫化合物,因此,对大蒜中有机硫化合物的分析至关重要。但大蒜中各类有机硫化合物的分析几乎都面临着化合物化学性质不稳定、易氧化、易降解的问题,因此未来仍需大力开发低温、无损型的样品前处理方法和检测方法,例如超临界流体萃取前处理方法、大气压离子化质谱检测方法等。
此外,受限于稳定性,有机硫化合物的标准品极不易获得,大多需要专门进行合成,且合成后的储存时间也极为有限。目前针对大蒜中有机硫化合物分析的报道大多仅是对大蒜及相关产品中的风味前体化合物、TS等进行总量的测定,或是对个别化合物进行分析,并未对大蒜中有机硫化合物进行系统分析和研究。为全面评价大蒜质量品质水平,可通过组学技术对大蒜中的有机硫化合物进行分析。代谢组是自基因组、转录组和蛋白组之后发展起来的系统生物学的重要研究平台,已开始应用于农产品的诸多方面,包括产地溯源、真伪鉴别、功能基因鉴定、途径解析以及农产品在种植、贮存运输过程中的监控等。它相比基因组、转录组和蛋白组更接近生物体表型,基因组等的微小改变也可在代谢组层面得以体现和放大。因此,基于代谢组学分析大蒜中有机硫化合物的代谢轮廓是将来的一个研究方向。
[1] SHUKLA Y, KALRA N. Cancer chemoprevention with garlic and its constituents., 2007, 247(2): 167-181.
[2] KHANUM F, ANILAKUMAR K R, VISWANATHAN K R. Anticarcinagenic properties of garlic: A review., 2004, 44(6): 479-488.
[3] LANZOTTI V, SCALA F, BONANOMI G. Compounds from Allium species with cytotoxic and antimicrobial activity., 2014, 13(4): 769-791.
[4] FRATIANNI F, OMBRA M N, COZZOLINO A, RICCARDI R, SPIGNO P, TREMONTE P, COPPOLA R, NAZZARO F. Phenolic constituents, antioxidant, antimicrobial and anti-proliferative activities of different endemic Italian varieties of garlic (L.)., 2016, 21: 240-248.
[5] LIU C, CAO F, TANG Q Z, YAN L, DONG Y G, ZHU L H, WANG L, BIAN Z Y, LI H L. Allicin protects against cardiac hypertrophy and fibrosis via attenuating reactive oxygen species-dependent signaling pathways., 2010, 21(12): 1238-1250.
[6] LAWAL B, SHITTU O K, OIBIOKPA F I, MOHAMMED H, UMAR S I, HARUNA G M. Antimicrobial evaluation, acute and sub-acute toxicity studies of., 2016, 5(4): 296-301.
[7] ANWAR S, YOUNUS H. Inhibitory effect of alliin fromon the glycation of superoxide dismutase., 2017, 103: 182-193.
[8] BANERJEE S K, MUKHERJEE P K, MAULIK S K. Garlic as an antioxidant: The good, the bad and the ugly., 2003, 17(2): 97-106.
[9] RIVLIN R S, BUDOFF M, AMAGASE H. Significance of garlic and its constituents in cancer and cardiovascular disease., 2006, 136(3): V.
[10] KREST I, GLODEK J, KEUSGEN M. Cysteine sulfoxides and alliinase activity of somespecies., 2000, 48(8): 3753-3760.
[11] BRODNITZ M H, PASCALE J V, VAN DERSLICE L. Flavor components of garlic extract., 1971, 19: 273-275.
[12] RAMIREZ D A, LOCATELLI D A, GONZáLEZ R E, CAVAGNARO P F, CAMARGO A B. Analytical methods for bioactive sulfur compounds in: An integrated review and future directions., 2017, 61: 4-19.
[13] MONTANO A, BEATO V M, MANSILLA F, ORGAZ F. Effect of genetic characteristics and environmental factors on organosulfur compounds in garlic (L.) grown in Andalusia, Spain., 2011, 59(4): 1301-1307.
[14] KIM S, PARK S L, LEE S, LEE S Y, KO S, YOO M. UPLC/ ESI-MS/MS analysis of compositional changes for organosulfur compounds in garlic (L.) during fermentation., 2016, 211: 555-559. doi: 10.1016/j.foodchem.2016.05.102
[15] DIRIBA-SHIFERAW G, NIGUSSIE-DECHASSA R, KEBEDE W, J. S J, GETACHEW T. Bulb quality of garlic (L.) as influenced by the application of inorganic fertilizers., 2014, 9(8): 784-796.
[16] GONZáLEZ R E, SOTO V C, SANCE M M, CAMARGO A B, GALMARINI C R. Variability of solids, organosulfur compounds, pungency and health-enhancing traits in garlic (L.) cultivars belonging to different ecophysiological groups., 2009, 57(21): 10282-10288.
[17] SCHWIMMER S, WESTON W J. Enzymatic development of pyruvic acid in onion as a measure of pungency., 1961, 9: 301-304.
[18] CAVAGNARO P F, CAMARGO A, GALMARINI C R, SIMON P W. Effect of cooking on garlic (L.) antiplatelet activity and thiosulfinates content., 2007, 55(4): 1280-1288.
[19] BLOCK E. The organosulfur chemistry of the genus allium – Implications for the organic chemistry of sulfur., 1992, 31(9): 1135-1178.
[20] YAMAZAKI Y, IWASAKI K, MIKAMI M, YAGIHASHI A. Distribution of eleven flavor precursors, s-alk(en)yl-l-cysteine derivatives, in seven Allium vegetables., 2011, 17(1): 55-62.
[21] ZHANG M, LEI N, ZHU T Z, ZHANG Z S. Thermal processing effects on the chemical constituent and antioxidant activity of s-alk(en)ylcysteine s-oxides (alliin) extract., 2013, 51(1): 309-313.
[22] NASIM S A, DHIR B, SAMAR F, RASHMI K, MAHMOODUZZAFAR, MUJIB A. Sulphur treatment alters the therapeutic potency of alliin obtained from garlic leaf extract., 2009, 47(4): 888-892.
[23] HORIE H, YAMASHITA K. Non-derivatized analysis of methiin and alliin in vegetables by capillary electrophoresis., 2006, 1132(1-2): 337-339.
[24] 陈倩娟, 张民, 刘玉柱, 秦培军. 蒜氨酸酶灭活方法研究. 食品科技, 2009, 34(6): 228-231.
CHEN Q J, ZHANG M, LIU Y Z, QIN P J. Study on inactivated enzyme methods of alliinase in garlic., 2009, 34(6): 228-231. (in Chinese)
[25] HRBEK V, REKTORISOVA M, CHMELAROVA H, OVESNA J, HAJSLOVA J. Authenticity assessment of garlic using a metabolomic approach based on high resolution mass spectrometry., 2018, 67: 19-28.
[26] 莫英杰, 王静, 孙宝国, 曹雁平. 超声波条件下蒜氨酸酶性质研究. 中国食品学报, 2010, 10(1): 61-66.
MO Y, WANG J, SUN B, CAO Y. Effect of ultrasound on property of alliinase., 2010, 10(1): 61-66. (in Chinese)
[27] KEUSGEN M. TLC analysis ofconstituents., 1997, 63(1): 93-94.
[28] DORAN J A, O'DONNELL J S, LAIRSON L L, MCDONALD M R, SCHWAN A L, GRODZINSKI B. S-alk(en)yl-L-cysteine sulfoxides and relative pungency measurements of photosynthetic and nonphotosynthetic tissues of., 2007, 55(20): 8243-8250.
[29] THOMAS D J, PARKIN K L. Quantification of alk(en)yl-L-cysteine sulfoxides and related amino acids in alliums by high-performance liquid chromatography., 1994, 42(8): 1632-1638.
[30] YOO K S, PIKE L M. Determination of flavor precursor compound S-alk(en)yl-L-cysteine sulfoxides by an HPLC method and their distribution inspecies., 1998, 75(1/2): 1-10.
[31] RANDLE W M, LANCASTER J E, SHAW M L, SUTTON K H, HAY R L, BUSSARD M L. Quantifying onion flavor compounds responding to sulfur fertility-sulfur increases levels of alk(en)yl cysteine sulfoxides and biosynthetic intermediates., 1995, 120(6): 1075-1081.
[32] ARNAULT I, CHRISTIDèS J P, MANDON N, HAFFNER T, KAHANE R, AUGER J. High-performance ion-pair chromatography method for simultaneous analysis of alliin, deoxyalliin, allicin and dipeptide precursors in garlic products using multiple mass spectrometry and UV detection., 2003, 991(1): 69-75.
[33] MIRON T, SHIN I, FEIGENBLAT G, WEINER L, MIRELMAN D, WILCHEK M, RABINKOV A. A spectrophotometric assay for allicin, alliin, and aliinase () with a chromogenic thiol: reaction of 4-mercaptopyridine with thiosulfinates., 2002, 307(1): 76-83.
[34] MIRON T, RABINKOV A, MIRELMAN D, WEINER L, WILCHEK M. A spectrophotometric assay for allicin and alliinase () activity: Reaction of 2-nitro-5-thiobenzoate with thiosulfinates., 1998, 265(2): 317-325.
[35] KUBEC R, DADAKOVA E. Quantitative determination of S-alk(en) ylcysteine-S-oxides by micellar electrokinetic capillary chromatography., 2008, 1212(1/2): 154-157.
[36] ZHU Q, KAKINO K, NOGAMI C, OHNUKI K, SHIMIZU K. An LC-MS/MS-SRM method for simultaneous quantification of four representative organosulfur compounds in garlic products., 2016, 9(12): 3378-3384.
[37] KHAR A, BANERJEE K, JADHAV M R, LAWANDE K E. Evaluation of garlic ecotypes for allicin and other allyl thiosulphinates., 2011, 128(4): 988-996.
[38] YOO M, LEE S, LEE S, SEOG H, SHIN D. Validation of high performance liquid chromatography methods for determination of bioactive sulfur compounds in garlic bulbs., 2010, 19(6): 1619-1626.
[39] LOCATELLI D A, ALTAMIRANO J C, LUCO J M, NORLIN R, CAMARGO A B. Solid phase microextraction coupled to liquid chromatography. Analysis of organosulphur compounds avoiding artifacts formation., 2014, 157: 199-204.
[40] RAMIREZ D A, LOCATELLI D A, TORRES-PALAZZOLO C A, ALTAMIRANO J C, CAMARGO A B. Development of garlic bioactive compounds analytical methodology based on liquid phase microextraction using response surface design. Implications for dual analysis: Cooked and biological fluids samples., 2017, 215: 493-500.
[41] DEL VALLE J M, MENA C, BUDINICH M. Extraction of garlic with supercritical CO2 and conventional organic solvents., 2008, 25(3): 535-542.
[42] WANG H P, LI X X, LIU S, JIN S. Quantitative determination of allicin inL. bulbs by UPLC., 2010, 71(1-2): 159-161.
[43] RIVLIN R S. Historical perspective on the use of garlic., 2001, 131(3): 951s-954s.
[44] CAVALLITO C J, BAILEY J H. Antibacterial substances from asarum canadense. I. Isolation, physical properties and antibacterial action., 1946, 68(3): 489-492.
[45] FREEMAN G G, MCBREEN F. A rapid spectrophotometric method of determination of thiosulphinate in onion () and its significance in flavour studies., 1973, 1(5): 1150-1152.
[46] BERNHARD R A, SAGHIR A R, JACOBSEN J V, MANN L K. Isolation and identification of allyl monosulfide and allyl alcohol from Allium., 1964, 107: 137-140.
[47] OLECH Z, ZABORSKA W. A spectrophotometric assay for total garlic thiosulfinates content. Kinetic aspects of reaction with chromogenic thiols., 2012, 62(1): 23-29.
[48] BOCCHINI P, ANDALO C, POZZI R, GALLETTI G C, ANTONELLI A. Determination of diallyl thiosulfinate (allicin) in garlic (L.) by high-performance liquid chromatography with a post-column photochemical reactor., 2001, 441(1): 37-43.
[49] RITOTA M, CASCIANI L, HAN B Z, COZZOLINO S, LEITA L, SEQUI P, VALENTINI M. Traceability of Italian garlic (L.) by means of HRMAS-NMR spectroscopy and multivariate data analysis., 2012, 135(2): 684-693.
[50] YOO M, KIM S, LEE S, SHIN D. Validated HPLC method and temperature stabilities for oil-soluble organosulfur compounds in garlic macerated oil., 2014, 52(10): 1165-1172.
[51] LOCATELLI D A, ALTAMIRANO J C, GONZáLEZ R E, CAMARGO A B. Home-cooked garlic remains a healthy food., 2015, 16: 1-8.
[52] KIM N Y, PARK M H, JANG E Y, LEE J. Volatile distribution in garlic (L.) by solid phase microextraction (SPME) with different processing conditions., 2011, 20(3): 775-782.
[53] LOCATELLI D A, NAZARENO M A, FUSARI C M, CAMARGO A B. Cooked garlic and antioxidant activity: Correlation with organosulfur compound composition., 2017, 220: 219-224.
[54] ABU-LAFI S, DEMBICKI J W, GOLDSHLAG P, HANUS L O, DEMBITSKY V M. The use of the 'Cryogenic' GC/MS and on-column injection for study of organosulfur compounds of the., 2004, 17(2): 235-245.
[55] KIMBARIS A C, SIATIS N G, PAPPAS C S, TARANTILIS P A, DAFERERA D J, POLISSIOU M G. Quantitative analysis of garlic () oil unsaturated acyclic components using FT-Raman spectroscopy., 2006, 94(2): 287-295.
Analytical Methods of the Organic Sulfur Compounds in Garlic
WENG Rui1, SHENG XiaoJing2, LIU PingXiang1, ZHANG JiGuang2, QIU Jing1, QIAN YongZhong1
(1Institute of Quality Standards and Testing Technology for Agro-Products, Chinese Academy of Agricultural Sciences/Key Laboratory of Agro-food Safety and Quality of Ministry of Agriculture and Rural Affairs, Beijing 100081;2Tobacco Research Institute, Chinese Academy of Agricultural Sciences/Key Laboratory of Quality and Risk Assessment for Tobacco and Aromatic plant products (Qingdao) of Ministry of Agriculture and Rural Affairs, Qingdao 266101, Shandong)
Garlic is a kind of widely planted agricultural product in China, which has plenty of nutritional and healthy functions, such as antibacterial, anti-inflammatory, and anti-oxidation. These functions are mainly attributed to the organic sulfur compounds, including the flavor precursors, thiosulfinates and thioether volatile compounds. The organic sulfur compounds either have its own biological activities, or multiple compounds work together to produce the same physiological effect. However, considering the poor stability and property diversity of the organic sulfur compounds, the analysis of organic sulfur compounds remains a big challenge. Existing reports are mainly on the determination of several compounds or one group of compounds, and there has been no comprehensive analysis of the organic sulfur compounds in garlic yet. Therefore, in the present review, the analysis methods of the main flavor precursors, thiosulfinates and thioether volatile compounds in garlic were separately discussed and summarized, including the sample pretreatment and detection methods.
garlic; organic sulfur compounds; analytical methods; nutritional ingredient
10.3864/j.issn.0578-1752.2019.18.012

2019-01-17;
2019-04-09
国家特色蔬菜产业技术体系岗位专家任务(CARS-24-E-04)
翁瑞,E-mail:wrsdu1989@126.com
(责任编辑 赵伶俐)
