电针对慢性应激抑郁模型大鼠海马突触可塑性蛋白的影响
2019-10-10叶必宏刘海飞李灵浙潘胜莲宋丰军王庆来朱文宗
叶必宏,刘海飞,李灵浙,潘胜莲,宋丰军,王庆来,朱文宗
(浙江中医药大学附属温州市中医院 针推理疗科,浙江 温州 325000)
抑郁症是以情绪低落、快感缺失、行为迟缓等为主要特征的精神类疾病,重度抑郁症患者会有明显的自杀念头及行为[1]。抑郁症发病机制及其防治研究是现代医学研究的热点,目前较为公认的抑郁症发病机制主要集中在单胺神经递质、神经营养、细胞因子等,而突触可塑性变化在其中的关键作用也日益受到重视[2]。研究表明,抑郁症模型大鼠脑内多个位置伴随着显著的突触可塑性下降,表现为结构的缺失以及功能的失常,其中以海马区研究最为广泛[3]。电针是传统中医疗法之一,治疗抑郁症等情绪疾病有其独特优势,能够减轻药物的不良反应,改善患者躯体化症候群,稳定患者情绪[4]。然而,尽管电针治疗抑郁症在临床已广泛使用,近年来基础研究也快速发展,但更多集中于对动物行为学及生化指标的探讨,机制尚未深入。本研究采用经典的CUMS抑郁模型,通过观察电针对大鼠海马区突触结构及可塑性蛋白表达的影响,深入探讨其抗抑郁机制,为其临床应用提供更多的理论依据。
1 材料和方法
1.1 实验动物 SPF级雄性SD大鼠48只,体质量为200~220 g,由上海斯莱克实验动物有限公司提供,动物许可证号为SCXK(沪)2017-0005。整个实验期间大鼠均饲养在SPF级标准环境中,适应性喂养5 d后开始正式实验。
1.2 试剂与主要仪器 氟西汀(美国礼来公司);RIPA裂解液(美国Thermo公司);兔抗大鼠SYN、PSD-95、CREB、BDNF多克隆抗体(英国Abcam公司);苏木素、伊红(北京中杉金桥生物技术有限公司);山羊抗兔IgG二抗(美国CST公司);华佗牌一次性针灸针(苏州医疗用品厂有限公司);LH202型电针仪(北京华卫医药有限责任公司);光学显微镜(德国ZEISS公司);核酸蛋白测定仪(英国BioDrop公司);酶标仪、组织切片机(美国Thermo公司);凝胶成像分析仪(美国Bio-Rad公司)。
1.3 分组与造模 动物随机分为4 组,包括对照组、模型组、电针组、氟西汀组,每组12只。采用慢性不可预见性温和应激(chronic unpredictable mild stress,CUMS)的方法建立抑郁大鼠模型,应激方法包括夹尾(1 min)、冰浴(4 ℃,4 min)、热水浴(50 ℃,4 min)、倾笼(24 h)、电击(50 V,3 min)、昼夜颠倒(24 h)、禁水禁食(24 h),每天随机采取其中一种应激,同一种应激不连续出现,共持续21 d。
1.4 治疗与给药 电针组于每日应激造模前接受电针治疗,穴位参照林文注主编的《实验针灸学》分别选取百会、印堂穴进行针刺,平刺进针,深度约为6 mm,然后接电针仪,强度为1 mA,频率为2 Hz,每次电针20 min,每日1次,连续21 d。氟西汀组则于每日应激前灌胃给予抗抑郁西药氟西汀,给药剂量为10 mg/kg,灌胃体积为10 mL/kg,给药21 d。对照组和模型组大鼠不予治疗或给药。
1.5 行为学测试
1.5.1 旷场测试:将大鼠放入黑色敞箱中央,待其在敞箱中自由活动1 min后,记录接下来4 min内大鼠的水平活动次数和垂直站立次数,以两者之和作为大鼠的旷场评分。
1.5.2 强迫游泳实验:将大鼠放入高50 cm透明圆柱形水缸中,水深约40 cm,水温保持在(25±2)℃。待大鼠适应1 min后,记录接下来4 min内大鼠的不动时间(两前爪静止且身体漂浮记为不动)。于应激后7、14、21 d分别进行旷场测试和强迫游泳实验。
1.6 Golgi染色 行为学测试完成后,麻醉大鼠,剥离海马,部分固定于4%多聚甲醛中用于病理组织观察,另一部分速冻于液氮中用于分子生物学指标检测。取固定于4%多聚甲醛溶液中的海马组织,用梯度浓度乙醇脱水后,将组织切成小块,置于硝酸银水溶液中完全浸泡镀银,在充分镀银后,以50 μm连续切片,漂洗,梯度乙醇脱水,二甲苯透明,中性树胶封片,晾干后置于光学显微镜下观察神经元突触形态。
1.7 Western blot实验 取冷冻保存的海马组织,加入5倍体积的RIPA裂解液,冰上匀浆,4 ℃、12 000 r/min离心15 min,取上清液测定总蛋白含量。制备分离胶和浓缩胶,待胶凝固后上样,经SDS-PAGE凝胶电泳完成后,转移蛋白至PVDF膜上,室温下封闭1 h,根据目的蛋白分子量裁剪条带,加入稀释后的一抗(SYN:1:1 000,PSD-95:1:1 000,CREB:1:1 000,BDNF:1:1 000,GAPDH:1:500),4 ℃孵育过夜。TBST洗涤4次,每次10 min,加入二抗(按1:2 000稀释),室温下孵育4 h,洗涤,ECL显影。应用Image J软件分析各蛋白条带灰度值,以目的蛋白/GAPDH灰度值计算蛋白相对表达水平。
1.8 统计学处理方法 采用SPSS21.0软件进行数据分析,计量数据用表示,多组比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠旷场测试结果 与对照组比,模型组大鼠从应激第14 天开始自主活动评分显著下降(P<0.05),至造模结束后下降更为明显(P<0.01);经电针治疗后,大鼠自主活动评分和氟西汀组一样较模型组显著上升(P<0.05),与氟西汀组比较差异无统计学意义(P>0.05)。见表1。
2.2 各组大鼠强迫游泳实验结果 与对照组比,模型组大鼠于应激第7天起不动时间即显著增加(P<0.05);经电针治疗14 d后,大鼠不动时间明显下降(P<0.05),在治疗21 d后,不动时间下降更为明显(P<0.01)。见表2。
2.3 各组大鼠海马Golgi染色结果 正常大鼠海马神经元丰富,树突棘分枝较长,分布均一,排列整齐致密;模型组大鼠海马神经元排列散乱,树突棘萎缩,分枝变短,稀疏无规则,突触损伤明显;经电针和氟西汀治疗后,模型大鼠神经元突触损伤情况得以缓解,表现为神经元数量增加,树突密度及长短逐渐恢复,排列整体有序。见图1。
表1 各组大鼠旷场自主活动评分比较(每组n=12,±s)
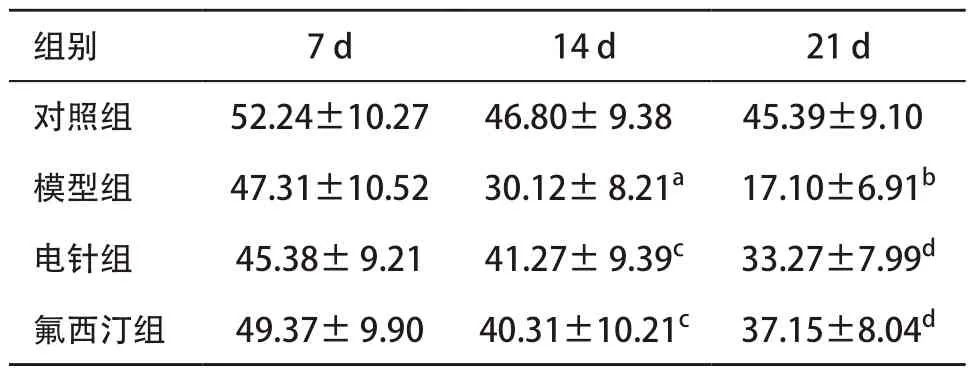
表1 各组大鼠旷场自主活动评分比较(每组n=12,±s)
与对照组比:aP <0.05,bP <0.01;与模型组比:cP <0.05,dP <0.01
表2 各组大鼠强迫游泳不动时间比较(每组n=12,±s,s)
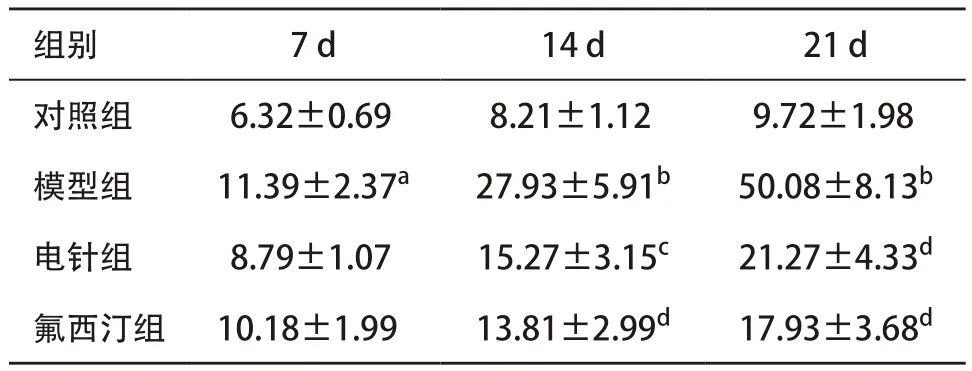
表2 各组大鼠强迫游泳不动时间比较(每组n=12,±s,s)
与对照组比:aP <0.05,bP <0.01;与模型组比:cP <0.05,dP <0.01
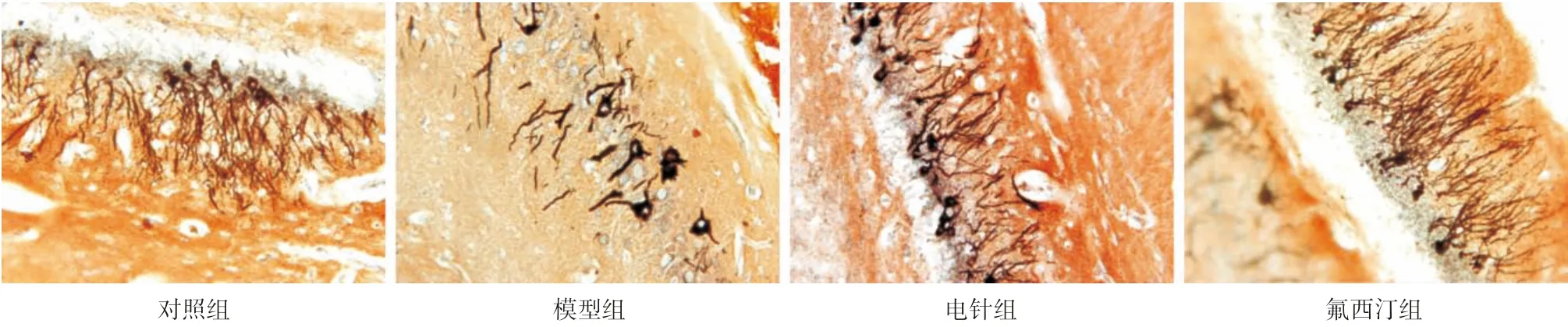
图1 各组大鼠海马神经元突触结构变化(×200)
2.4 各组大鼠海马突触可塑性蛋白表达情况 与对照组比,模型组大鼠海马突触可塑性相关蛋白SYN、PSD-95、CREB、BDNF表达均明显下调(P<0.01);经电针治疗或氟西汀干预后,上述突触可塑性蛋白的低表达情况均得到明显逆转(P<0.01)。见图2和表3。
3 讨论
应激与抑郁症的发生密切相关,慢性、长期、强度不一的应激源是导致抑郁产生并加速其发展的重要原因[5]。CUMS很好地拟合了人类抑郁症的致病源,是国内外通用的抑郁动物模型。临床抑郁患者常伴有快感缺失、不爱运动、精神萎靡、悲观绝望等特征,依据此类特征已形成一系列公认的抑郁动物模型的行为评估方法。在本研究中,21 d慢性应激后,大鼠旷场自主活动评分显著下降,同时强迫游泳不动时间显著增加,表现出明显的不爱活动、行为绝望等抑郁样行为。经电针或氟西汀治疗后,大鼠的抑郁行为明显减缓,体现了电针良好的抗抑郁疗效。

图2 各组大鼠海马突触可塑性蛋白电泳结果图
表3 各组大鼠突触可塑性蛋白相对表达量(每组n=6,±s)

表3 各组大鼠突触可塑性蛋白相对表达量(每组n=6,±s)
与对照组比:aP <0.01;与模型组比:bP <0.01
突触是神经元间信息传递的基础,神经元通过突触互相联系,从而形成一个复杂的大脑信息处理网络[6]。研究发现,抑郁症等神经精神类疾病均伴随着明显的突触病理改变,包括结构改变和功能改变[7]。突触结构改变通常为神经元突触的形态、密度异常,具体表现出树突棘变短变细,数量稀疏,排列散乱。突触功能改变以突触可塑性下降为主要特征,包括调控可塑性的相关蛋白的含量变化。SYN和PSD-95分别位于突触前、后膜,SYN是一种突触素,其相对表达量一定程度上能决定突触的数量和密度;PSD-95是突触后致密区核心构架蛋白之一,参与神经元生长、突起形成和突触可塑性调节等[8-9]。SYN和PSD-95的表达水平对于中枢神经系统内神经元间的正常信号传递起着关键调节作用[10]。CREB是一种反应元件结合蛋白,其mRNA表达水平能决定突触可塑性的功能强弱,在学习记忆中起着“开关”作用[11]。CREB能调控BDNF表达,给予突触形成过程中所必需的神经营养,促进神经元存活、增殖及损伤后修复再生等[12-13]。
本研究发现,模型组大鼠海马神经元排列散乱,树突棘萎缩,分枝变短,稀疏无规则,突触结构损伤明显,同时突触可塑性相关蛋白SYN、PSD-95、CREB、BDNF表达量均显著降低,突触可塑性功能障碍;经21 d电针治疗后,突触可塑性蛋白表达上调,突触损伤得以改善,这可能是电针治疗抑郁症的关键作用机制。
