激光剥蚀-电感耦合等离子体质谱定量分析单细胞中的银纳米颗粒
2019-10-09付东旭郑令娜刘金辉汪冰竺云王萌丰伟悦
付东旭 郑令娜 刘金辉 汪冰 竺云 王萌 丰伟悦
摘 要 :采用激光剥蚀电感耦合等离子体质谱技术(Laser ablationinductively coupled plasmamass spectrometry, LAICPMS), 建立了定量分析单细胞中银纳米颗粒(AgNP)的方法。利用喷墨打印机制备出与细胞基体相似的皮升级液滴, 作为单细胞定量标准, 再利用LAICPMS定量分析暴露AgNP的小鼠巨噬细胞。结果表明, 95个单细胞中AgNP含量为19.1~1682 fg, 呈对数正态分布, 平均值为(166±188) fg, 与酸消解分析得到的细胞群体AgNP平均含量((175±2) fg)相符。LAICPMS在单细胞分析方面具有巨大潜力, 有望进一步应用于单细胞水平的金属纳米颗粒的生物效应和安全性研究。
关键词 :银纳米颗粒; 激光剥蚀电感耦合等离子体质谱; 单细胞分析; 定量分析
1 引 言
银纳米颗粒(AgNP)由于其独特的抗菌性能, 被广泛应用于生物医学研究和工业产品[1], 但是其在生物系统中的吸收、转运、生物效应和毒理风险仍亟需深入研究[2]。细胞是生命的基本单元, 定量检测细胞中的AgNP对于研究其生物效应及安全性具有重要意义。
细胞中金属纳米颗粒的传统分析方法是消解大量细胞, 然后用原子光谱技术(如原子吸收光谱[3]和电感耦合等离子体发射光谱[4])检测。但是, 这类方法只能提供细胞群体的平均值, 不能获得细胞准确的个体信息。单细胞分析可以获得准确的个体信息, 更好地了解和阐述细胞的多样性和异质性。目前用于测定单细胞中纳米颗粒的方法主要有荧光显微镜[5]、电子显微镜[6]\, 流式细胞仪[7]等。 上述方法有的要求分析对象具有荧光信号, 有的分析通量较低, 在分析单细胞中金属纳米颗粒时往往受到限制。
近年来, 电感耦合等离子体质谱(ICPMS)開始应用于单细胞分析[8~10]和单颗粒分析[1,12]。Tsang等[9]分析了单个幽门螺杆菌中的金属铋, 为研究铋类药物提供了新途径; Zheng等[0]在单细胞水平上研究了量子点的吸收过程。但是, 上述应用只局限于分析悬浮液中的单细胞, 而不能对细胞进行原位分析。与上述基于溶液的单细胞分析不同, 激光剥蚀电感耦合等离子体质谱(Laser ablationinductively coupled plasmamass spectrometry, LAICPMS)具有微米级空间分辨率, 利用激光剥蚀固体样品, 将产生的气溶胶引入ICPMS完成检测, 因此可以实现快速的原位、微区分析[1,12]。文献中已有LAICPMS用于单细胞分析的报道[3~17], 但在实际分析时, 由于缺少基体匹配的定量标准, 常常难以实现准确的定量分析。为了解决这个问题, van Malderen等[6]用微加工技术制备了明胶基体的单细胞标准, 定量分析了单细胞中的Cu, 得到了单细胞中铜的分布图; Wang等[7]利用喷墨打印机技术制备了单细胞标准, 定量分析了单细胞中金纳米颗粒(AuNP)。
喷墨打印机可以在基底上精确打印皮升量级的小液滴, 其体积与细胞大小相近。 本研究利用喷墨打印机制备得到的小液滴作为单细胞的定量标准, 结合LAICPMS, 实现了对单细胞中AgNP的定量分析。
2 实验部分
2.1 仪器与试剂
Perkin Elmer NexION 300D电感耦合等离子体质谱仪(美国Perkin Elmer公司); 配有双体样品池的New Wave NWR 213激光剥蚀系统(美国ESL公司); MicroFab Jetlab Ⅱ喷墨打印机(美国MicroFab Technologies公司); Binder C150细胞培养箱(德国Binder公司); MilliQ超纯水系统(美国Millipore公司); Sartorius BS210S电子天平(德国Sartorius公司)。
银纳米颗粒(AgNP, 20 nm, 100 mg/L , 南京纳米东方生物技术有限公司); 银标准溶液(1000 mg/L, 中国计量科学研究院); AgNO3(优级纯, 阿法埃莎公司); 胎牛血清、DMEM/F12培养基、胰酶消化液(0.25%, TrypsinEDTA) (赛默飞世尔科技有限公司); HNO3、HCl和H2O2(优级纯, 北京化学试剂公司)。磷酸盐缓冲液(PBS, 碧云天生物技术研究所); 实验用水为超纯水(MilliQ超纯水系统制备)。


3 结果与讨论
3.1 基体匹配的单细胞标准
本研究采用MicroFab JetLab II喷墨打印机制备基体匹配的Ag标准液滴点阵, 液滴的体积由喷墨打印机所用的喷头口径和压电晶体电压决定, 在优化实验条件下, 打印出液滴的质量偏差约为1%[8]。图1是打印在载玻片上5 μg/g Ag液滴点阵的明场照片, 每个液滴直径为(35 ±3) μm。由于液滴的直径受到基底的表面性质、打印环境等因素的影响, 因此图中液滴直径的偏差大于液滴实际的质量偏差。通过ICPMS分析106个液滴的Ag含量, 计算出每个液滴中Ag的平均质量为21 ng。

LAICPMS测量时, 元素的信号强度与样品基体的化学组成和物理性质等因素有关, 因此, 定量标准与待测样品的基体要尽量相似[9]。本研究中的Ag标准液滴中含有2%罗丹明B, 含C量与单个细胞相近[7]; 银标准液滴和单细胞样品都置于玻璃片上, 干燥后用激光剥蚀, 因此得到气溶胶基体元素主要为C和Si(来自玻璃), 标准和样品的基体相似。
3.2 LAICPMS定量分析单细胞中的AgNP
将制备得到的Ag标准液滴作为LAICPMS单细胞分析的定量标准, 激光的光斑大小为40 μm, 激光的能量为6.0 J/cm2, 以确保每个标准液滴或单细胞被完全剥蚀。图2显示了LAICPMS分析载玻片上不同浓度的Ag标准液滴, 可以看出Ag标准液滴的信号重复性很好, RSD≤8%, 标准曲线的线性相关系数R2=0.996, Ag元素的线性范围为5~1051 fg。玻片上的空白区域未检测到明显的Ag信号, 检出限和定量限分别按空白信号3倍和10倍的标准偏差计算, 分别为1.5 fg和4.7 fg Ag。

在对照组细胞未检测出Ag的信号, 因此细胞中Ag的信号来自于暴露的AgNP。本研究采用LAICPMS分析了95个细胞, 发现单细胞中AgNP含量差别很大, 呈对数正态分布(图4)。单细胞中Ag质量的范围为19.1~1682 fg, Ag平均质量为(166±188 )fg。同时用HNO3消解了7.1×106个细胞, 通过溶液ICPMS分析, 得到了细胞群体Ag质量的平均值为(175±2) fg, 两种定量分析结果基本一致, 证明了建立的LAICPMS单细胞分析方法的可靠性。
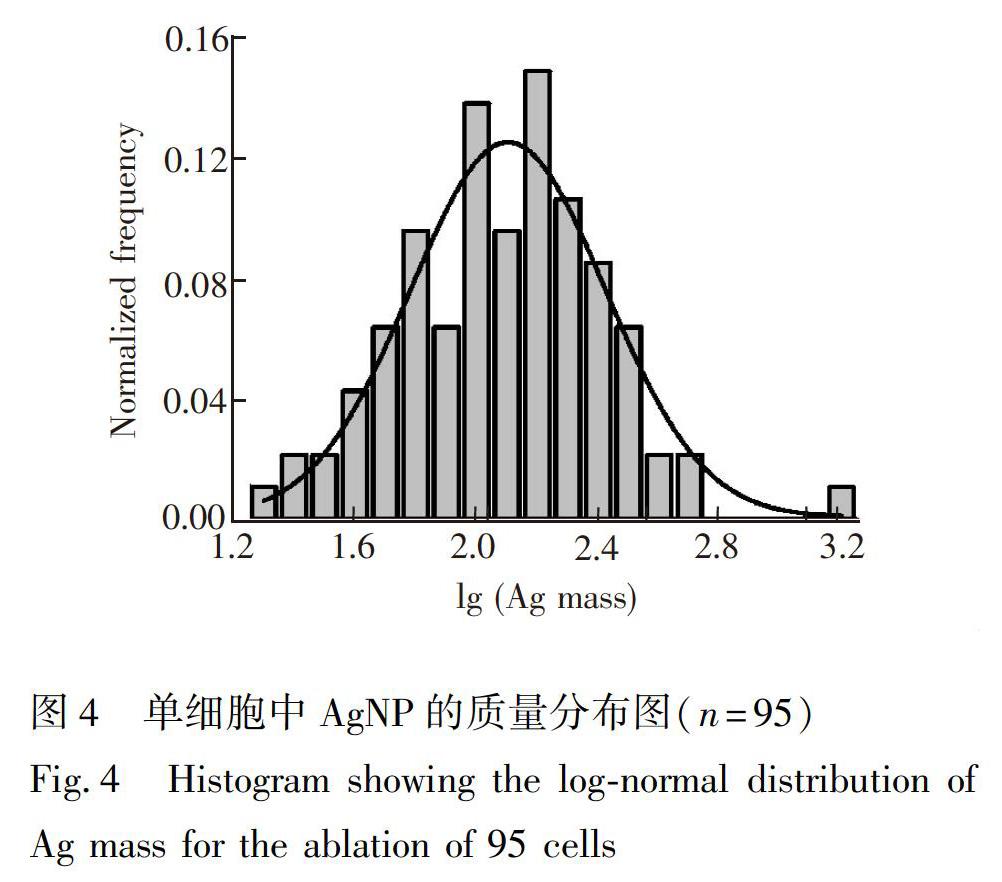
与传统的仅能得到细胞群体平均的方法不同, LAICPMS方法可以获得单个细胞的信息, 在单细胞水平上研究细胞的异质性。本研究结果表明, 即使同一种细胞在相同培养条件下暴露同一剂量的AgNP, 单细胞中的AgNP含量也可能具有1~2数量级的差别。
在文献中, 使用流式质谱仪[7]和X射线荧光[20]的方法, 定量分析单细胞中的金属纳米颗粒, 也得到了类似的结果。有很多原因可能造成单细胞中AgNP的差异: (1)由于基因的表达和蛋白的合成都是随机的, 细胞群中存在细胞异质性[21]; (2)细胞生长的微环境不同(例如单个细胞周围AgNP的团聚和沉积状态不同)会影响单细胞对AgNP的吞噬能力[22]; (3)细胞周期也是影响细胞吞噬纳米颗粒的关键因素[23]。目前基于LAICPMS的单细胞分析方法仍不成熟, 存在分析通量低、 不能区分单细胞中的纳米颗粒和溶解态离子等缺点。未来可以通过优化细胞制备过程(如将细胞排布成规整的阵列[24])、使用新一代LAICPMS系统(如ICPTOFMS[25])解决分析通量的问题。此外, 可以通过与其它能够提供形态信息的方法(如同步辐射X射线吸收谱)联用, 区分单细胞中的纳米颗粒和溶解离子。
4 结 论
本研究利用喷墨打印机制备得到与细胞基体近似的单细胞定量分析标准, 并使用LAICPMS实现了对单细胞中AgNP的绝对定量分析。实验结果表明, 在相同培养条件下小鼠巨噬細胞对AgNP具有不同的吞噬能力。单细胞中AgNP的准确定量分析, 有助于更好地理解细胞的异质性, 为在单细胞水平研究纳米颗粒的生物效应和安全性提供新的途径。与基于溶液的单细胞ICPMS分析方法相比, LAICPMS具有独特的优势, 可以实现单细胞的原位分析, 只需要少量细胞就可以完成分析; 此外, 通过制备合适的单细胞标准, LAICPMS可以实现单细胞内纳米颗粒的准确定量分析。
References
1 Le Ouay B, Stellacci F. Nano Today, 2015, 10(3): 339-354
2 Chen C Y, Li Y F, Qu Y, Chai Z F, Zhao Y L. Chem. Soc. Rev., 2013, 42(21): 8266-8303
3 Gliga A R, Skoglund S, Wallinder I O, Fadeel B, Karlsson H L. Part. Fibre Toxicol., 2014, 11: 11
4 Chithrani B D, Ghazani A A, Chan W C W. Nano Lett., 2006, 6(4): 662-668
5 Oomen P E, Aref M A, Kaya I, Phan N T N, Ewing A G. Anal. Chem, 2019, 91(1): 588-621
6 Haselgrübler T, Haider M, Ji B, Juhasz K, Sonnleitner A, Balogi Z, Hesse J. Anal. Bioanal. Chem., 2014, 406(14): 3279-3296
7 Yang Y S, Atukorale P U, Moynihan K D, Bekdemir A, Rakhra K, Tang L, Stellacci F, Irvine D J. Nat. Commun., 2017, 8: 14069
8 Mueller L, Traub H, Jakubowski N, Drescher D, Baranov V I, Kneipp J. Anal. Bioanal. Chem., 2014, 406(27): 6963-6977
9 Tsang C N, Ho K S, Sun H Z, Chan W T. J. Am. Chem. Soc., 2011, 133(19): 7355-7357
10 Zheng L N, Wang M, Wang B, Chen H Q, Ouyang H, Zhao Y L, Chai Z F, Feng W Y. Talanta, 2013, 116: 782-787
11 LUO RuiPing, ZHENG LingNa, LI Liang, WANG Juan, FENG WeiYue, YU XiangHua, WANG Meng. Chinese J. Anal. Chem., 2018, 46(6): 925-930
羅瑞平, 郑令娜, 李 亮, 王 娟, 丰伟悦, 喻湘华, 王 萌. 分析化学, 2018, 46(6): 925930
12 WANG Qi, ZHANG Wen, WANG LiYun, LIU YongSheng, HU ShengHong, HU ZhaoChu. Spectrosc. Spect. Anal., 2011, 31(12): 3379-3383
汪 奇, 张 文, 王立云, 刘勇胜, 胡圣虹, 胡兆初. 光谱学与光谱分析, 2011, 31(12): 3379-3383
13 YANG Yuan, LONG ChenLu, YANG ZhaoGuang, LI HaiPu, WANG Qiang. Chinese J. Anal. Chem., 2014, 42(11): 1553-1560
杨 远, 龙晨璐, 杨兆光, 李海普, 王 强. 分析化学, 2014, 42(11): 1553-1560
14 Pozebon D, Scheffler G L, DresslerV L, Nunes M A G. J. Anal. At. Spectrom., 2014, 29(12): 2204-2228
15 Drescher D, Giesen C, Traub H, Panne U, Kneipp J, Jakubowski N. Anal. Chem., 2012, 84(22): 9684-9688
16 van Malderen S J M, Vergucht E, Rijcke M D, Janssen C, Vincze L, Vanhaecke F. Anal. Chem., 2016, 88(11): 5783-5789
17 Wang M, Zheng L N, Wang B, Chen H Q, Zhao Y L, Chai Z F, Reid H J, Sharp B L, Feng W Y. Anal. Chem., 2014, 86(20): 10252-10256
18 Verkouteren R M, Verkouteren J R. Anal. Chem., 2009, 81(20): 8577-8584
19 MotelicaHeino M, Le Coustumer P, Donard O F X. J. Anal. At. Spectrom., 2001, 16(6): 542-550
20 Rashkow J T, Patel S C, Tappero R, Sitharaman B. J. R. Soc. Interface, 2014, 11(94): 20131152
21 Schmid A, Kortmann H, Dittrich P S, Blank L M. Curr. Opin. Biotech., 2010, 21(1): 12-20
22 Albanese A, Chan W C W. ACS Nano, 2011, 5(7): 5478-5489
23 Kim J A, berg C, Salvati A, Dawson K A. Nat. Nanotechnol., 2012, 7(1): 62-68
24 Zheng L N, Sang Y B, Luo R P, Wang B, Yi F T, Wang M, Feng W Y. J. Anal. At. Spectrom., 2019, 34(5): 915-921
25 Bauer O B, Hachmoller O, Borovinskaya O, Sperling M, Schurek H J, Ciarimboli G, Karst U. J. Anal. At. Spectrom., 2019, 34(4): 694-701
Abstract In recent years, single cell analysis has become one of hot topics in analytical chemistry. In this work, a method was developed for quantitative analysis of silver nanoparticles (AgNP) in single cells by laser ablationinductively coupled plasmamass spectrometry (LAICPMS). An inkjet printer was used to produce droplets of silver standards, which were similar to the matrixes of single cells. After exposed to AgNP, 95 single cells were quantitatively analyzed by LAICPMS using the droplet standards. The contents of AgNP in single cells showed a lognormal distribution, ranging from 19.1 fg to 1682 fg Ag per cell with an average of (166±188) fg Ag per cell, which was in good agreement with the average from cell population ((175±2) fg Ag per cell). LAICPMS had great potential in single cell analysis and provided a new tool for studying biological effects of metal nanoparticles at a single cell level.
Keywords Sliver nanoparticles; Laser ablationinductively coupled plasmamass spectrometry; Single cell analysis; Quantitative analysis
