一株耐锌细菌Sphingobacterium caeni S3的Zn2+吸附特征
2019-10-09沈宗泽韩晓刚
袁 梦,沈宗泽,封 磊,宋 萍,韩晓刚,游 凯,苏 丹,李 航
(1.福建农林大学资源与环境学院;2.福建农林大学林学院,福建福州350002)
锌(Zn)是生命体的一种必要微量元素,也是一种重金属.它虽然毒性小,但不易降解,可通过食物链在生物体内大量富集,这不仅会对环境造成一定的危害,还会威胁人类的健康和生存[1].我国是产锌大国,产量位居世界首位,随着锌产业的飞速发展,锌污染问题越来越严重.因此,解决锌的环境污染问题变得尤为重要.
微生物修复技术是利用一些具有重金属抗性或吸附性能的微生物的吸附、转化和沉淀作用,降低重金属的毒性,达到改善环境的目的[2].其中,微生物吸附法具有无二次污染、成本低、操作简单等优点,应用前景十分广阔.研究已证明一些微生物包括细菌、真菌和放线菌均可表现出一定的重金属吸附能力,且微生物菌体活性及胞外聚合物(extracellular polymeric substance,EPS)对其重金属吸附能力具有重要影响[3-5].例如:Tangaromsuk et al[6]发现鞘氨醇单胞菌(Sphingomonas paucimobilis)活菌体对Cd2+表现出很好的吸附性能;Gabr et al[7]研究发现,铜绿假单胞菌(Pseudomona aeruginosa)非活性菌体对Pb2+表现出更强的吸附能力;Martine et al[8]通过试验证明,异养菌的EPS对 Pb2+、Cu2+和 Cd2+均表现出较强的吸附能力;Yang et al[9]研究表明,克雷伯氏菌(Klebsiellasp.)的 EPS对 Cu2+的吸附能力明显强于对Zn2+的吸附能力;王亮等[10]发现去除菌体EPS后,白腐真菌对Pb2+的吸附能力明显减弱.
目前,有关微生物对重金属的吸附研究大多集中于Cd2+、Pb2+等方面,有关微生物对Zn2+吸附机理的研究较少.本研究以实验室前期筛选的一株具有Zn2+吸附能力的细菌S3为对象,测定其Zn2+吸附特征,并比较菌体活性及EPS对其吸附过程的影响,以期为进一步揭示微生物的重金属吸附机制和探究环境锌污染的微生物治理技术提供参考.
1 材料与方法
1.1 材料
供试菌株:耐锌微生物S3由本实验室保藏,筛选自锌污染土壤.
LB培养基:胰蛋白胨10 g·L-1,酵母提取粉5 g·L-1,NaCl 10 g·L-1;配制固体LB培养基需要另加入16 g·L-1琼脂粉.
含重金属培养基:将配制好的LB液体培养基和重金属溶液进行高温灭菌,再向已灭菌的LB液体培养基中加入一定量的重金属溶液.
1.2 菌株鉴定
菌落形态观察:将菌株纯化后,接种到固体LB培养基上,在30℃下培养48 h,观察菌落的颜色和形态.
16S rDNA基因序列分析:提取基因组,利用PCR扩增目的片段,经琼脂糖凝胶电泳,将PCR产物纯化,切胶回收目的片段交由大连宝生物公司进行DNA测序;然后把得到的碱基序列提交到GenBank数据库,运用Blast对其同源性进行比对;再利用软件MEGA 4.1和ClustalX建立系统发育树,从而确定菌株的种类.
1.3 Zn2+对菌株生长影响的测定
1.3.1 最小抑制浓度(minimum inhibitory concentration,MIC)测定 取 180 μL 含 Zn2+浓度分别为 100、200、300、400、500、600、700 mg·L-1的 LB 培养基加入到 96 孔细胞培养板中,并向每孔接种 20 μL 菌液(麦氏浊度1×107cfu·mL-1).在150 r·min-1、30℃条件下培养,36 h后测量在600 nm波长下的光密度(D)值.设置不含Zn2+的空白组,并以重金属抑制细菌生长的最低浓度为MIC[11].
1.3.2 Zn2+对菌株生长的影响 将菌株S3以1%的接种量分别接种到含Zn2+浓度为100、200、300和400 mg·L-1的100 mL LB液体培养基中,且培养基均放在规格为250 mL的三角瓶内,然后在150 r·min-1、30℃条件下培养.每隔6 h取培养液样品,测量其在600 nm波长下的D值.
1.3.3 菌株吸附Zn2+前后激光共聚焦观察 利用Leica TCS-SP2激光共聚焦显微镜,在波长为514 nm[12]的条件下观察菌株S3的形态.
1.4 菌体对Zn2+的吸附
1.4.1 菌体的收集 先取单菌落S3接种到盛有100 mL LB液体培养基的250 mL三角瓶中,将其作为种子液在150 r·min-1、30℃条件下培养18 h.再以1%的接种量将其接种到新鲜的盛有100 mL LB液体培养基的250 mL三角瓶中,培养到稳定期.取出培养液,在4℃、4500g条件下离心30 min,弃掉上清液保留菌体,再加入无菌水洗涤、离心,重复3次,最后得到湿菌体备用.
1.4.2 菌体的吸附试验 前期的试验表明,Zn2+浓度为100 mg·L-1时,S3菌体的吸附能力较好,所以后续试验的Zn2+浓度均为100 mg·L-1.向含100 mg·L-1Zn2+的100 mL LB液体培养基(盛于250 mL三角瓶内)中加入 0.1 g S3 湿菌体,在150 r·min-1、30 ℃条件下分别培养 10、20、40、60、80、120 min 取样,然后在同样条件下离心10 min,取其上清液测量Zn2+含量,并计算吸附率.每个处理做3组重复.
1.4.3 扫描电子显微镜(scanning electron microscope,SEM)分析 制备2.5%戊二醛溶液,分别加入吸附Zn2+前后的菌体,并置于4℃下保存固定.过夜后,先用PBS缓冲液洗涤菌体3次,再依次用乙醇和醋酸异戊酯脱水、置换,最后进行冷冻真空干燥、喷金[13],用SEM(日立5-520型)观察菌体表面特征并拍照.
1.4.4 傅里叶变换红外光谱仪(Fourier transforms infrared analysis,FTIR)分析 分别将吸附Zn2+前后的菌体进行冷冻真空干燥,然后将其置于研钵中,再加入适量溴化钾(KBr)完全研磨并混匀后制成薄片,通过Nicolet 6700 FTIR分析红外光谱.最后,根据红外光谱中特征吸收峰的变化,鉴定样品中的化合物和官能团[14].
1.4.5 菌体活性对吸附率的影响 非活性菌体的制备:将湿菌体在80℃下烘干至恒重,保留下来的菌体即为非活性菌体.
称取0.1 g非活性菌体加入到含100 mg·L-1Zn2+的100 mL LB液体培养基(盛于250 mL三角瓶)中.按 1.4.2 的方法测定 Zn2+含量,并计算吸附率.
1.5 菌体EPS对Zn2+的吸附
1.5.1 菌体EPS的提取 取出前期培养至稳定期的S3菌液,在4℃、4500g条件下离心10 min,弃掉上清液,再加入无菌水定容至5 mL后摇匀.在冰水浴条件下以40 W超声搅拌破碎3 min,然后在4℃、10000 r·min-1条件下离心10 min,并选用0.22 μm纤维素滤膜过滤上清液,最后得到的液体为EPS样品.
1.5.2 菌体EPS组成成分的测定 蛋白质含量的测定采用考马斯亮蓝法[15];多糖含量的测定采用苯酚—硫酸法[16].
1.5.3 菌体EPS的吸附试验 先取50 mL含50 mg·L-1Zn2+的溶液加入到烧杯中,再向预处理过的透析袋中加入20 mL浓度为100 mg·L-1的菌体EPS溶液,最后将透析袋夹好后放到烧杯内.按1.4.2的方法测定Zn2+含量,并计算吸附率.
1.6 吸附动力学分析
吸附动力学的研究范畴主要包括吸附速率和吸附机理,最常用的动力学模型为准一级动力学模型和准二级动力学模型.其中,准一级动力学模型是由Lagergren方程[17]推导而来,准二级动力学模型由McKay方程[18]推导而来.采用动力学模型拟合试验数据,进而对菌体及菌体EPS的吸附行为进行分析.
对上式两边进行积分,转换成直线方程:ln(qe-qt)=lnqe-k1t.
式中,qt和qe分别表示t时的吸附量和达到吸附平衡时的吸附量,k1是一级动力学方程常数.以ln(qe-qt)对时间t作图,可以计算出准一级动力学模型相关参数k1和qe.
式中,qt和qe分别表示t时的吸附量和达到吸附平衡时的吸附量,k2是准二级动力学方程常数.以对时间t作图,可以计算出准二级动力学模型相关参数k2和qe.
2 结果与分析
2.1 耐锌细菌的鉴定
由图1A可以看出,S3菌落为不透明的乳白色湿润菌体,呈圆凸状,边缘整齐,且易于挑起.将S3菌体置于光学显微镜下,可以看出S3呈杆状,且无鞭毛(图1B).
在GenBank上注册菌株S3的16S rDNA基因序列,其登录号为KX664480.利用Blast程序比较其序列相似性,得出菌株S3与Sphingobacterium caeni(登录号为NR-109661.1)相似性高达99%,表明二者基因序列的同源性为99%.由图2也可以看出,S3与S.caeni位于同一个分支,因此确定菌株S3属于鞘氨醇杆菌属(Sphingobacterium).

图1 S3菌株的形态特征Fig.1 Morphological characteristics of strain S3
2.2 Zn2+对菌株生长的影响
2.2.1 Zn2+对菌株 S3 生长的 MIC 由图3可知,Zn2+会对S3的生长产生一定影响,其光密度随着Zn2+浓度的增大而减小.当Zn2+浓度达到500 mg·L-1后,光密度的减小幅度逐渐趋于平缓,表明500 mg·L-1为Zn2+对 S3 的 MIC.根据 Mergeay et al[19]的分类,Zn2+对菌株的MIC值在65~650 mg·L-1之间为中度耐锌细菌,而MIC值超过650 mg·L-1则为抗锌细菌.因此,可以判定菌株S3为中度耐锌细菌,对Zn2+表现出较强的耐受性.

图3 Zn2+对S3的最小抑制浓度Fig.3 Minimum inhibitory concentration of Zn2+ to S3
2.2.2 Zn2+浓度对菌株生长的影响 由图4 可知,在含不同浓度Zn2+的LB培养基中,S3菌体的生长受到不同程度的抑制,并且其生长能力随Zn2+浓度的增大而逐渐减弱.高浓度的Zn2+能显著抑制菌体的生长,但生长并未停止,表明S3菌体对Zn2+具有较强耐受性.
2.2.3 S3吸附Zn2+前后激光共聚焦观察 由图5可以看出,未吸附Zn2+的S3菌体呈聚集状,个体形态模糊,且从中能够看到少量的菌体呈杆状.吸附Zn2+之后,菌体的密度下降,但大部分仍然聚集.这表明Zn2+对S3菌体产生了一定的毒性.
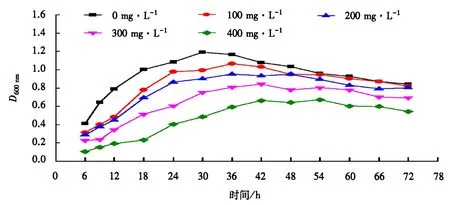
图4 Zn2+浓度对S3生长的影响Fig.4 Effects of Zn2+ concentrations on the growth of S3

图5 菌体S3吸附Zn2+前后激光共聚焦显微图Fig.5 Laser scanning confocal micrograph of S3 before and after Zn2+ adsorption
2.3 菌株的Zn2+吸附特征
2.3.1 菌株 S3对 Zn2+的吸附过程 由图6可知,菌株S3在120 min内对Zn2+的吸附过程主要分为3个阶段:前20 min为快速吸附,到20 min时吸附率达到50.4%;在20~60 min吸附率的上升速度减缓;80 min后达到吸附平衡,此时吸附率为54.1%.

图6 培养不同时间后菌株S3对Zn2+的吸附率Fig.6 Adsorption rates of Zn2+ by strain S3 cultured for different durations
2.3.2 菌体吸附Zn2+前后SEM分析 从图7可以看出,S3菌体呈杆状,这与鞘氨醇杆菌形态特征[20]一致.在吸附Zn2+之前,S3菌体的细胞个体形态较为饱满;而在吸附Zn2+之后,部分细胞呈现干瘪状,并且表面有晶体沉淀.这可能是由于菌体细胞在吸附Zn2+的过程中分泌代谢物,并与Zn2+形成沉淀物,这也增强了菌体自身对重金属离子的耐受性[21].
2.3.3 菌体吸附Zn2+前后FTIR分析 由图8可以看出,S3菌体在吸附Zn2+前后的光谱图变化不大.在波数为3292 cm-1处,缔合O-H或N-H吸收峰位移至3298 cm-1处,吸收峰强度减弱;在2923 cm-1处,-CH伸缩振动峰强度略微减弱,但没有发生位移;在2361 cm-1处,吸收峰强度减弱,可能与P-H振动有关;在1653 cm-1处,酰胺Ⅰ带吸收峰强度(C=O的伸缩振动)减弱,但并未出现显著的位移;在1057 cm-1处,C-O伸缩振动峰强度略微减弱,且位移至1070 cm-1处.因此,参与S3菌体Zn2+吸附过程的官能团主要有缔合O-H、N-H和多糖的C-O.

图7 菌体S3吸附Zn2+前后的SEM图Fig.7 Scanning electron micrograph of S3 before and after Zn2+ adsorption

图8 菌体S3吸附Zn2+前后的FTIR图Fig.8 FTIR spectrogram of S3 before and after Zn2+adsorption
2.3.4 菌体活性对吸附率的影响 由图9可以看出,在120 min内,S3非活性菌体的Zn2+吸附能力弱于活性菌体.非活性菌体达到吸附平衡的时间在60 min左右,而活性菌体则在80 min左右才实现吸附平衡.其原因可能是活性菌体的前期吸附过程有2个阶段,第一阶段是发生在细胞表面的快速吸附,第二阶段是发生在细胞内的缓慢吸附;而非活性菌体前期仅有细胞表面吸附阶段.

图9 培养不同时间后菌株S3的活性菌体和非活性菌体对Zn2+的吸附率Fig.9 Adsorption rates of Zn2+ by active and inactive bacteria of strain S3 cultured for different durations
2.4 菌体EPS的Zn2+吸附特征
2.4.1 EPS的组成 S3菌体EPS中蛋白质含量(58.140 mg·L-1)明显低于多糖含量(88.730 mg·L-1).该结果与李久义等[22]得到的结论一致.
2.4.2 EPS对Zn2+的吸附过程 由图10可知,菌体EPS在120 min内对Zn2+的吸附过程主要分为3个阶段,与S3菌株对Zn2+的吸附过程一致.第一阶段为快速吸附,到20 min时吸附率为29.2%;第二阶段(20~60 min)吸附率的上升速度减缓;第三阶段(80 min后)实现吸附平衡,此时吸附率为32.4%.因此,S3菌体EPS对Zn2+的吸附主要集中在第一阶段.吸附率发生变化的原因:菌体EPS在前20 min内有足够的Zn2+吸附位点,吸附率迅速增大;吸附位点在20~60 min逐渐减少,吸附率变化减慢;到80 min后,菌体EPS上的吸附位点饱和,实现吸附平衡[23].

图10 培养不同时间后菌株S3 EPS对Zn2+的吸附率Fig.10 Adsorption rates of Zn2+ by strain S3 EPS cultured for different durations
2.5 吸附动力学模型
将S3活性菌体和非活性菌体的Zn2+吸附过程拟合准一级动力学方程,其线性相关系数(R2)分别为0.952和0.872,平衡吸附量分别为12.950和3.210 mg·g-1,与实际数据有很大差异;但将其拟合准二级动力学方程,R2分别为0.997和0.999,且算出的平衡吸附量与实际数据差距较小(表1).菌体EPS也具有同样的拟合效果.因此,S3菌体及其EPS的Zn2+吸附过程更适合用准二级动力学方程进行描述.

表1 动力学模型拟合的相关参数Table 1 Relevant parameters fitted by dynamic models
3 结论
(1)选取实验室前期筛选的一株对Zn2+具有一定抗性的菌株S3,利用分子生物学手段,初步鉴定菌株S3为鞘氨醇杆菌属.菌株S3对不同浓度的Zn2+表现出不同程度的耐受性,Zn2+对S3菌体的MIC为500 mg·L-1,为中度耐锌细菌.
(2)菌株S3对Zn2+具有一定的富集能力,且菌体对Zn2+的吸附率随着Zn2+浓度的增大而逐渐减小.在120 min内菌株S3非活性菌体的Zn2+吸附能力弱于其活性菌体,并且非活性菌体可以在较短时间内达到吸附平衡.潘建华等[24]在研究蜡状芽孢杆菌(Bacillus cereus)对Pb2+的吸附过程中也得到了类似的结果.
(3)参与S3菌体Zn2+吸附过程的官能团主要有缔合O-H、N-H和多糖的C-O;S3菌体EPS中的蛋白质含量低于多糖含量.Zhang et al[25]在研究硫酸盐还原菌(sulfate-reducing bacteria)EPS对Cd2+的吸附过程中,发现EPS上多糖中的官能团起主要吸附作用;许旭萍等[26]发现球衣菌(Sphaerotilus natans)FQ32能够吸附Hg2+,其原因也是菌体细胞表面有能够与Hg2+发生络合的活性基团.
(4)对试验数据进行动力学分析,发现S3菌体及其EPS对Zn2+的吸附过程更适合用准二级动力学模型进行描述,说明该过程主要为化学吸附过程.
