黄瓜白粉病的PMA-qPCR方法建立及应用
2019-10-09李金婷张佐然梁雅静孔维文李云龙何晓青
李金婷,张佐然,梁雅静,孔维文,李云龙,何晓青
(1.北京林业大学生物科学与技术学院,北京100083;2.北京市植物保护站,北京100029)
黄瓜白粉病俗称“白毛病”[1],叶片为主要的发病部位,发病时叶片呈现大片白粉区,后期逐渐变黄变脆.其病原菌为单囊壳白粉病菌(Podosphaera xanthii),喜于适宜的温度及高湿度环境下生长,因此,黄瓜白粉病常见于大棚及温室环境中,北方尤为常见[2].感染黄瓜白粉病的叶片较脆弱,光合作用下降,严重时会导致植株枯死,对黄瓜产量有巨大的影响.该病的特点是传播速度快、受灾区域广,给全国黄瓜种植业带来了很大的安全隐患[3].国内外对于黄瓜白粉菌的研究多集中在其形态鉴定和化学防治方面[4-5],较少涉及分子方面的检测.因此,建立一种高度敏感、可定量检测病原体的方法,对黄瓜白粉病的控制十分重要.
叠氮溴化丙锭(propidium monoazide,PMA)是一类在强光照射下与核酸高度亲和的染料.PMA染料可以穿过死细胞不完整的细胞膜与DNA共价连接阻止死细胞DNA的扩增[6-7],从而达到检测活性细胞的目的.实时荧光定量PCR(quantitative real-time PCR,qPCR)是一种基于聚合酶链式反应(polymerase chain reaction,PCR)的生物学技术.在PCR过程中可添加与双链DNA结合的非特异性染料或特异性探针,对目标DNA扩增过程进行实时监测,通过将PCR产物连接到载体上建立已知拷贝数的标准曲线,进而计算目标DNA的起始量.因此,qPCR经常被用于目标物质的定量检测.研究发现,细胞在死亡时仍能保持DNA活性不受影响,而传统的qPCR只可以定量到病原体总数,无法区分病原体是否有活性[8-9].PMA-qPCR技术能够判断细胞膜是否完整,根据其完整性辨别活菌和死菌.其原理是当细胞膜受损时,细胞DNA能够与进入细胞膜的PMA相结合,从而阻止DNA的复制,qPCR扩增也因此被阻断.当强光照射时,DNA与PMA的结合因形成叠氮集团而变得更加紧密,并且强光能消除未与PMA成功结合的DNA[10].
目前,PMA-qPCR技术已被广泛应用于植物、食品等的研究:针对黄瓜、番茄等植物的病原菌(如青枯病菌、番茄病溃疡病菌、细菌性斑点病菌等)已建立了具体的检测方法[11-14];同时,利用此方法可对乳制品、肉类等的活菌数进行定量检测[15].但尚未见该方法用于瓜类白粉病菌的研究.本研究拟通过PMA-qPCR方法鉴定黄瓜白粉病病原菌,并检测患病叶片中的活性致病菌和臭氧处理后的活菌比例,以期为黄瓜白粉病的预防与控制提供技术支持.
1 材料与方法
1.1 材料
1.1.1 样品 患白粉病黄瓜叶片采自北京市房山区;黄瓜细菌性角斑病致病菌(Pseudomonas syringaepv.lachrymans)、黄瓜细菌性缘叶枯病菌(Pseudomonas marginalis和P.viridiflava)均由北京植物保护站提供;大肠杆菌(Escherichia coli)和金黄色葡萄球菌(Staphylococcus aureus)购自国家微生物菌种保藏中心.
1.1.2 主要仪器及试剂 2×Super HiFi PCR Mix、高纯质粒大提试剂盒、pGM-Simple-T Fast连接试剂盒、细菌基因组提取试剂盒、植物基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒、TRIZOL试剂和Super-Real PreMix Plus均购自天根生化科技(北京)有限公司;电泳仪和凝胶成像仪购自美国伯乐公司;MX3005P qPCR仪购自美国爱捷伦科技公司;50×TAE Buffer、Goldview购自北京拜尔迪生物技术公司;100 bp PlusⅡDNA Ladder购自全式金(TransGen)公司;Qubit核酸/蛋白定量仪购自美国英杰生命有限公司;H2O3程控金属浴购自金银杏生物科技(北京)有限公司.PMA染料购自美国Biotium公司;其他常规试剂、耗材购自北京易秀博谷生物科技有限公司.
1.2 方法
1.2.1 患病叶片表面黄瓜白粉菌ITS序列扩增 用Primer Premier 5软件根据GenBank上黄瓜白粉菌(AB026144)的 rDNA-ITS保守区设计引物 PxA-f、PxA-r,序列见表1.轻轻刮取患黄瓜白粉病的叶片表层得到病菌孢子及菌丝,提取基因组,以得到的基因组为模板进行PCR扩增.PCR反应体系:模板2 μL,2×Super HiFi PCR Mix 25 μL,上、下游引物各 1 μL,补足 ddH2O 至 50 μL.反应程序:94 ℃ 3 min;98 ℃ 10 s,60 ℃ 30 s,68 ℃ 30 s,共35 个循环;68 ℃ 5 min.回收、保存扩增得到的PCR产物并进行测序(北京睿博兴科生物技术有限公司).
1.2.2 qPCR特异性引物设计和验证 根据引物PxA-f、PxA-r获得的序列,利用Primer Premier 5设计引物,得到一对扩增长度为93 bp的引物PxB-f、PxB-r,序列见表1.为验证引物特异性,以黄瓜白粉病致病菌基因组为模板,常见的黄瓜致病菌(黄瓜细菌性角斑病致病菌、黄瓜细菌性缘叶枯病菌)以及模式菌株大肠杆菌和金黄色葡萄球菌基因组为对照进行qPCR检测.qPCR体系:SuperReal PreMix Plus 12.5 μL,上、下游引物各 0.4 μL,模板 2 μL,加水补足至 25 μL.扩增程序:95 ℃ 10 min;95 ℃ 1 min,60 ℃ 30 s,72 ℃1 min,共40个循环.

表1 引物序列Table 1 Primer sequence
1.2.3 qPCR标准品的构建 将引物PxA-f、PxA-r扩增得到的片段与pGM-Simple-T载体连接,转化到DH5α感受态细胞中,涂布于含氨苄青霉素的LB抗性平板上,挑取白色菌落接种于氨苄青霉素终浓度为80 μg·mL-1的LB液体培养基中,37℃震荡培养过夜,提取质粒进行测序鉴定,将其作为qPCR的标准品.
1.2.4 qPCR标准曲线的建立 用Qubit核酸定量仪测定质粒浓度,将其换算得到质粒拷贝数.换算公式为N=NA×c/l×660,其中,N为质粒拷贝数,NA为阿伏伽德罗常数6.02×1023,c为质粒浓度,l为质粒长度,660为一个碱基的相对分子质量[14].在确定拷贝数之后,将质粒按5×10~5×106个·μL-1稀释为6个梯度,在MX3005P qPCR仪上进行PCR扩增和荧光定量检测.反应体系参考1.2.2,反应结束后获得标准曲线和熔解曲线.
1.2.5 黄瓜叶片白粉病致病菌检测 (1)PMA预处理和DNA提取.按照李聪聪等[10]的方法制备PMA工作液:取8 mg PMA染料溶解于20%二甲基亚砜(dimethyl sulfoxide,DMSO)配制成1 μg·μL-1储备液,-20℃保存.取患病叶片不同部位(全组织、表面、内部)经臭氧处理不同时间(0、20、30、40、50 min),液氮研磨后分别称取两管100 mg的粉末,一管直接提取基因组(总菌数),另一管经PMA处理后再提取基因组(活菌数).向管内加入1 mL PBS,震荡15 s以上用铝箔纸包裹EP管管盖以下的部分以避光,再向管中加入20 μL PMA工作液,使其终浓度为20 μg·mL-1.随后将离心管置于转速为150 r·min-1的恒温摇床中5 min,然后将离心管置于低温条件下,使用氯素灯对其照射10 min,照射期间每隔20 s转动一次离心管,以达到均匀照射的目的[16].最后将离心管放入低温离心机中(转速为10000 r·min-1)离心10 min,离心结束后去除上清液,根据DNA提取试剂盒说明书提取DNA.
提取基因组后用Nanodrop测每管基因组的D260nm值,将同一臭氧处理时间的PMA处理组和对照组的基因组浓度调至相同(基因组提取时不同个体会有误差,且提取到的植物基因组相对于病原基因组可忽略不计,所以最大限度降低两管的误差,可以提高活菌含量计算的准确性).
(2)样品DNA的qPCR检测.以不同处理DNA为模板,使用MX3005P qPCR仪进行qPCR检测,每个处理设3次平行试验.反应体系参照1.2.2,将测得的循环数(Ct值)代入标准曲线获得黄瓜白粉菌的拷贝数.
2 结果与分析
2.1 黄瓜白粉菌ITS序列扩增结果
ITS序列扩增结果显示产物长度为432 bp.通过GenBank比对发现产物序列与单囊壳白粉病菌的同源性为100%,说明待检测黄瓜叶片表面的病菌为单囊壳白粉病菌.
2.2 qPCR标准曲线的建立
用插入质粒的PxA-f、PxA-r引物扩增ITS序列,与预期片段序列进行比对,可知两段序列具有100%的同源性.6个梯度的稀释标准品经qPCR扩增后自动生成熔解曲线、阈值和基线.以质粒起始模板拷贝数为横坐标(X),不同拷贝数对应的Ct值为纵坐标(Y),绘制黄瓜白粉菌基因检测的标准曲线,得出模板数量与 Ct值之间的线性关系:Y=-3.294×logX+38.04,相关系数(R2)为 0.994,扩增效率(Eff.)为 101.2%(图1).通过此公式可计算待测样本的初始拷贝数.另外,熔解曲线具有单一峰值(图2),DNA熔解温度(Tm值)为81.0℃,无引物二聚体和非特异扩增的出现,证明引物特异性良好.
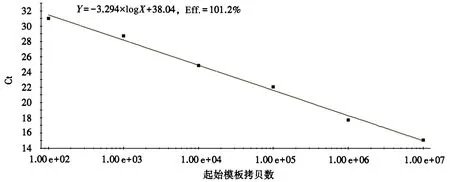
图1 黄瓜白粉菌基因的标准曲线Fig.1 Standard curve of cucumber powdery mildew pathogen gene
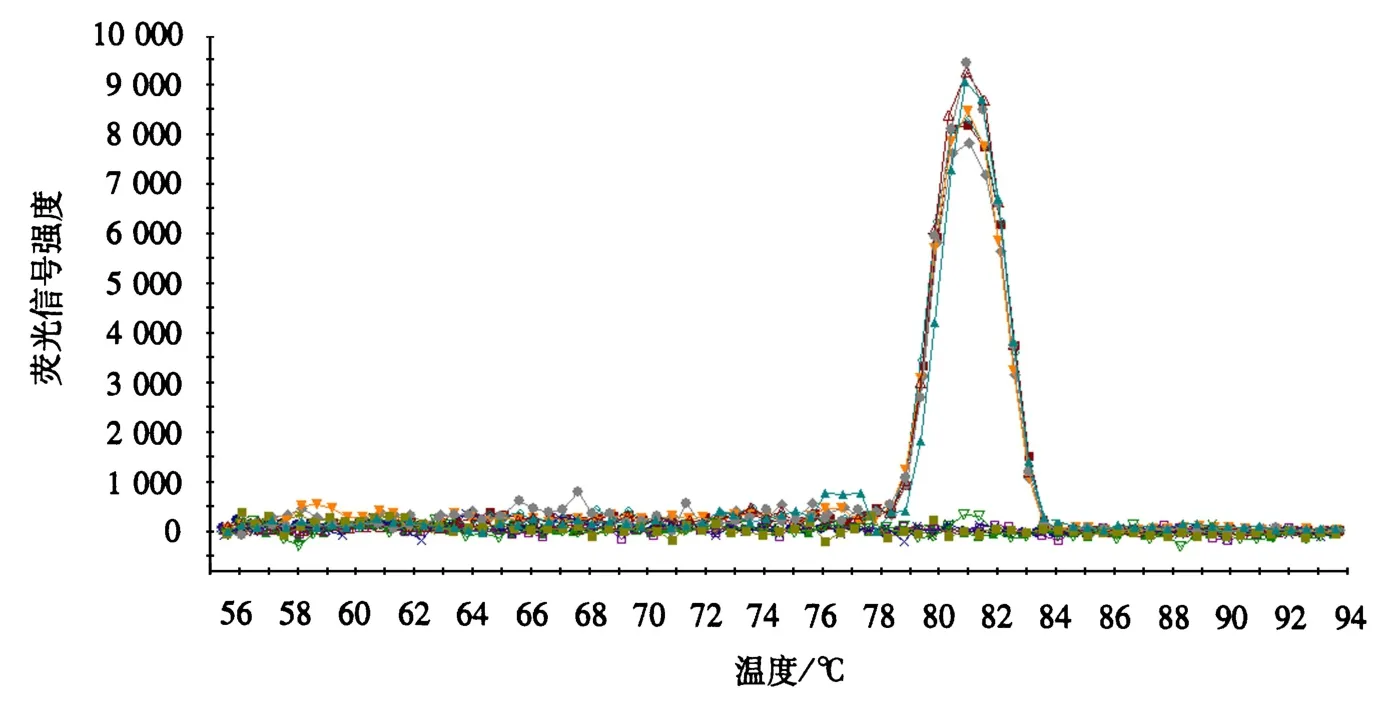
图2 黄瓜白粉菌基因的熔解曲线Fig.2 Dissociation curve of cucumber powdery mildew pathogen gene
2.3 qPCR特异性检验
通过qPCR对不同的黄瓜病原菌和2种模式细菌进行定量.结果显示,仅黄瓜白粉病致病菌有扩增,Ct值为18.42;其余黄瓜病原菌以及大肠杆菌和金黄色葡萄球菌均无Ct,证明PxB引物可以区分白粉菌和其他黄瓜病原菌,能够用于后续PMA-qPCR方法的建立.
2.4 qPCR重复性检验
选择5×102、5×104、5×1063个梯度的质粒进行组间和组内的重复试验,以确定qPCR过程中标准曲线的准确性.结果(表 2)显示,组内变异系数为 0.17%~0.90%,组间变异系数为 0.45%~1.05%,表明 qPCR的重复性良好,可用于后续试验.

表2 标准质粒的组内和组间变异系数Table 2 Variation coefficient of intra-assay and inter-assay for standard plasmid
2.5 不同处理的拷贝数差异
qPCR测得,经PMA预处理的样品(臭氧处理30 min的叶片全组织)Ct值为28.74,对照组Ct值为14.74(图3);将 Ct值代入标准曲线得到两者的拷贝数分别为4.335×102和9.448×106个·μL-1.
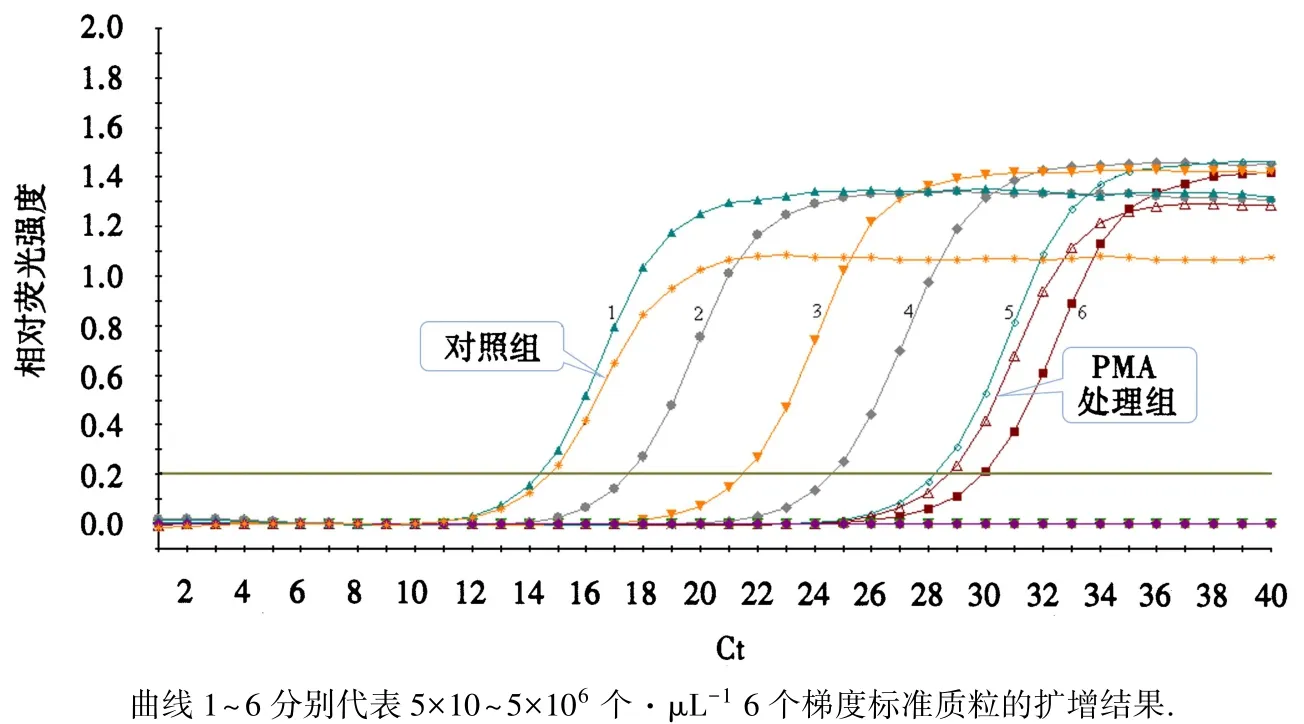
图3 不同处理样品扩增结果和质粒的标准扩增曲线Fig.3 Amplification results and standard curves of plasmid under different treatments
2.6 PMA-qPCR检验臭氧处理后的活菌比例
臭氧处理后,黄瓜叶片全组织、叶片表面、叶片内部病原菌活菌比例随着处理时间的延长均呈减少趋势.但叶片全组织活菌比例在20~40 min下降幅度不显著,50 min时活菌比例为17.1%;叶片表面在50 min时活菌比例为15.6%;叶片内部活菌的减少趋势不如叶片表面明显,20~40 min活菌比例为52.6%~56.8%,50 min时活菌比例为38.6%(表3).本研究中,在不同臭氧处理时间下,经PMA处理后的样品相对于未经PMA处理的样品,检测到的活菌比例均有明显下降,说明该方法可以用于黄瓜白粉病活菌的检测.

表3 不同处理部位在各臭氧处理时间点的总菌数、活菌数及其比例Table 3 Total bacterial count,viable count and percentage of different parts of leaves sterilized for different durations
3 讨论
qPCR技术作为一种快速高效的诊断方法,目前已经广泛用于各种病原菌的检测,qPCR的主要方法包括SYBR GreenⅠ荧光染料法和Taqman探针法[17].前者能与所有双链DNA的小沟结合激发出绿色荧光,对DNA模板不具有选择性,对引物的特异性要求高,需要防止非特异性扩增等现象的发生;后者主要是利用Taq酶的5′核酸外切酶活性,探针只与模板结合,因而具有选择性,但其合成探针的费用较高,且操作较为复杂.本研究根据黄瓜白粉病病原菌设计的引物熔解曲线Tm值单一,无引物二聚体,特异性强,因此采用了SYBR GreenⅠ荧光染料染色的方法.
张晓云等[18]利用病斑面积的大小研究了枯草芽孢杆菌CAB-1抑菌蛋白对黄瓜白粉病的防治作用,范瑛阁等[19]采用扫描电镜研究了3株生防细菌对黄瓜白粉菌的拮抗、溶菌和重寄生作用,但这两种研究方法都无法准确检测处理后的黄瓜白粉菌活菌数量.本研究通过设计黄瓜白粉菌特异性引物,建立了PMA-qPCR方法,检测了黄瓜白粉菌的活性病原菌和臭氧处理后的黄瓜白粉菌活菌比例.臭氧处理50 min时检测到的活菌比例较处理前有明显下降,说明该方法可以有效区分出黄瓜白粉菌中的活性菌.
PMA-qPCR中的PMA染料可以穿过死细胞不完整的细胞膜与DNA共价结合,弥补了qPCR方法不能检测样品中活细胞比例的不足.通过PMA-qPCR方法可从分子水平对黄瓜白粉病菌进行检测,也可用于检测黄瓜白粉病的生物防治效果,有助于制定高效的防治策略,并且具有低成本、精确、快捷、实用性强等优点.
