CoCl2化学模拟肝癌体外缺氧模型的建立及对HIF-1α、VEGF基因的影响
2019-10-09翁苓苓高玲张闽光
翁苓苓 高玲 张闽光
肝癌本身快速增殖的生物学特征造成了缺氧的微环境,其与肿瘤发展、浸润、转移等恶性生物学行为密切相关,导致肿瘤治疗失败和预后不良[1]。缺氧诱导因子-1(HIF-1)在肝癌的侵袭、转移中起着重要的作用,但因HIF-1α在常氧下易降解[2],使这种研究遇到困难。因此,建立体外细胞稳定的缺氧模型可为肝癌的缺氧环境及防治血管新生等实验研究提供平台。常规的缺氧模型为物理性缺氧如低张性低氧,其模型特点需要低氧的状态平衡与维持,而化学模拟诱导缺氧环境简单易行,更利于快速建立急性缺氧的模型。本研究就CoCl2作用常见的肝癌细胞系模拟化学性缺氧的最佳条件展开探索。
资料与方法
一、实验细胞和材料
(一)细胞 人肝癌细胞系HepG2、Hep3B、SMMC-7721和 Bel-7402,购于美国菌种保藏中心(ATCC)。
(二)试剂 胎牛血清(Gibco公司);DMEM培养基(美国Hyclone);双抗(青霉素-链霉素)(美国Gibco公司);胰酶(美国Sigma公司);CCK-8试剂盒(上海博谷生物科技有限公司);氯化钴(sigma,C8661);HIF-1α抗体(BD,610958);VEGF引物 (CST);PCR提取试剂(日本TAKARA);PCR定量试剂盒(日本TAKARA)。
二、实验方法
(一)细胞培养 用含有10%的胎牛血清、谷氨酰胺的DMEM培养液,于37 ℃饱和湿度、5% CO2浓度下培养。
(二)建立低氧模型 将对数生长期的四种细胞种植在96孔板内,根据每种细胞生长情况调整细胞浓度,每孔200 μL培养基,设常氧气对照组(加入正常培养液),实验CoCl2组(分设100、200、300、400、500、600、700、800 μmol/L),每组5个复孔。
(三)CCK-8法细胞增殖实验 取对数生长期的肝癌细胞悬液,以每孔5×103个细胞接种于96孔培养液,每孔培养液为200 μL。每组设5个复孔,37 ℃、5%CO2细胞培养箱中培养,按照碧云天CCK-8试剂盒说明书进行操作,加入不同浓度CoCl2处理肝癌细胞,每孔加入10 μg CCK-8,轻摇,37 ℃下孵育3 h,用酶联免疫仪记录450 nm 波长处的吸光度(A)值。分别做5个复孔,实验重复3次。
(五)RT-PCR检测 四种肝癌细胞在5%CO2、37℃条件下培养,处于对数生长期的细胞,加入200 μmol/L CoCl2分别作用于四种肝癌细胞系,常氧下加入培养液作为空白对照组,5% CO2、37 ℃继续培养胞0、6、12、24 h后,按照TRIzol说明方法提取细胞RNA,测总RNA浓度和纯度。按反转录试剂盒说明书将RNA逆转录为cDNA。以β-actin为内参,VEGF引物序列正义链:AATCGAGACCCTGGTG-GACA,反义链:TGTTGGACTCCTCAGTGGGC。PCR反应条件:94 ℃预变性30 s,94 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s共40个循环。2-△△CT法计算mRNA的相对表达。每个实验组重复3次。
(六)Western blot检测 四种肝癌细胞在5%CO2、37 ℃条件下培养,处于对数生长期的细胞,分别加入含100、200、300、400 μmol/L 的CoCl2的DMEM培养液培养24 h,提取总蛋白后测定蛋白浓度。蛋白裂解液裂解细胞后提取细胞总蛋白。BCA法测定蛋白浓度。丙烯酰胺垂直电泳,半干转膜法转至PVDF膜。5%脱脂牛奶室温封密1 h。加一抗稀释液4 ℃孵育过夜。PBST缓冲液洗膜10 min×3次。加入不同稀释比的二抗稀释液室温孵育1 h,PBST缓冲液洗膜10 min×3次。ECL化学发光,暗室胶片显影后,Image-Pro Plus 5.0软件计算条带光密度值。
三、统计学方法
结 果
一、氯化钴对四种肝癌细胞存活率的影响
为了研究在CoCl2处理诱导的缺氧模拟条件下对常见的肝癌细胞生长的影响,将四种肝癌细胞加入不同浓度的CoCl2(0~800 μmol/L)。CoCl2浓度的选择是既能满足实验低氧条件,又保证细胞存活率较高作为细胞缺氧的实验的标准,排除药物对于细胞较大的急性毒性,同时保证药物能够发挥最大作用。实验选用不同浓度的CoCl2作用于四种肝癌细胞,24 h后检测细胞的吸光度值。实验结果显示,加入不同浓度的CoCl2后四种肝癌细胞存活率不同程度地减低,CoCl2浓度在100~200 μmol/L时四种肝癌细胞的生长无明显减低,当浓度高于200 μmol/L后,四种人肝癌细胞存活率明显降低(P<0.05,见图1)。
选取100、200、300、400 μmol/L浓度的CoCl2作用四种肝癌细胞0、12、24、48、72 h后检测细胞的吸光度值,结果显示,CoCl2作用四种肝癌细胞48、72 h后细胞存活率显著降低(P<0.05,见图2)。表明CoCl2>200 μmol/L,作用时间>24 h后呈剂量和时间依赖性地抑制肝癌细胞活力,而浓度在200 μmol/L以内的CoCl2未严重影响细胞的活力。

图1 不同浓度CoCl2对四种肝癌细胞存活率的影响
二、氯化钴作用四种肝癌细胞不同时间后VEGF mRNA的表达
根据CoCl2对细胞活性增殖的影响,选取浓度为200 μmol/L的CoCl2作用四种肝癌细胞最佳诱导浓度,作用0、6、12、24 h后检测VEGF mRNA相对表达量。结果显示,在CoCl2作用24 h时四种肝癌细胞VEGF mRNA表达均明显增加(P<0.05)。故选用的时间为24 h作为CoCl2诱导低氧的时间。见图3。

注:A:Bel-7402肝癌细胞;B:Hep3B肝癌细胞;C:SMMC-7721肝癌细胞;D:HepG2肝癌细胞
图2CoCl2作用四种肝癌细胞不同时间后的细胞存活率
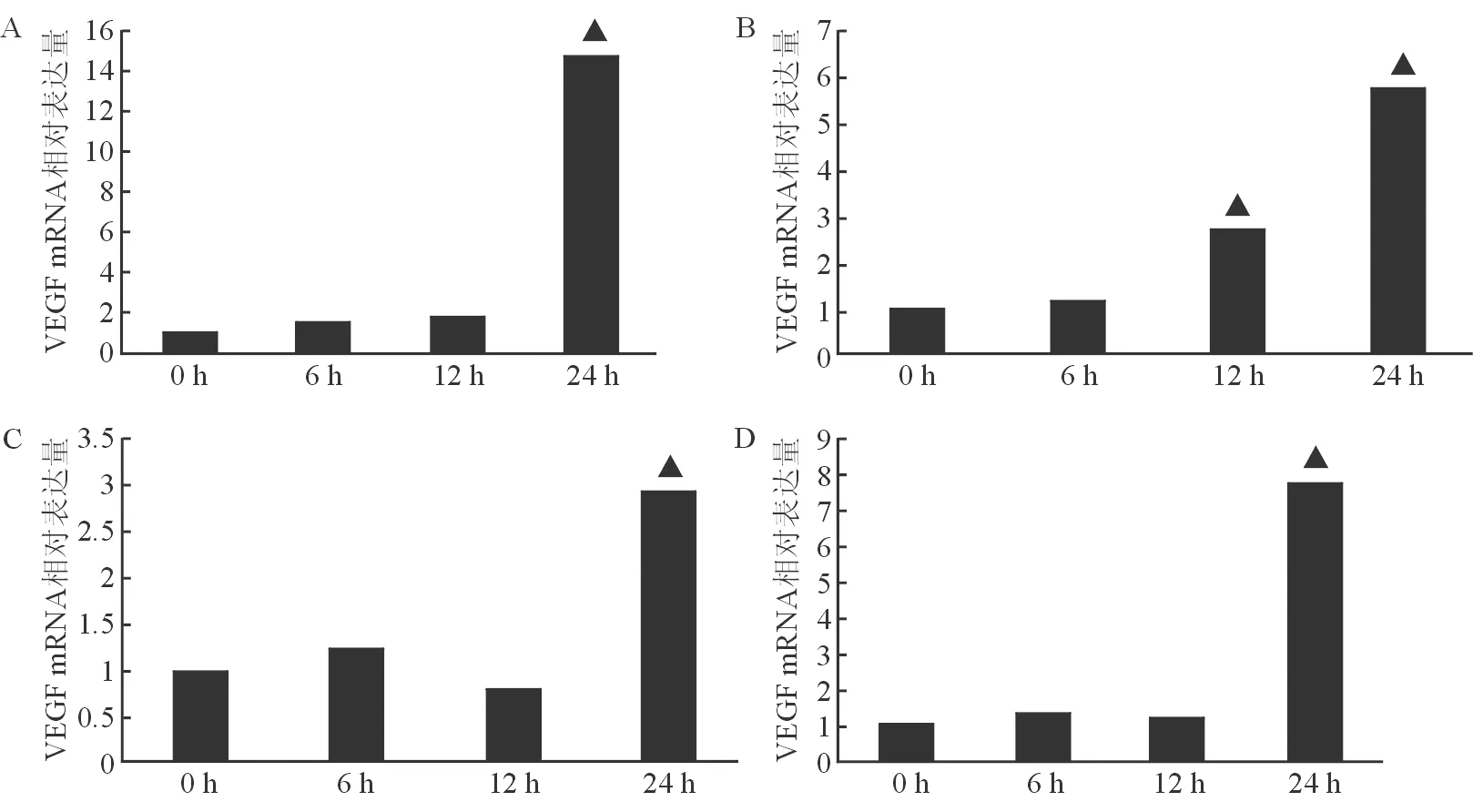
注:A:Bel-7402肝癌细胞;B:Hep3B肝癌细胞;C:SMMC-7721肝癌细胞;D:HepG2肝癌细胞。与对照组(作用0 h肝癌细胞内VEGF mRNA)比较,▲P<0.05
图3CoCl2对四种肝细胞VEGFmRNA相对表达量的影响
三、氯化钴对四种肝癌细胞HIF-1α蛋白表达的影响
不同浓度培养氯化钴作用于四种肝癌细胞24 h,提取总蛋白,进行Western Blot的检测。结果显示,未加入氯化钴时HIF-1α蛋白未见明显表达;当氯化钴浓度为100 μmol/L时,Bel-7402细胞HIF-1α蛋白表达;当氯化钴浓度为200 μmol/L时,四种肝癌细胞HIF-1α蛋白均表达。故综合氯化钴对细胞存活率的影响,氯化钴浓度为200 μmol/L可作为稳定HIF-1α表达的缺氧模型的浓度。

图4 不同浓度CoCl2作用四种肝癌细胞24 h后HIF-1α蛋白的表达
讨 论
CoCl2是常见的化学模拟缺氧条件的化学物质,其通过钴的累积稳定HIF-1α表达来模拟缺氧[3],与氧水平无关,因此该方法具有比常规缺氧模型更稳定的优点。此外,已经证明CoCl2能调节缺氧导致相关的下游靶标如促红细胞生成素和葡萄糖转运蛋白1(GLUT1)的作用,具有与真正的缺氧相同的调节作用[4]。
CoCl2对不同的细胞诱导HIF-1α表达所需的浓度及处理时间有所不同。高浓度或长时间作用细胞会诱导细胞的凋亡[5]。CoCl2能上调HIF-1α,并促进VEFG等下游基因表达[6-7]。本研究提示,氯化钴对四种肝癌细胞均产生细胞毒性作用,并随着药物浓度增加而增强。在CoCl2浓度超过200 μM时及作用24 h后细胞存活率明显减低。同时发现200 μM CoCl2作用四种肝癌细胞24 h后细胞内VEGF mRNA表达水平最高,肝癌细胞也较能稳定表达HIF-1α蛋白。本研究表明,四种常见的肝癌细胞在200 μM CoCl2作用24 h时,对细胞既有较小的细胞毒性,也能使得肝癌细胞较稳定表达HIF-1α,因此200 μM CoCl2作用24 h 为肝癌化学性缺氧诱导的最佳条件。
与其他体外模型一样,这个简化的平台相对有限地反映了体内肿瘤微环境,它缺乏体内的复杂性、细胞成分的多样性(包括免疫细胞和器官特异性基质细胞,以及细胞外基质成分)。然而,与依赖于物理低氧的常规缺氧模型相比,基于CoCl2的平台可以简单易行地模拟肿瘤缺氧微环境,为肝癌细胞的缺氧、血管新生的研究提供了细胞模型基础。
