俄罗斯联邦药物性肝损伤临床指南介绍
2019-10-09孙小溪吴姗姗梁文丽于乐成
孙小溪 吴姗姗 梁文丽 于乐成
俄罗斯联邦最近发布了2019年药物性肝损伤(DILI)临床指南[1],本刊挑选其中值得借鉴和参考的内容作简要介绍。
一、流行病学
至2016年,世界卫生组织(WHO)的VigiBase全球数据库已收到13 208 000份药品不良反应报告。仅在2015至2016年期间就增加了18%(新病例198.4万)。DILI约占所有不良反应的10%。DILI发病率高,临床表型多样,缺乏明确的诊断方法,部分患者预后不良。需要指出的是,肝损伤不仅可由一般概念的药物引起,也可由具有生物学活性的添加剂(biologically active additives,BAA)和植物类制品(plant products)引起,后两者相当于欧美文献所指的草药和膳食补充剂(HDS)。
在俄罗斯联邦,急性DILI约占住院患者的 2.7%。抗结核药、抗菌药物、镇痛药、激素、细胞生长抑制剂、抗高血压药和抗心律失常药是常见的引起DILI的药物。DILI的严重程度可从轻微到极端严重,甚至死亡。
对乙酰氨基酚是发达国家严重的非特异质型DILI最常见的原因。迄今为止,已确认1 000多种药物和HDS会可引起DILI,且其数量在不断增加。LiverTox网站(http://livertox.nlm.nih.gov)包含了美国DILI网络(DILIN,http://www.dilin.org)注册记录的药物肝毒性信息。DILIN专家组建议,根据已知的肝毒性风险及官方报告的肝损伤例数,可将相关药物分为以下几类:有50例以上肝毒性报告的为A类,有12~50例肝毒性报告的为B类,有4~11例肝毒性报告的为C类,有1~3例肝毒性报告的为D类,无肝毒性报告的为E类。此外,当药物的肝毒性无法充分评估时,例如新药或很少使用的药物,可归为X类。某些专家还建议,将仅在超过治疗剂量时才显示肝毒性的药物归为T类。A类和B类药物见表1,经常引起特异质型DILI的药物见表2,经常导致DILI的抗肿瘤化疗药物见表3。HDS引起的DILI特别值得注意,不同草药组分之间的相互作用也非常重要。

表1 引起DILI最常见的A类和B类药物▲
注:▲来自美国DILIN数据库;*该药品未在俄罗斯联邦注册

表2 不同数据库报道的引起特异质型DILI的前5种药物
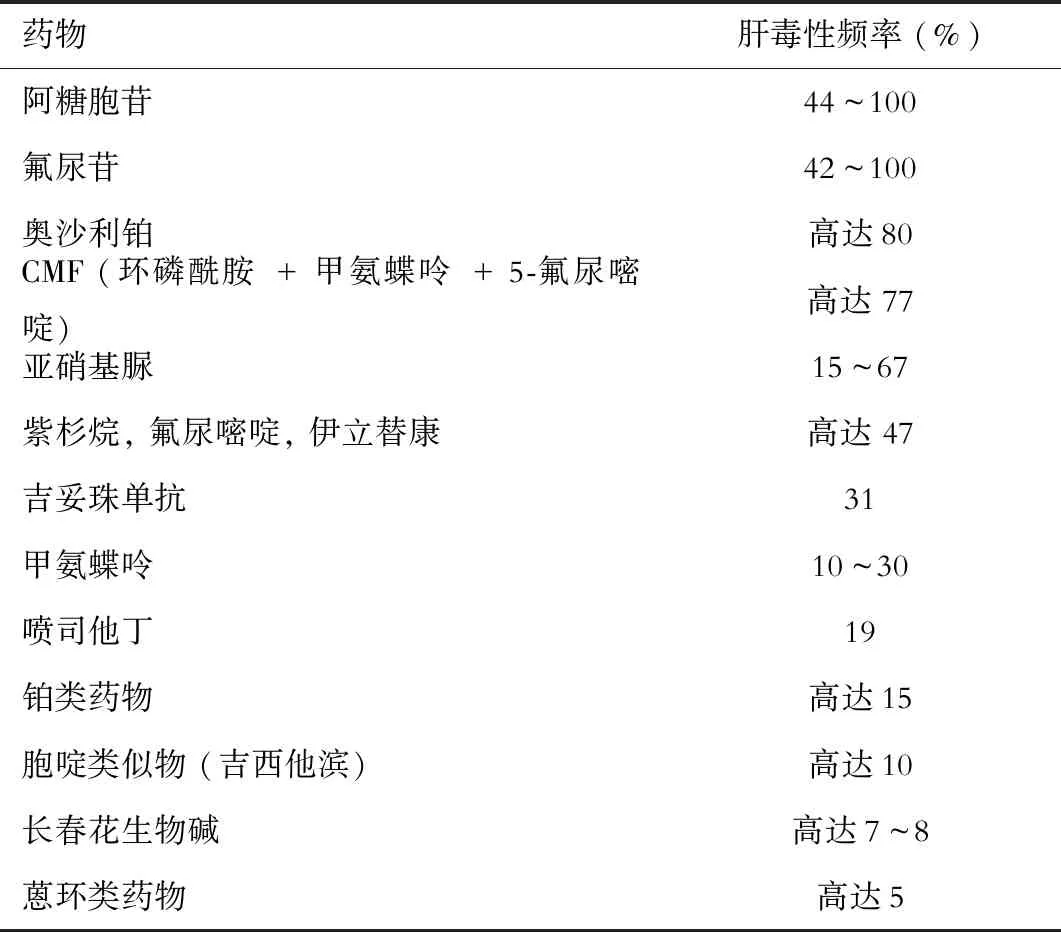
表3 抗癌药物的肝毒性频率*
注:*根据俄罗斯联邦肿瘤学会2014年制定的“抗癌化疗引起的肝毒性的治疗建议”
二、药物不良反应的类型与DILI所属分型
不论药物对机体损伤的性质如何,药物反应通常可分为A、B、C和D共4型。A型是指常可预期的、与药物(例如大剂量对乙酰氨基酚)药理活性相关的药物不良反应,或药物间相互作用的结果,可在任何人身上观察到。B型是指罕见的、难以预期的、非剂量依赖性反应,仅发生在少数敏感人群,即特异质型药物不良反应或其他反应。C型是指与药物长期治疗相关的反应,例如耐受性、依赖性、戒断综合征和累积效应。D型是指药物的延迟效应。
DILI通常可分为直接肝毒性和特异质型反应。直接肝毒性反应也称固有肝毒性反应,与药物的药理学性质相关,具有剂量依赖性,可发生于任何人,因此符合上述A型药物不良反应的特征。特异质型DILI仅发生于少数人群,由机体的适应性免疫应答或某些遗传特性所致,几乎不依赖于剂量,其临床病程和结果多变,因此符合上述B型药物不良反应的特征。
俄罗斯联邦指南对常见DILI的临床分型(肝细胞损伤型、胆汁淤积型、混合型)和严重程度划分、R值计算方法等方面的建议,与当前中国、美国及欧洲的DILI指南大体一致,但对于肝细胞损伤型DILI的ALT阈值,仍沿用了国际上早年的标准,即ALT>2×ULN。
三、DILI的发病机制和危险因素
由于药物生物转化机制的多样性,每种药物所致DILI的发病机制也可能存在不同。DILI发病机制多样而复杂,涉及药物的直接肝毒性效应(药物活性代谢产物的形成和氧化还原反应的受损)、细胞肌动蛋白合成的破坏及随后的裂解所致的细胞膜损伤、胆盐输出泵等转运蛋白或多肽的功能障碍、免疫系统的激活和免疫-炎症反应的启动等。药物代谢涉及到细胞色素P450(CYP)等多种酶系,而CYP的异构体目前已发现1 000余种。细胞凋亡是上述生物转化异常导致的一个结果。细胞呼吸链相关酶的抑制在DILI的发展过程中起重要作用,可使ATP生成减少,脂肪酸代谢异常,导致出现不同类型的肝细胞脂肪变性。
DILI的发生是多种因素相互作用的结果,其风险因素包括药物的肝毒性潜力、个体的遗传易感性、肝损伤发病前的基础疾病背景和环境因素等。
(一)遗传因素 遗传因素主要涉及HLA 等位基因、(药物代谢酶和转运系统的)基因多态性及线粒体功能障碍等。遗传因素被认为是特异质型DILI发病的主要风险因素。全基因组关联研究(GWAS)显示,人类第6对染色体中的HLA位点与某些药物所致DILI之间有显著的因果关联(表4)。

表4 与DILI相关的HLA等位基因
注:引自A.Ortega-Alonso et al,2016.
(二)药物特性 药物特性包括药物的化学结构、分子量、亲脂性、剂量和疗程等。对于肝毒性的预测,了解药物的剂量和用药时间是必要的。对于过敏反应性DILI,任何药物的剂量阈值通常大于10 mg;而对于特异质型DILI,剂量阈值通常大于50 mg/d。亲脂性在DILI发生中的作用尚无明确结论。
(三)宿主因素 宿主因素包括种族 /民族、年龄、性别、生活方式、肝病史、其他病情、多重用药情况、微生态状况、病毒感染(HBV、HCV、HIV等)、活性代谢物的合成能力、药物运输和清除途径受损、解毒功能异常、GSH系统的消耗、酒精摄入、营养不良等。
1.年龄:年龄对于预测DILI的特定表型有一定的价值。例如,乙酰水杨酸相关的Reye综合征仅见于儿童患者;异烟肼相关的DILI在50岁以上人群中的发生率是其他人群的5倍。另一方面,老年人体重减轻,CYP代谢活性减弱,药代动力学发生变化,但尚未确认高龄是DILI的危险因素。高龄时的多重用药可能是年龄与DILI发病率增高相关的主要因素。
2.性别:队列研究未显示DILI的发病率具有显著的性别差异。但有研究显示,女性是肝细胞损伤型DILI伴暴发性肝功能不全(女性占77%~89%)的独立危险因素。
3.种族:蒙古人种可能是发生DILI的独立危险因素,而黑人与慢性DILI表型相关。
4.肝病和其他背景状况:基础疾病和代谢特是DILI发生的危险因素。有使用某种药物或其类似物引起不良反应的病史的患者,再次用药可增加DILI的发生风险。
许多药物在较低剂量慢性滥用时可增加肝毒性风险,当应用对乙酰氨基酚、异烟肼、烟酰胺等药物时可显著增加肝损伤的严重程度,并与甲氨蝶呤的特异质性肝毒性反应相关。肥胖会增加氟烷肝损伤的风险,甲氨蝶呤和他莫昔芬是导致脂肪性肝炎和肝纤维化的诱因。饥饿与异烟肼和对乙酰氨基酚的肝毒性直接相关。糖尿病不是发生DILI的危险因素,但如果发生糖尿病,则会导致DILI的慢性化和死亡风险增加。
5.药物间相互作用:同时使用多种药物可增加DILI发生的可能。
已知通过CYP或膜转运蛋白系统诱导代谢可增强药物的肝毒性。典型例证是长期饮酒可诱导CYP2E1,从而增加对乙酰氨基酚的肝毒性。
联合使用两种或更多具有潜在肝毒性的药物可增加DILI风险。可应用下述网站帮助评估药物的潜在相互作用https://www.drugbank.ca/interax/multi_search。
治疗丙型肝炎的直接抗病毒药物(DAA)尽管具有良好的有效性和安全性,但与其他药物和某些营养素有药物相互作用(DDI)。通过https://www.hep-druginteractions.org/checker网站和手机应用软件 HEPiChart 可查询DDI,从而预防不良事件的发生。
(四)代谢因素 活性代谢物的形成与肝毒性强度之间存在关联的结论主要来自于体外细胞培养研究,在临床上尚未证实两者之间存在明显的相关性。通过氧化应激实现的直接细胞毒作用在卡马西平、氯丙嗪、氯氮平实验中得到证实。与线粒体损伤相关的肝细胞死亡最常在线粒体DNA点突变遗传机制的基础上发生。这一情况已在双氯芬酸、丙戊酸、他莫昔芬和阿司匹林所致的肝损伤中得到证实。从现代微生物组学研究的角度来看,抗生素相关的DILI可能是通过干扰微生物群组成来实现的,这也会导致线粒体损伤。
一些研究表明,胆汁淤积型DILI的发生是由于胆盐输出泵(BSEP)的活性受到抑制,例如酮康唑、奈法唑酮和拉帕替尼相关的肝毒性。可能同时影响线粒体和BSEP的药物导致更严重肝毒性的风险更大。多药耐药相关蛋白(MRP)及其MRP3和MRP4组分功能异常引起的胆汁淤积型DILI也是值得特别关注的。
四、DILI的临床表型
DILI具有多种临床和病理形态学表型。DILI的部分临床和病理形态学表型、所对应的药物及病理组织学特征见表5。
1.进展性肝细胞坏死和炎症浸润
a.急性肝细胞坏死(中央静脉周围的3区带和门管区周围的1区带)
b.进行性肝坏死(急性肝功能衰竭)
c.急性病毒性肝炎样改变
d.急性自身免疫性肝炎样改变
e.单核细胞增多症肝炎样改变
f.慢性病毒性肝炎样改变
g.肉芽肿性肝炎样改变
2.胆汁淤积型
a.急性肝内胆汁淤积症,伴或不伴炎症浸润
b.慢性肝内胆汁淤积症,伴或不伴炎症浸润

表5 DILI的临床和病理形态学表型与所对应的药物
c.胆管硬化的形成
d.胆管缺失
3.肝细胞损伤/胆汁淤积混合型
4.脂肪变性
a.微泡性
b.大泡性
c.脂肪性肝炎样损伤
d.肝磷脂沉积病
5.血管损伤型
a.伴肝窦扩张
b.紫癜性肝病
c.肝窦阻塞综合征(肝小静脉闭塞病)
d.肝静脉血栓形成(Badd-Chiari综合征)
e.肝门静脉硬化
f.结节性再生性增生
6.慢性DILI伴严重纤维化和肝硬化
7.肝脏肿瘤
a.肝细胞腺瘤
b.肝细胞癌
c.胆管癌
五、DILI的诊断与鉴别诊断
俄罗斯联邦DILI指南对DILI 的诊断和鉴别诊断的阐述及流程,基本与最新的中国、美国和欧洲的DILI指南保持一致。其中,也着重推荐应用2015版RUCAM量表进行药物与肝损伤之间因果关系的评估。
此外,俄罗斯联邦DILI指南指出肝活检不是诊断DILI的强制性检查项目,但在以下情况需考虑肝活检:(1)已停用可疑药物,但实验室检查提示肝脏生化指标持续进展;(2)已停可疑药物,但血清ALT在30 d后从峰值降低不足50%(肝细胞损伤型),或血清ALP在180 d后从峰值降低不超过50%(胆汁淤积型损伤);(3)计划使用或再使用某种疑似曾经导致DILI的药物时;(4)慢性肝病或慢性DILI实验室检查持续异常超过180 d时。
六、DILI的预后和预防
与现有中、美、欧DILI指南相比,俄罗斯联邦指南对DILI的预后和预防无特别不同的阐述。
七、DILI 的治疗
治疗DILI首先是停用引起肝损伤的药物。轻到中度DILI患者可在门诊治疗。症状严重或符合Hy’s法则的患者,需住院治疗。除给予必要的对症支持治疗外,适当应用抗炎保肝药物有助于DILI的恢复。对DILI相关肝衰竭病例,应当与肝移植中心联系,紧急肝移植可挽救约40%的DILI相关急性肝衰竭(ALF)患者。干细胞在重症DILI患者中的应用价值有待研究。
迄今为止,尚无一种药物可有效用于任何形式的DILI的解毒和治疗。
(一)N-乙酰-L-半胱氨酸(N-acetyl L-Cysteine,NAC)NAC用于过量对乙酰氨基酚引起的DILI,肝功衰竭早期给药时的疗效已得到随机对照临床试验(RCTs)的证实。72 h口服用药方案为:饱和剂量140 mg/kg,然后改为70 mg/kg,每4 h一次,直至满72 h。21 h静脉用药方案为:饱和剂量150 mg/kg,1h用完;然后50 mg/kg共4 h,再后100 mg/kg共16 h。
(二)左旋肉碱(L-carnitine)左旋肉碱用于丙戊酸引起的DILI。对92例由丙戊酸钠引起的重症DILI患者的研究表明,近半数应用左旋肉碱治疗的患者存活,而单纯接受强化支持治疗的患者生存率仅为10%。左旋肉碱注射途径的疗效优于口服途径。
(三)消胆胺(cholestyramine)在来氟米特引起的DILI中,消胆胺平均使用时间为11 d(来氟米特因肠肝循环而具有较长的半衰期)。
(四)糖皮质激素(glucocorticosteroids,GC)GC主要适用于自身免疫样DILI的治疗。动态监测GC的疗效有助于鉴别真正的自身免疫性肝炎和DILI。推荐的GC用法为:强的松20~40 mg/d,在肝脏生化指标复常后减量,持续用药6个月。在GC停药后,自身免疫性DILI一般不会复发,而真正的自身免疫性肝炎(AIH)多易复发。
具有自身免疫表型的DILI常由抗肿瘤坏死因子(抗-TNF)类药物所致。这类药物包括近年在俄罗斯联邦注册的、可用于多种肿瘤治疗的纳武单抗(nivolumab)。使用纳武单抗的患者约5%可发生不同程度的肝细胞损伤,不足1%有发展为急性肝衰竭(ALF)的风险。纳武单抗或纳武单抗联合伊匹单抗(ipilimumab)引起的DILI属于免疫介导的肝炎,其处理方案如下:
1.基线血清ALT、AST和TBil正常者:如出现Ⅱ级肝损伤(表6),则暂停纳武单抗和伊匹单抗等免疫治疗,直到肝脏生化指标恢复正常。若生化指标持续异常,可用甲基强的松龙每日0.5~1 mg/kg。若能缓解,则渐减激素剂量,并可在适当的时机恢复免疫疗法。若病情继续进展,则增加甲基强的松龙剂量至每日1~2 mg/kg,停用免疫治疗应且不得恢复应用。出现Ⅲ~Ⅳ级ALT、AST和TBil升高(表6)时,需停止免疫治疗且不再恢复使用,并给予甲基强的松龙每日1~2 mg/kg进行治疗。
2.基线血清ALT、AST和TBil升高的HCC患者:若基线血清ALT、AST升高不超过3 ULN,在免疫治疗过程中其水平升高至5~10倍,应停止免疫治疗,给予甲基强的松龙每日1~2 mg/kg;若能缓解,尚有可恢复免疫治疗。若基线ALT、AST升高幅度大于3~5 ULN,在免疫治疗过程中增加到8~10倍以上,应停用纳武单抗,给予甲基强的松龙每日1~2 mg/kg。若能缓解,尚可恢复免疫治疗。若基线ALT、AST升高幅度大于10 ULN,或TBil升高至3~10 ULN(表6),应停纳武单抗,且不再恢复使用。
(五)Remaxol Remaxol的活性物质为琥珀酸、N-甲基葡聚糖、肌苷、蛋氨酸和烟酰胺,用于肿瘤治疗和预防DILI,也可作支持治疗。根据癌症支持护理专家协会的临床指南,在一些DILI高危药物应用时可预防使用Remaxol。也可用于抗结核药物所致DILI的防治。
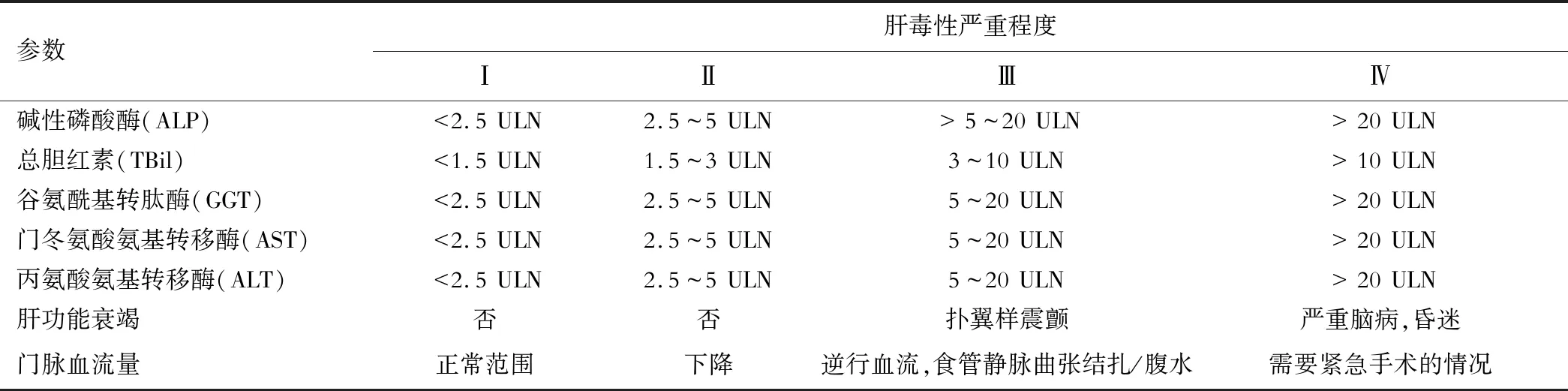
表6 美国国立癌症研究所(NCI)制定的药物肝毒性严重程度标准
(六)腺苷蛋氨酸(SAMe )俄罗斯联邦肿瘤学协会(RUSSCO)支持治疗学组已更新临床指南,将SAMe纳入相关DILI的预防和治疗方案。
(七)双环醇(Bicyclol)双环醇对肝损伤的保护作用已在四氯化碳、对乙酰氨基酚、D-氨基半乳糖和刀豆蛋白A(ConA)的肝损伤实验模型中得到证实,并证明了其安全性。双环醇治疗和预防多种DILI的有效性及安全性已得到诸多研究的证明。通常剂量为一次25~50 mg,3次/d。可持续4周或更长时间。
(八)熊去氧胆酸(UDCA)对胆汁淤积型DILI,可以给予UDCA每日 13~15 mg/kg治疗。在RUSSCO针对DILI的临床建议中,对于胆汁淤积型,建议联合给予腺苷蛋氨酸(Heptral○R)和UDCA。
(九)必需磷脂(EFL)常用制剂是多烯磷脂酰胆碱(易善复)。EFL的使用有利于细胞膜和细胞器结构的正常化,使肝细胞坏死减轻和消失,促进肝细胞再生,减少结缔组织形成。有研究显示,在妊娠前3个月应用EFL治疗DILI有效。对妊娠和分娩过程的动态观察表明,EFL可使流产的发生率降低2倍,使先兆子痫的发生率降低2.5倍。
(十)水飞蓟素 水飞蓟素对肝脏的保护作用由来已久。水飞蓟素治疗DILI的有效性研究仍在继续,目前主要在动物模型中进行研究。小型临床研究表明水飞蓟素对于抗结核药物引起的肝毒性有一定的防治效果。
八、推荐意见汇总
1.药物性肝损伤(DILI)可由一般意义上的药物引起,也可由具有生物学活性的添加剂和传统医药(相当于HDS)引起。
2.对于原因不明的急性或慢性肝病患者,应始终考虑有DILI的可能性。
3.DILI可分为直接肝毒性和特异质型反应。
4.DILI可以是无症状的,也可以具有严重且多样的临床症状。
5.在没有组织学证据的情况下,药物暴露时的肝损伤可诊断为:(1)ALT或AST ≥ 5 ULN,无症状;(2)ALP≥2 ULN;(3)TBil>2 ULN,同时有其他肝脏生化指标增高;(4)AST或ALT <5 ULN,同时有症状。此外,对于实验室指标升高不足2 ULN的情况,应称之为“肝脏生化试验改变”。孤立性ALT(AST)活性升高达2~5ULN,可考虑为肝损伤。
6.对于每项升高的指标,应计算其超过正常上限值(ULN)的倍数。应计算R值,计算方法为(ALT/ULN)/(ALP/ULN)。在监测过程中也应计算R值。
7.根据临床和实验室数据,应区分以下类型的肝损伤:(1)肝细胞损伤型,ALT>2 ULN或R≥5;(2)胆汁淤积型,ALP>2 ULN或R≤2;(3)混合型,ALT >2×ULN,ALP>2×ULN,2 8.DILI发生6个月内,若肝酶或胆红素没有恢复到发病前的基线水平,和/或持续存在肝病的其他体征或症状,则应考虑慢性DILI。 9.可以使用2011年GP Aithal等创建的系统,或其他任何经过广泛测试的DILI相关系统对DILI的严重程度进行判断。 10.药物高剂量被确认为DILI发展的危险因素。而其他常见因素目前尚未被确认为DILI发展的危险因素。风险评估应当因人而异。年龄、合并症、慢性酒精滥用,携带某些特定的等位基因,都可能增加单用特定药物时DILI的发生风险。女性是暴发性肝衰竭的独立危险因素。 11.不同DILI表型具有不同的临床表现、病理形态学特征和致病药物。DILI治疗方案的制定应基于对DILI表型的评估。 12.为确定药物和肝损伤之间的因果关系,建议使用RUCAM量表进行评估。如可能不止一种药物是肝损伤病因,则应分别对每种药物使用RUCAM量表进行评估。对于复杂病例,分析药物与肝损伤之间的因果关系时,需比较肝损伤的表型和已发表的肝损伤数据。 13.DILI的诊断应基于对如下信息的评估:用药与肝损伤发生之间的时间关系;临床、实验室以及必要时的影像和肝组织学检查;风险评估;其他肝损原因的排除;有关药物肝毒性的现有文献数据分析。 14.DILI的诊断是一种排除法,通常需要对患者进行全面检查以排除其他病因。应根据具体情况和相关肝病的临床诊治指南,对可能的肝病逐一进行排查。 15.应避免再次使用导致DILI的可疑药物,除非是危及生命的情况且无其他替代治疗可供选择。在某些情况下,若初始肝损伤较轻,可尝试再次使用该药并评估肝脏反应,以作为一种辅助诊断策略。 16.可应用Hy’s法则识别严重的潜在致命性DILI的风险。Hy’s法则风险是指:发生药物相关的肝细胞损伤和黄疸(TBil>2 ULN),并能除外其他原因所致的TBil升高。 17.若疑似发生DILI,但继续治疗的益处高于风险,则建议停用所有疑似肝损伤药物。然而,即使需要继续用药,但在下列情况下仍应停止使用疑似肝损伤药物:(1)ALT或AST>8 ULN;(2)ALT或AST>5 ULN超过2周;(3)ALT或AST>3 ULN,伴TBil>2 ULN(或INR>1.5);(4)ALT或AST>3 ULN,伴乏力、恶心、呕吐、发热、皮疹和/或嗜酸性粒细胞增多(>5%)。但若原发疾病危及生命,且除了该药以外并无其他可用的替代治疗,则出于健康目的,仍可谨慎使用该药继续治疗。 18.轻到中度DILI患者可在门诊治疗。符合Hy’s法则的严重DILI患者(有肝细胞损伤的征象,有严重的临床表现以及潜在的预后不良)需要住院治疗。 19.如确诊DILI,医生必须向患者转交相关的医疗文件,在文件中注明引起DILI的可疑药物或已得到确认的药物。建议患者妥善保存相关医疗文件,并在以后就医时呈现。患者应避免在没有医生处方的情况下自行应用可疑肝损伤药物和具有相似药理学特点的其他药物。 20.目前尚无非专利药物(generic drugs)可推荐用于治疗DILI。 21.随着急性严重DILI向急性肝衰竭进展,应及时与肝移植中心讨论患者的救治策略。 22.护肝治疗应基于DILI的严重程度、表型以及致病药物的药代动力学和药效学特征来选择。根据DILI类型的不同来选择不同的保肝药物进行治疗是可能的。 23.DILI患者应当接受医生的监管,直至临床和实验室指标完全恢复正常。急性胆汁淤积型DILI慢性化风险较高,患者需要更为细致和长期的随访。类似自身免疫性肝炎的DILI患者也应延长观察治疗,以防真正的自身免疫性肝炎复发。 24.当应用具有肝毒性高风险的药物时,可以考虑预防性应用护肝药物。
