耐热克鲁维酵母与酿酒酵母顺序接种发酵对霞多丽干白葡萄酒感官品质的影响
2019-10-09杨婕王玉华米兰李爱霞王婧
杨婕,王玉华,米兰,李爱霞,王婧
(甘肃农业大学 食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室, 甘肃省葡萄与葡萄酒产业技术研发中心,甘肃 兰州,730070)
近几年,面对葡萄酒产品的优质化、国际化和高端化的发展趋势,提升葡萄酒品质是我国应对市场竞争的主要策略。然而,全球气候变化的趋势使得酿酒葡萄果实出现成熟速度加快,糖分含量提高,酸度下降,风味物质较为寡淡等问题[1]。因此如何提高葡萄酒酸度、降低乙醇体积分数,突出葡萄酒典型性风格是葡萄酒酿造中急需解决的技术问题。近年来,随着对葡萄酒研究的深入,非酿酒酵母的潜在应用价值不断被揭示,利用非酿酒酵母与酿酒酵母(Saccharomycescerevisiae)混合接种发酵,从而利用不同菌种“取长补短”是提升葡萄酒品质的重要途径之一[2]。
Lachanceathermotolerans是Lachancea属代表性物种,可代谢产生乳酸,具有生物“酸化剂”之称[3],在葡萄酒酿造中能够增加酒体酸度,降低pH值[4],并且其乳酸产生能力高于乳酸菌[5]。然而L.thermotolerans具有中等乙醇发酵能力,必须与发酵能力较强的酵母混合接种才能完成乙醇发酵[6]。BENITO[7]利用L.thermotolerans与S.cerevisiae混合发酵来探索其对西班牙南部葡萄产区的应用效果,结果表明L.thermotolerans在提高葡萄酒乳酸含量、甘油含量、增加挥发性香气物质方面有显著效果。也有学者研究表明,L.thermotolerans菌株之间的生理代谢和发酵能力差异较大,包括乳酸产生能力、耐受性等都各不相同[7]。目前国内对L.thermotolerans在葡萄酒中的应用尚未被重视,不同L.thermotolerans菌株与S.cerevisiae顺序接种方式对干白葡萄酒增酸效应及感官品质影响的研究尚未见报道。
高品质的白葡萄酒需要一定的酸度来支撑其口感的清爽度,然而近几年越来越多的白葡萄品种如霞多丽、贵人香、白诗南、长相思等在酸度上均无法满足要求。企业在生产中解决酸度缺乏的措施通常是增加商业食品级的酸,如酒石酸,乳酸或柠檬酸。但是,使用工业酸存在很多问题,如缺乏化学稳定性、成本提高等[7]。因此,明确L.thermotolerans的增酸、增香效应,同时借助S.cerevisiae发酵力强的特性揭示混合发酵方式对提高白葡萄酒酸度和感官品质的研究十分必要。
本试验以甘肃省葡萄与葡萄酒工程学重点实验室保藏的3株L.thermotolerans菌株为材料,研究不同L.thermotolerans菌株与S.cerevisiae以顺序接种发酵的方式对发酵过程主要产物的影响,乙醇发酵结束后测定葡萄酒的各项理化指标和乳酸产生情况,并用GC-MS测定其挥发性化合物的含量,以期为L.thermotolerans在国产白葡萄酒酿造中的应用提供理论参考。
1 材料与方法
1.1 原料与试剂
霞多丽葡萄:2016年9月采自甘肃省武威市民勤县夏博览葡萄酒庄园,含糖量210 g/L(以葡萄糖计)、可滴定酸含量7.2 g/L(以酒石酸计)。
L-苹果酸、L-乳酸(色谱纯):上海源叶生物科技有限公司;NaOH、NaCl、HCl、醋酸钠、无水碳酸钠、醋酸、无水葡萄糖等试剂(分析纯):天津市科密欧化学试剂有限公司。
1.2 菌种与培养基
L.thermotolerans1(LT1):中国科学院微生物研究所;L.thermotolerans2(LT2):南阳师范学院;L.thermotolerans3(LT3):安琪酵母公司;S.cerevisiae(SC),活性干酵母粉,安琪酵母公司。
YPD液体培养基(质量分数):葡萄糖2%、蛋白胨2%、酵母浸粉1%。
YPD固体培养基(质量分数):YPD液体培养基再加琼脂2%。
WL营养培养基,青岛高科技工业园海博生物技术有限公司。
1.3 仪器与设备
Genesis 10s紫外-可见分光光度计,美国Thermo Scientific公司;500051S 立式高压灭菌锅,上海申安医疗器械厂;SW-CJ-2FD超净工作台,苏净集团苏州安泰空气技术有限公司; SPX-150-II生化培养箱,上海跃进医疗器械有限公司;TRACE1310-ISQ气相色谱质谱联用仪,美国Thermo Scientific公司; Ultimate 3000高效液相色谱仪,美国Thermo Scientific公司。
1.4 试验方法
1.4.1 菌种培养
将活化于YPD平板的供试菌株挑取单菌落分别接种于YPD液体培养基中,28℃培养24 h,以2%的接种量分别接种于YPD液体培养基中,28℃培养24 h制成种子液,然后进行酵母菌接种试验。
1.4.2 小容器酿造试验
霞多丽葡萄除梗破碎、压榨装罐,加入40 mg/L SO2、20 mg/L果胶酶,4℃澄清48 h,60℃水浴10 min[1],放置室温,取葡萄汁接种供试菌株于1 L玻璃罐中,装液量为70%,启动乙醇发酵。
顺序接种:首先以2%的接种量将扩培后的3株L.thermotolerans菌株分别接种于澄清的葡萄汁中(接种后L.thermotolerans初始菌体数量为106CFU/mL),96 h后以2%的接种量接入S.cerevisiae(接种后S.cerevisiae初始菌体数量为106CFU/mL)进行混菌发酵;同时以接种S.cerevisiae纯种发酵为对照(接种后S.cerevisiae初始菌体数量为106CFU/mL)。
发酵温度控制在20℃左右,当残糖含量低于4 g/L 时,乙醇浓度基本不变时终止发酵,每个处理重复3次。
1.4.3 主要理化指标分析
乙醇发酵结束后取样测定残糖、乙醇体积分数、总酸、pH值和挥发酸等基本理化指标,参照GB/T 15038—2006 《葡萄酒、果酒通用分析方法》。
1.4.4L-乳酸、苹果酸测定
乙醇发酵结束后取样,参考BUGLASS等[8]和PÉREZ-RUIZ等[9]方法,略作修改。采用高效液相色谱仪进行测定。
色谱条件:色谱柱:BDS HYPERSIL C18(250 mm×4.6 mm,5 μm);检测器:二极管阵列检测器;流动相:0.005 mol/L的硫酸水溶液;流速0.5 mL/min;柱温:30 ℃;进样量20 μL;检测波长:210 nm。
定性:将配好的苹果酸、乳酸单一标准溶液分别进样,确定各自的出峰时间,根据保留时间进行定性。
定量:将配好不同浓度的苹果酸和乳酸混合标准液分别进样,进行定量分析。以不同混合酸标准液的浓度为横坐标,出峰面积为纵坐标绘制标准曲线,得到苹果酸、乳酸的标准曲线方程。根据标准曲线方程分别计算出酒样中苹果酸、乳酸的含量。
1.4.5 生长曲线测定
生长曲线测定参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验菌落总数测定》。
1.4.6 菌株细胞数量测定
参照GOBBI等[4]的方法,略作修改。单独接种S.cerevisiae的发酵酒样用YPD固体平板进行菌落计数。S.cerevisiae和L.thermotolerans顺序发酵酒样采用WL营养培养基测定,其中在WL营养培养基上L.thermotolerans呈深绿色,S.cerevisiae呈白色,根据菌落不同的颜色计算二者的生物量计算L.thermotolerans和S.cerevisiae的生物量。
1.4.7 挥发性化合物测定
HS-SPME样品处理:取8 mL酒样于顶空瓶中。加入2.4 g NaCl及10 μL内标物2-辛醇,并加入磁力搅拌转子,密封并摇匀,将摇匀的样品放于40℃磁力搅拌器中,平衡30 min,插入萃取头于40 ℃恒温水浴锅中磁力搅拌吸附富集30 min。
GC-MS分析条件:参照鲁榕榕等[10]方法并略作修改。色谱条件:色谱柱:DB-WAX(60 m×2.5 mm×0.25 μm);柱升温程序:40℃保持7 min,以4℃/min升至200℃,保持8 min;载气(He,纯度99.999%)流速 1 mL/min;进样口温度240℃;不分流进样。质谱条件:电子轰击离子源(EI);电子能量70 eV;传输线温度220℃;离子源温度240℃;质谱扫描范围m/z50~350。
定性定量方法:用气相色谱-质谱联用仪进行分析鉴定,香气成分分析利用MS全离子扫描模式下的总离子流图谱。分析结果运用计算机谱库(NIST 11)进行初步检索和分析,再结合相关文献进行人工谱图解析,确定挥发性物质的各化学成分;采用内标法进行定量分析,内标物为2-辛醇。如公式(1)、(2):
各香气成分含量/(mg·L-1)=
(1)

(2)
1.4.8 感官分析
感官分析参照GOBBI等[4]的方法,略做修改。选择10名经过专业培训并具有葡萄酒品鉴资格证的专业人员进行感官评定。对各酒样进行随机编号,分别从香气强度、花香、果香、甜味、酸味、异味、澄清度、酒体平衡8个方面对各葡萄酒样品进行具体评价。使用10分结构化数值尺度来量化,1~9代表强烈程度逐渐增加。
1.5 数据分析
采用Excel 2010进行数据处理,SPSS 23.0对数据进行单因素方差分析,利用Duncan’s多重比较在置信区间0.05下对数据进行差异显著性分析,对不同处理酒样的香气化合物进行主成分分析。
2 结果与分析
2.1 基本理化指标
由表1可知,在4组供试酒样中,残糖含量均<4 g/L,各处理间均无显著差异。S.cerevisiae纯种发酵的对照组乙醇体积分数最高为13.45%,3组顺序发酵酒样乙醇体积分数与对照酒样相比有所降低,但3组处理酒样间存在显著差异,由此可见,L.thermotolerans具有降低葡萄酒的乙醇体积分数的潜力;3组处理酒样挥发酸含量为(0.28~0.35) g/L,与对照酒样(0.43 g/L)相比均显著降低,且处理间存在显著差异,表明L.thermotolerans具有低产挥发酸的特性;3组处理酒样pH值比对照酒样显著降低了6%~10%,且3组处理酒样间差异显著,其pH值与总酸含量相对应,表明L.thermotolerans能增加酒体酸度。

表1 乙醇发酵结束时供试酒样理化指标Table 1 physico-chemical indices of sample wines at the end of alcoholic fermentation
注:SC:单独接种S.cerevisiae酒样;LT1-SC:先接种L.thermotolerans1,4d后接入S.cerevisiae酒样;LT2-SC:先接种L.thermotolerans2,4d后接入S.cerevisiae酒样;LT3-SC:先接种L.thermotolerans3,4d后接入S.cerevisiae酒样。同行不同字母表示差异显著(P<0.05)。下同。
2.2 总酸及苹果酸、L-乳酸分析
由图1-A可知,3组处理酒样之间总酸含量差异显著,比对照酒样(6.53 g/L)增加了7.2%~44.4%。L.thermotolerans作为生物酸化剂,具有产生L-乳酸的能力,由图1-B可知,3组处理酒样中L-乳酸的含量显著高于对照酒样(0.12 g/L),其中LT1酒样的乳酸含量(2.53 g/L)显著高于LT2酒样(2.01 g/L)和LT3酒样(1.52 g/L)。由此可知,3株L.thermotolerans菌株自身的差异性导致其产生乳酸的能力各不相同。本试验未进行苹乳发酵,3组处理酒样中苹果酸含量与对照酒样相比显著降低了21%~24%,但处理酒样之间苹果酸含量并无显著差异。

A-总酸;B-苹果酸和乳酸图1 供试酒样总酸及苹果酸、乳酸生成量Fig 1 Production of total acid and malic acid、lactic acid of sample wines注:图中不同小写字母表示各组差异显著(P<0.05)。
2.3 生长曲线及乳酸曲线分析
由图2可知,3株L.thermotolerans菌株的生长趋势基本相似,经历了约1 d的延滞期,随后在第2天进入了对数生长期,第4天3株L.thermotolerans的生长量达到最大值为107CFU/mL,之后生长趋于稳定。同样,3株L.thermotolerans菌株产乳酸的趋势大致相同,均是在第4天达到最大值,分别为1.66、1.80、1.35 g/L,随后乳酸含量略有下降,但基本保持稳定。综上,3株L.thermotolerans菌株生长曲线和乳酸曲线均在第4天达到最大值。

A-生长曲线;B-乳酸曲线图2 三株L.thermotolerans的生长曲线及乳酸曲线Fig 2 Growth curves and lactic acid curves of threeL.thermotolerans
2.4 发酵过程中不同酵母菌生长趋势的变化
乙醇发酵过程中对2种酵母菌生长动态的监测结果见图3,起始接种的菌体细胞浓度均为106CFU/mL,图3-A为单独接种S.cerevisiae的酒样中菌体数量的变化情况,最初菌体数量增长快速,第4天达到最大值107CFU/mL,随后略有下降,直至乙醇发酵结束,其菌体数量稳定在106CFU/mL。图3-B~图3-D为

A-S.cerevisiae纯种发酵生长趋势变化; B-L.thermotolerans1和S.cerevisiae顺序发酵生长趋势变化;C-L.thermotolerans 2和S.cerevisiae顺序发酵生长趋势变化; D-L.thermotolerans 3和S.cerevisiae顺序发酵生长趋势变化图3 供试酒样乙醇发酵中不同酵母菌生长趋势变化Fig.3 Evolution of different yeasts during alcohol fermentation of sample wines
不同L.thermotolerans菌株与S.cerevisiae菌株顺序接种发酵过程中的菌体生长动态。3株L.thermotolerans菌株在发酵过程中菌体生长趋势基本相似,均在1~4 d内生长迅速,并在第4天菌体数量达到最大值为107CFU/mL。在S.cerevisiae菌株接入第2天,随着S.cerevisia菌体数量的增多,L.thermotolerans菌体数量逐渐开始下降,其中LT1菌株(图3-B)和LT2菌株(图3-C)均在第8天消亡,LT3菌株(图3-D)在第9天消亡,而处理组中S.cerevisiae菌体数量在乙醇发酵结束(第11天)依然稳定在106CFU/mL。
2.5 主要挥发性香气化合物的分析
本试验测定了乙醇发酵结束后的各酒样的香气组成,共检测出72种香气物质,其中包括酯类物质30种,高级醇类19种,酸类物质7种,醛酮萜烯类物质12种,其他化合物4种。见表2。

表2 供试酒样挥发性香气成分及含量 单位:μg/L
续表2
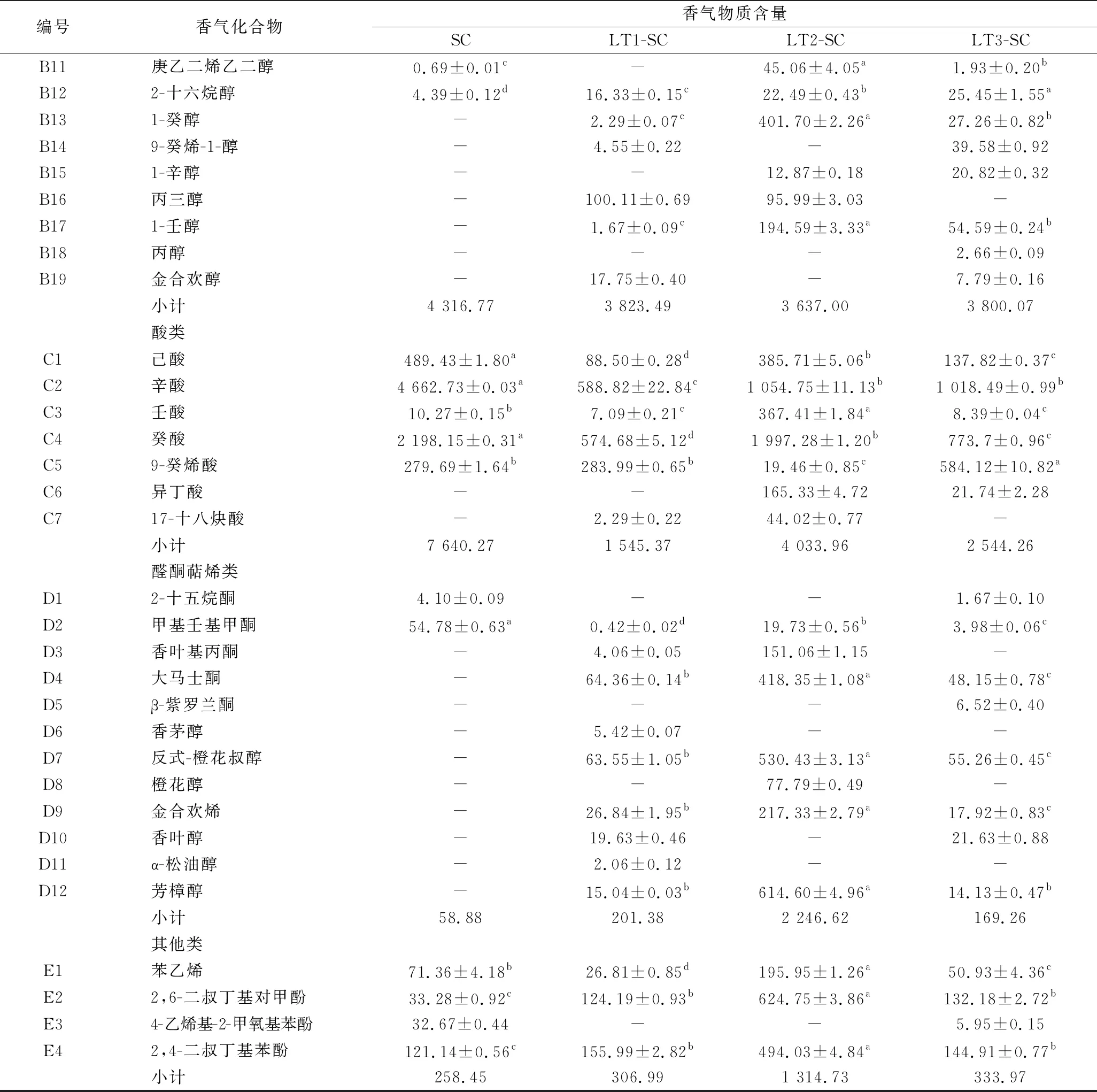
编号香气化合物香气物质含量SCLT1-SCLT2-SCLT3-SCB11庚乙二烯乙二醇0.69±0.01c-45.06±4.05a1.93±0.20bB122-十六烷醇4.39±0.12d16.33±0.15c22.49±0.43b25.45±1.55aB131-癸醇-2.29±0.07c401.70±2.26a27.26±0.82bB149-癸烯-1-醇-4.55±0.22-39.58±0.92B151-辛醇--12.87±0.1820.82±0.32B16丙三醇-100.11±0.6995.99±3.03-B171-壬醇-1.67±0.09c194.59±3.33a54.59±0.24bB18丙醇---2.66±0.09B19金合欢醇-17.75±0.40-7.79±0.16小计4 316.773 823.493 637.003 800.07酸类C1己酸489.43±1.80a88.50±0.28d385.71±5.06b137.82±0.37cC2辛酸4 662.73±0.03a588.82±22.84c1 054.75±11.13b1 018.49±0.99bC3壬酸10.27±0.15b7.09±0.21c367.41±1.84a8.39±0.04cC4癸酸2 198.15±0.31a574.68±5.12d1 997.28±1.20b773.7±0.96cC59-癸烯酸279.69±1.64b283.99±0.65b19.46±0.85c584.12±10.82aC6异丁酸--165.33±4.7221.74±2.28C717-十八炔酸-2.29±0.2244.02±0.77-小计7 640.271 545.374 033.962 544.26醛酮萜烯类D12-十五烷酮4.10±0.09--1.67±0.10D2甲基壬基甲酮54.78±0.63a0.42±0.02d19.73±0.56b3.98±0.06cD3香叶基丙酮-4.06±0.05151.06±1.15-D4大马士酮-64.36±0.14b418.35±1.08a48.15±0.78cD5β-紫罗兰酮---6.52±0.40D6香茅醇-5.42±0.07--D7反式-橙花叔醇-63.55±1.05b530.43±3.13a55.26±0.45cD8橙花醇--77.79±0.49-D9金合欢烯-26.84±1.95b217.33±2.79a17.92±0.83cD10香叶醇-19.63±0.46-21.63±0.88D11α-松油醇-2.06±0.12--D12芳樟醇-15.04±0.03b614.60±4.96a14.13±0.47b小计58.88201.382 246.62169.26其他类E1苯乙烯71.36±4.18b26.81±0.85d195.95±1.26a50.93±4.36cE22,6-二叔丁基对甲酚33.28±0.92c124.19±0.93b624.75±3.86a132.18±2.72bE34-乙烯基-2-甲氧基苯酚32.67±0.44--5.95±0.15E42,4-二叔丁基苯酚121.14±0.56c155.99±2.82b494.03±4.84a144.91±0.77b小计258.45306.991 314.73333.97
注:“-”表示未检测到香气成分。
2.5.1 酯类化合物
酯类物质主要是酵母在乙醇发酵过程中产生的,通常赋予葡萄酒果香,花香,甜香等[11]。由表2可知,本试验共检测出30种酯类物质,在酒中的总含量为7 043.19~25 885.57 μg/L。LT2、LT3顺序接种酒样中酯类化合物的总含量显著高于S.cerevisiae纯种发酵的对照酒样(19 985.48 μg/L),其中LT2酒样中酯类化合物的总含量最高(26 018.54 μg/L),比对照酒样高出30%,其中含量较高的包括肉桂酸乙酯、9-十六碳烯酸乙酯、乙酸苯乙酯、癸酸乙酯、肉豆蔻酸乙酯等;其次是LT3酒样(14 606.75 μg/L),含量较高的包括辛酸乙酯、庚酸乙酯;LT1酒样中酯类含量最少(7 043.19 μg/L),但其中癸酸乙酯、乙酸异戊酯、辛酸乙酯的含量较高。在供试酒样中辛酸乙酯和癸酸乙酯贡献较大,其主要香气特征为果香,这也是霞多丽葡萄酒的主体香气成分[12]。本试验中顺序接种发酵所产生的辛酸乙酯、癸酸乙酯等物质的含量显著高于对照酒样。综上,不同L.thermotolerans菌株对酯类物质的产生有不同的影响。
2.5.2 高级醇类化合物
高级醇类化合物是酵母代谢的次级产物之一,是葡萄酒中主要的香气物质。葡萄酒中的高级醇质量浓度低于300 mg/L时,有助于提高自身的复杂性;当质量浓度超过400 mg/L,杂醇将会作为一个消极的影响因子[13]。本试验共检测出19种高级醇,顺序接种酒样中高级醇含量为(3 637.00~3 800.07) μg/L,比对照酒样(4 316.77 μg/L)下降了12%~16%,3组处理酒样间高级醇含量也存在显著差异。顺序接种酒样中的正丁醇、2,3-丁二醇、1-癸醇、苯乙醇的含量均高于对照酒样,其中苯乙醇、1-癸醇、2-壬醇赋予葡萄酒浓郁的花香和果香,提高香气复杂性。
2.5.3 脂肪酸类化合物
脂肪酸类物质大部分来源于酵母菌代谢的副产物,葡萄酒中通常表现出来的奶酪味以及脂肪味与葡萄酒中存在的脂肪酸密切相关[14]。本试验中共检测出7种脂肪酸,顺序接种酒样中脂肪酸类物质的总含量为1 545.37~4 033.96 μg/L,与对照酒样(7 640.27 μg/L)相比显著降低了46%~80%。在葡萄酒中已报道的脂肪酸有异丁酸、丁酸、异戊酸、己酸、辛酸、癸酸、9-癸烯酸和月桂酸[15],虽然脂肪酸与葡萄酒的不良风味有关,但它们对葡萄酒的香气平衡有着重要作用,并且能抑制对应芳香酯的水解[16]。而本试验共检测出己酸、辛酸、癸酸、9-癸烯酸4种脂肪酸,它们在低浓度时会散发奶酪和奶油的风味,而在高浓度时有腐败和刺激味。本试验中顺序接种酒样中检测到的主要的脂肪酸类物质如己酸、辛酸和癸酸的含量均显著低于对照酒样。
2.5.4 醛酮及萜烯类化合物
萜烯类化合物具有浓郁的香味,其感官阈值较低,是麝香型葡萄及其葡萄酒的典型香气,它赋予了葡萄酒浓郁的品种香气特征。萜烯类化合物属于植物体中由乙酰CoA合成的次级代谢产物,以游离态和无味的糖苷结合态存在于葡萄果实中,葡萄果皮中的含量最高[17]。本试验共检测出12种萜烯类化合物,在酒中总含量为169.26~2 246.62 μg/L,3组顺序接种酒样中醛酮及萜烯类物质含量均显著高于对照酒样(58.88 μg/L)。其中LT2酒样产生的醛酮及萜烯类物质含量最高(2 246.62 μg/L),高出对照组37倍,其中含量较高的有香叶基丙酮、大马士酮、反式-橙花叔醇、橙花醇、金合欢烯、芳樟醇等;其次是LT1酒样(201.38 μg/L),高出对照组2.4倍,其中含量较高的有香叶基丙酮、大马士酮、金合欢烯、香叶醇、α-松油醇。产量最低的为LT3酒样(169.26 μg/L),高出对照组1.9倍,含量较高的有大马士酮、β-紫罗兰酮、香叶醇。
2.5.5 其他化合物
本试验共检测到4种其他香气成分,分别为苯乙烯、2,6-二叔丁基对甲酚、2,4-二叔丁基苯酚、4-乙烯基-2-甲氧基苯酚,顺序接种酒样中各物质总含量由高到低分别为LT2(1 314.73 μg/L)、LT3(333.97 μg/L)、LT1(306.99 μg/L)。
2.6 主要发酵香气的OAV
葡萄酒中的香气物质和香气特征之间有着复杂的联系,OAV可用于评价各风味化合物对酒香气的贡献,超过阈值的香气化合物会对葡萄酒的特征香气产生较大影响[18]。为进一步研究不同L.thermotolerans对葡萄酒具体香气的影响,本试验对已提取的挥发性香气化合物进行了定性定量分析,将各供试酒样中OAV>1的呈香化合物整理成表3,香气阈值[19-21]和香气描述[11,20,22-24]根据相关文献获得。
由表3可知,共有19种挥发性化合物的OAV>1。本文OAV值>1的酯类包括乙酸异戊酯(香蕉味)、肉桂酸乙酯(奶油,草莓)、乙酸苯乙酯(苹果)、癸酸乙酯(水果味)、月桂酸乙酯(甜香、蜂蜡香)和辛酸乙酯(菠萝、梨清香)。其中肉桂酸乙酯(246.05)、癸酸乙酯(33.85)、乙酸苯乙酯(5.89)在LT2酒样中的OAV最大,显著高于对照酒样,尤其是肉桂酸乙酯的OAV相较对照酒样高达4.7倍。OAV>1的高级醇类有2,3-丁二醇(5.90)、1-癸醇(1.00)、2-壬醇(2.11)、苯乙醇(1.02),均在LT2酒样中最大,显著高于其他酒样,赋予了葡萄酒甜香,花香,果香,奶油等气味,LT2酒样所产生的苯乙醇的OAV值最高为1.02,可达对照酒样的1.6倍,苯乙醇由苯丙氨酸代谢产生,可赋予酒体玫瑰花香和蔷薇花香。在脂肪酸类物质中只有己酸,辛酸OAV>1,赋予葡萄酒不愉快的气味(酸臭气味,腐败味等)。本试验中香叶基丙酮、大马士酮和β-紫罗兰酮和芳樟醇在对照酒样中并未检测出,仅在顺序接种酒样中被检测出OAV>1,这些醛酮及萜烯类化合物具有花香、甜果香和紫罗兰等香气,极大地丰富了葡萄酒的风味。其中LT2酒样中香叶基丙酮(2.52)、大马士酮(8.37)和芳樟醇(102.42)的OAV显著高于其他2个处理酒样,LT3酒样中的β-紫罗兰酮(72.44)则最高。这些主要的香气物质使人愉悦,柔和优雅,极大地丰富了口感,对葡萄酒的香气均有非常重要的贡献。

表3 供试酒样中OAV>1香气成分的OAVTable 3 Mean values of OAV for volatile compounds which presented OAV>1 in sample wines
注:“/”表示未检测到香气成分。
2.7 各处理酒样挥发性香气的主成分分析
为直观分析4种酵母菌株乙醇发酵后对霞多丽干白葡萄酒中呈香物质的差异,对检测出各类呈香化合物的含量进行主成分分析。主成分1的方差贡献率达到52.760%,主成分2的方差贡献率为40.627%,二者累积贡献率达到93.387%,能反映样品的风味品质信息。

A-因子载荷图;B-样品分布图图4 香气化合物主成分分析的因子载荷图及香气化合物主成分分析的样品分布图Fig.4 Loadings plot from PCA and score plot from PCA of volatile aroma compounds
图4-A为检测出的香气化合物主成分分析的因子载荷图,图4-B为检测出的香气化合物主成分分析的样品分布图,因子的载荷系数反映了霞多丽干白葡萄酒中各挥发性香气物质对各主成分的影响,相关系数越大,说明主成分对该变量的代表性越强。从图4-A可得出与PC1高度正相关的有棕榈酸乙酯、肉豆蔻酸乙酯、苯乙醇、正丁醇等,其中在图4-B中LT2酒样分布在PC1正半轴,与上述香气特征较接近。而1-戊醇、乙酸异戊酯、肉桂酸乙酯则与PC1高度负相关(载荷系数>0.9),在图4-B中LT1酒样和LT3酒样距离较近,将其聚为一类,与上述香气特征较接近。与PC2高度正相关的有月桂酸乙酯、癸酸-3-甲基-丁酯、辛酸、己酸、癸酸,而2-十六烷醇、辛酸乙酯PC2呈负相关(载荷系数>0.7)。
2.8 感官评价
对4组供试酒样进行感官分析,由图5可知,有L.thermotolerans菌株参与发酵的酒样获得的总体得分比对照酒样高。对于酸味和甜味,3组处理酒样均显著高于对照酒样,这是由于L.thermotolerans本身产较高的乳酸。在澄清度、酒体平衡、异味方面各供试酒样差异不大。而在花香和果香方面,LT2酒样的表现较优于其他2组处理酒样。3组处理酒样在香气强度方面均高于对照酒样。综上,有L.thermotolerans菌株参与发酵的处理组在香气强度、花香、果香、酸味和甜味方面均优于对照酒样,菌株LT2在3组顺序接种酒样中表现最优。

图5 感官分析雷达图Fig.5 Radar map of sensory analysis
3 讨论
近年来研究表明,L.thermotolerans菌株具有中等发酵乙醇的能力,因此需与S.cerevisiae混合发酵完成乙醇发酵[4,25]。有学者研究表明,L.thermotolerans菌株和S.cerevisiae混合发酵时,所产生的生长曲线与乳酸曲线基本一致,即第4天细胞生物量达到最大值,乳酸的产量也达到最大值[26]。也有研究指出,当L.thermotolerans菌株和S.cerevisiae菌株混合发酵,一旦接种S.cerevisiae细胞后,L.thermotolerans菌株的生物量明显降低,这种现象直接关系到乳酸的产生量[27]。本文中3株L.thermotolerans菌株在第4天的生长量及乳酸含量均达到最大,所以本试验采用间隔4天顺序接种模式发酵,使L.thermotolerans菌株在乙醇发酵前期充分发挥增酸作用。L.thermotolerans菌株相较其他非酿酒酵母,是1株高产乳酸的酵母,KAPSOPOULOU等[26]发现L.thermotolerans纯种发酵中L-乳酸产量较高,但也有研究报道指出,在大多数情况下,当L.thermotolerans与发酵力更强的酵母混合接种完成乙醇发酵时,乳酸的产量差异相对较小,这主要取决于与S.cerevisiae混合培养的不同方式[7]。本试验中最高的1株L.thermotolerans产生了2.53 g/L乳酸,虽增加的含量不同,但增加的趋势大致相同。本试验3组顺序接种酒样产生的苹果酸与对照酒样相比降低了21%~24%,有研究表明,L.thermotolerans菌株在乙醇发酵中也可降解L-苹果酸,其含量与对照相比下降了8%~26%[4,26-27],但有些学者的研究中则未出现这些现象[5,28],这可能与L.thermotolerans菌株自身性质有关,但具体原因还需进一步研究。KAPSOPOULOU等[27]利用L.thermotolerans菌株与S.cerevisiae混合发酵发现总酸相比对照增加0.6~5 g/L,而COMITINI等[3]研究发现其总酸增加0.3~2.2 g/L,pH值降低了0.3,这取决于混合接种的策略不同。但在所有的情况下,增加了的总酸和降低了的pH值的原因是因为乳酸的增加比苹果酸降解的影响大得多[29]。L.thermotolerans菌株的增酸效应对于提高温暖产区的低酸度白葡萄汁具有显著效果[1]。本试验中,3株L.thermotolerans菌株顺序接种发酵的酯类物质与对照酒样相比,总含量增加,但有些种类也有降低,这可能与不同L.thermotolerans菌株之间的差异有关。GIL等[30]分析了西班牙马德里产区白葡萄酒和桃红葡萄酒中的香气成分,发现其中辛酸乙酯、己酸乙酯、乙酸异戊酯等比其他酯类的含量更高,而在本试验中也发现辛酸乙酯、肉桂酸乙酯、乙酸苯乙酯等比其他酯类含量较高。有研究报道,L.thermotolerans菌株比S.cerevisiae会产生更少的高级醇[5,27]。本试验研究发现,顺序接种发酵酒样产生的高级醇的总含量明显低于S.cerevisiae纯种发酵。BENITO等[5]观察到涉及L.thermotolerans菌株顺序发酵时,产生的高级醇比S.cerevisiae纯种发酵低了13%,而BALIKCI等[31]也报道了相同的结果。GOBBI等[4]对L.thermotolerans菌株与S.cerevisiae混合发酵进行研究,评估不同的条件对其产生的影响,其结果表明,混合发酵与对照相比产生了大量的2-苯乙醇,2-甲基-1-丁醇和3-甲基-1-丁醇也显著降低。CHEN等[32]报道在L.thermotolerans菌株混合发酵中1-丙醇的含量显著增加,而3-甲基-1-丁醇和2-甲基-1-丁醇显著降低,这可通过L.thermotolerans菌株自身的差异来解释以上原因。BENITO等[1]研究发现,当L.thermotolerans菌株顺序发酵时,萜烯类化合物增加了15%,而这种现象可能与L.thermotolerans菌株中的葡萄糖苷酶的活性密切相关。L.thermotolerans菌株参与发酵的萜烯类总含量显著高于对照酒样,且不同菌株产生的挥发性香气化合物的含量大有不同,这可能与菌株自身特性有关。
4 结论
L.thermotolerans不同菌株和S.cerevisiae以间隔4 d顺序接种方式酿造霞多丽干白葡萄酒,发酵性能良好,基本理化指标符合国标要求,对葡萄酒增酸和提高产品香气质量、感官品质具有积极影响,但不同L.thermotolerans菌株的酿造潜力各不同。L.thermotolerans菌株顺序接种发酵使供试酒样中L-乳酸和总酸含量显著增加,挥发酸显著降低;挥发性香气化合物中脂肪酸乙酯和醛酮及萜烯类化合物的含量显著增多;感官分析表明,顺序发酵使酸度增加,口感清爽,果香、花香味突出,酒体平衡。
