关于离子方程式的一些疑难点解析
2019-10-09■苏怡
中学生数理化(高中版.高考理化) 2019年9期
■苏 怡
离子方程式属于化学核心素养内容中的“证据推理与模型认知”部分,为了更好地培养同学们的这一化学核心素养,现将离子方程式中的一些疑难点进行整合分析如下。
一、书写离子方程式时要记住“六不拆”:难溶物不拆;难电离物不拆;单质、气体、氧化物不拆;弱酸的酸式酸根不拆;微溶物作生成物时不拆;固+固,固+气,气+气反应不拆
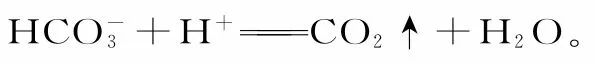
二、书写离子方程式时,浓硫酸不能拆写成离子形式,而浓硝酸、浓盐酸要拆写成离子形式

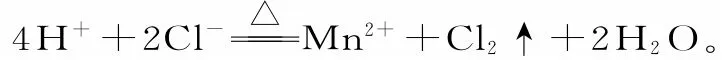
三、微溶物的澄清溶液要拆成离子形式,呈浑浊状态或沉淀时要写成化学式
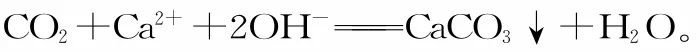
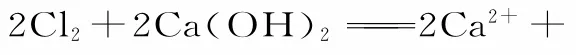
四、氨水作为反应物时写为NH3·H2O;作为生成物,当有加热条件或浓度很大时,写为“NH3↑+H2O”的形式
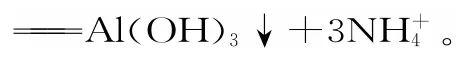
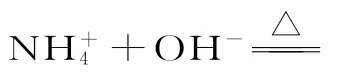
五、酸性氧化物与碱反应涉及的“量”
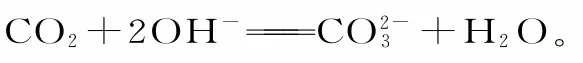

六、试剂的混合顺序不同,引起“量”不同,则离子方程式也不同
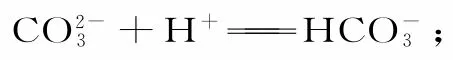

七、酸式盐与碱的反应
(一)若酸式盐与碱的元数相同,则反应只有一种形式,反应产物与各反应物的用量和添加顺序均无关。

(二)若酸式盐与碱的元数不同,反应一般有两种形式,反应产物与元数较小者的用量有关,书写时应遵循“少定多变”的原则,即先将不足量反应物的化学计量数定为“1”,然后调整过量反应物的化学计量数。
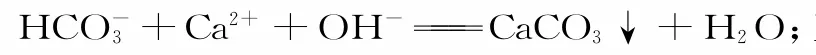
八、与“量”有关的离子方程式的书写

