甘油/碳酸二甲酯酯交换合成碳酸甘油酯的热力学分析
2019-10-08刘振民薛永兵王潇潇王远洋
刘振民,李 斌,薛永兵,王潇潇,王远洋
(太原科技大学化学与生物工程学院,山西 太原 030024)
在生物柴油生产过程中大约会副产质量分数10%的甘油, 快速发展的生物柴油工业已导致越来越严重的甘油过剩局面[1]。 近年来,以甘油为平台化合物生产高附加值的产物引起了国内外研究者的关注[2-3],其中,碳酸甘油酯(GC)作为一种高附加值的甘油下游产物,具有高沸点、低凝固点、低挥发性、低可燃性、强极性、无毒无味、无腐蚀、无污染、与水互溶、生物可降解等特性,可广泛用于涂料、胶黏剂、化妆品的润饰剂以及药物制备中的溶剂和气体分离膜的合成等[4]。
以甘油为原料合成GC的方法主要有CO2法、尿素法和酯交换法等。 CO2法[5]主要以分子筛、离子交换树脂或二丁基氧化锡为催化剂,CO2与甘油在超临界的条件下可直接合成出GC,但是该路线反应条件苛刻,需要使用助溶剂,且受热力学的限制,GC产率较低。 尿素法[6]以路易斯酸为催化剂,需要负压抽出反应生成的氨气来促进甘油的转化,同时该路线存在氨气回收的问题。 酯交换法[7]是由碳酸乙烯酯/碳酸烷基酯与甘油反应合成GC的方法,该路线的甘油转化率高、GC选择性好, 是一条最具有工业化应用前景的工艺路线。 亨斯曼公司以甘油和碳酸乙烯酯为原料,于2009年实现工业化生产,但产物GC和乙二醇的沸点相差较小,分离成本较高。 而甘油与碳酸二甲酯反应制备GC因反应条件温和、操作设备简单,且产物GC和甲醇的沸点相差较小而容易分离提纯等优点而广受青睐。
目前, 国内外对甘油/碳酸二甲酯(DMC)交换合成GC尚处在研究探索阶段, 且关于GC和DMC的基础热力学数据尚无文献报道。 Jiabo Li[8]等采用Benson和R-D基团贡献法结合热力学相关公式,只给出甘油/DMC 酯交换合成GC 反应在298.15K、313.15K、333.15K和353.15K下的平衡常数。康丽娟[1]等采用Benson和ABWY基团贡献法对酯交换反应进行了热力学计算, 但计算过程较简略。 本文采用Benson基团贡献法、Trouton规则、 对应状态法理论以及M-P法对甘油/DMC酯交换合成GC的反应进行了详细的热力学计算和分析, 并采用Aspen 对该反应进行模拟验证,以期对后续实验研究和可能的工业化生产提供一定的理论依据。
1 热力学计算流程
1.1 反应方程式
甘油/DMC酯交换反应合成GC的反应如图式1。

图式1 甘油/DMC酯交换合成GC的反应方程式Scheme 1 Reaction formula of glycerol carbonate synthesis by transesterification of glycerol with DMC
1.2 计算方法
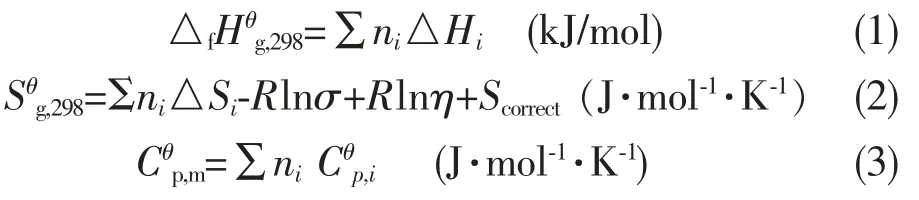
由于Benson基团贡献法给出的是在气态下化合物的生成焓、熵和等压热容,而在反应条件下,反应物均在液相状态下进行化学反应,因此,计算液态下化合物的生成焓和等压热容,需要知道蒸发焓的数据。 蒸发焓也称汽化热或蒸发潜热,它是指同温度下饱和蒸汽和饱和液体的焓差,即饱和液体汽化生成饱和蒸汽焓的变化值。
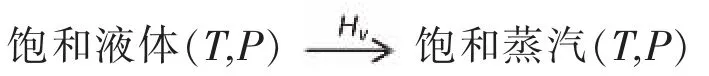
物质的蒸发焓△Hν, 可根据物质的沸点(Tb) 可由Trouton规则计算得到,其计算公式为:

所以,
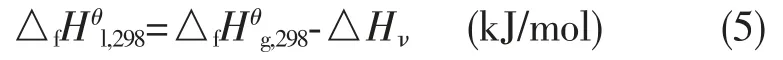


式中:Tr为对应态温度,ω为偏心因子。
1.2.4 反应体系△r和lnKθ与温度T的关系
已知△r, 可根据基尔霍夫定律, 计算出△r(T)~T变化的函数。
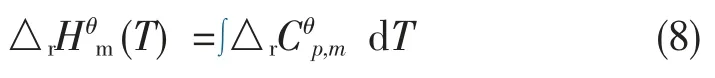
再由范特霍夫(Vant’Hoff)方程式,可计算出lnKθ~T变化的函数。

2 计算过程
2.1 DMC和GC热力学函数△f、△f与、的计算
文献中尚无关于DMC、GC的焓值和熵值的数据,故对酯交换反应进行热力学计算,需要对DMC和GC的焓值和熵值进行估算。
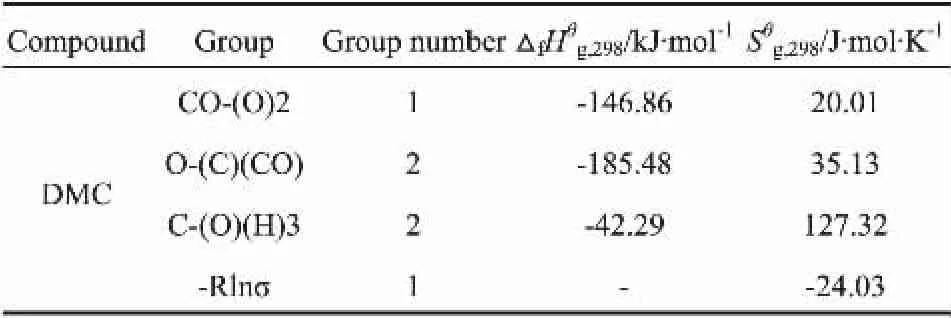
表1 Benson法[10-12]估算DMC的标准生成焓值和熵值Table 1 Standard molar enthalpy of formation and standard molar entropy of dimethyl carbonate estimated by Bensonmethod
利用Benson 基团贡献法求得的气态DMC 的△f为-602.40 kJ/mol,而通过分子力学计算方法,经过优化DMC分子的构型得到DMC的△f为-579.02 kJ/mol,二者较为吻合,说明Benson基团贡献法的准确性较高[13]。 考虑DMC的蒸发焓,根据Trouton规则,按照公式△H=0.088Tb计算,则得到液态DMC的△f为634.37 kJ/mol,与文献值-640.40 kJ/mol基本一致[1]。说明利用Benson基团贡献法和Trouton规则求得的DMC的△f准确度高,且计算过程简便。

表2 Benson法估算GC的标准生成焓和熵值Table 2 Standard molar enthalpy of formation and standard molar entropy of glycerol carbonate estimated by Benson method
通过Benson 基团贡献法,由表2数据可计算出:

根据Trouton规则,△Hν=0.088Tb=55.18 kJ/mol,可进一步得到:

2.2 DMC和GC热力学函数和的计算
要获得反应的热力学性质随温度的变化关系,就需要知道反应体系中各物质的热容随温度的变化关系,甲醇和甘油的热容值随温度的变化可以从数据手册中查询,但DMC和GC的热容值则需要通过热力学估算求得。
Benson 基团贡献法给出的每种基团分别在300K、400K、500K温度下的数值如表3所示。
表3 DMC和GC的Benson 法基团的值Table 3 Heat capacity values of DMC and GC estimated by Benson method

表3 DMC和GC的Benson 法基团的值Table 3 Heat capacity values of DMC and GC estimated by Benson method
?
表4 DMC和GC的~T之间的关系式Table 4 Relationship between heat capacities of DMC and GC and temperature estimated by the corresponding state method

表4 DMC和GC的~T之间的关系式Table 4 Relationship between heat capacities of DMC and GC and temperature estimated by the corresponding state method
?
根据Stermling和Brown提出对应状态法理论,即和之间的关系式计算DMC和GC的, 这里可采用M-P法[14]简便计算DMC和GC的Tc和偏心因子ω,结果见表5。

表5 DMC和GC的Tc和ω值的计算Table 5 Critical temperature and acentric factor of DMC and GC estimated by M-P method

表6 DMC和GC的Cθp,l~T之间的关系式Table 6 Relationship between heat capacities of DMC and GC and temperature estimated by the corresponding state method
3 结果与讨论
3.1 标准状况下反应的焓变、 熵变和吉布斯自由能变以及平衡常数的计算
除了DMC和GC的热力学性质需要估算外,甲醇和甘油的热力学性质可以从化学化工手册中查询得到。

表7 反应物和产物的热力学数据[14-15]Table 7 Thermodynamic data of reactants and products
根据标准状况的数据计算, 可得到以下数据:酯交换焓变△r=10.42kJ/mol, 反 应熵 变△r=124.65 J·mol-1·K-1,反应吉布斯自由能变=平衡常数Kθ=5.05*104。
通过标准状况下的热力学数据计算表明,在101.325kPa,298.15K下,甘油和DMC酯交换合成GC反应的焓变=10.42kJ/mol,表明该反应在此条件下是吸热反应。 从反应的热力学方面考虑,温度升高,平衡向GC生成的方向移动,甘油的转化率增大,故适当提高反应温度可以促进GC的生成;从反应的动力学方面考虑,反应温度升高,提高分子的运动动能, 增加甘油和DMC分子的有效碰撞数,反应速率加快,缩短反应时间;因此,从热力学和动力学两个方面考虑,提高反应温度对甘油的转化率和GC的生成都有促进作用。
在101.325kPa,298.15K下,甘油和DMC酯交换合成GC反应的吉布斯自由能变=-26.85kJ/mol,为负值,表明该反应在标准状况下可自发进行。
3.2 不同温度下反应的、lnKθ及计算
由于标准摩尔生成焓数据来源的限制,常常只能直接计算出298.15K时的标准摩尔反应焓(298.15K)。 从表5和表6中的~T关系式可以计算得到总反应的:

把上式代入到基尔霍夫公式(8)式并进行积分得到:

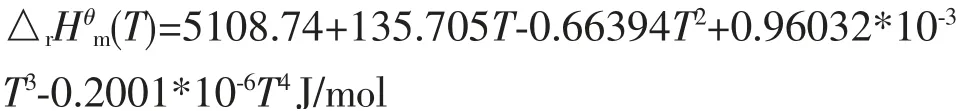
按照范特霍夫(Vant’Hoff)方程式:

总反应的标准平衡常数可由积分求得,即
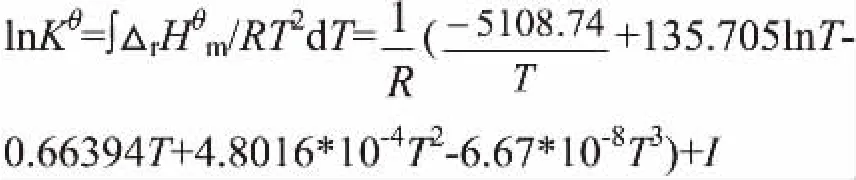
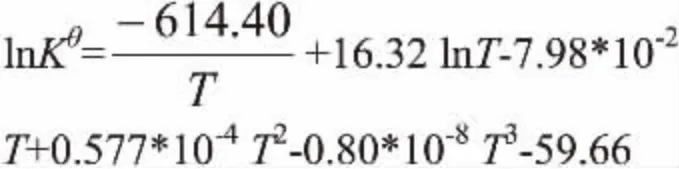

图1 反应焓变随温度变化的关系Fig. 1 Enthalpy change of transesterification reaction vs temperature

图2 反应的吉布斯自由能变随温度变化的关系Fig. 2 Gibbs free energy change of transesterification reaction vs temperature

图3 平衡常数随温度变化的关系Fig. 3 Equilibrium constant of transesterification reaction vs temperature
从图3中lnK~T的关系图中也可以看出, 温度在300~390K范围内反应的平衡常数随温度的增大而增大,也说明升高反应温度有利于反应的进行。
4 Aspen模拟验证
由Asp en 热力学数据模拟得到在298.15K、101.325kPa的条件下,该反应的焓变=13.72kJ/mol;反应吉布斯自由能变= =-30.52kJ/mol,与上述结果相一致,验证了估算的正确性。 进一步还模拟了在101.325kPa、300~400K条件下该反应的焓变和吉布斯自由能变,见表8。
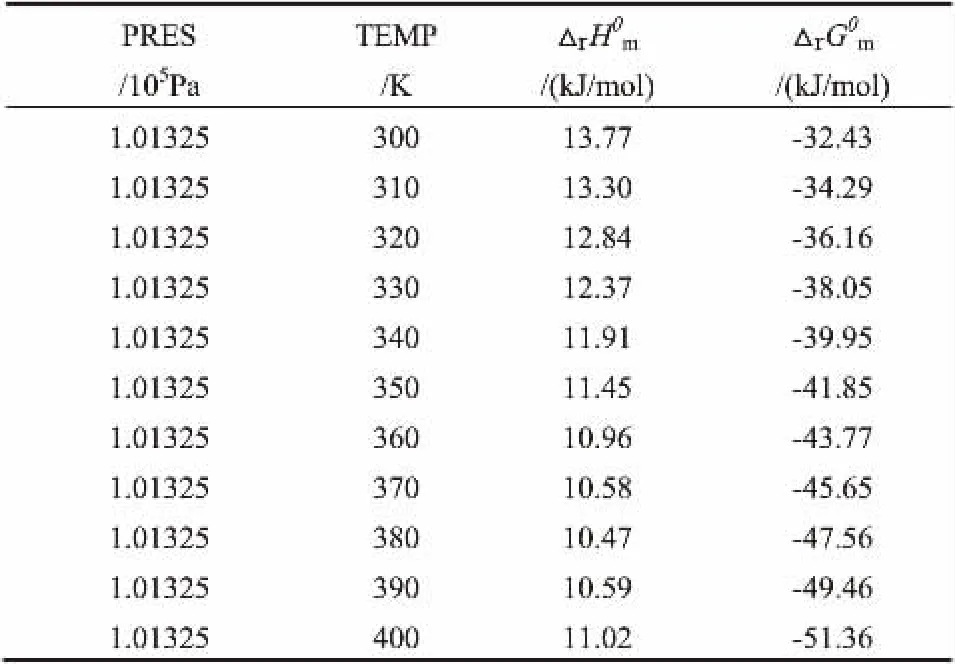
表8 Aspen 模拟该反应的焓变和吉布斯自由能变Table 8 Aspen simulates the reaction in enthalpy and gibbs free energy
由表8可以看出在101.325kPa、300~400K条件下, 该反应的焓变, 反应吉布斯自由能变,说明在此温度范围内,反应为可自发进行的吸热反应,与上述计算结果相一致。
5 结论
本文采用Benson基团贡献法计算DMC和GC的标准摩尔生成焓、 标准摩尔熵和摩尔等压热容,采用Trouton规则计算DMC和GC的蒸发焓。 采用热力学基本公式计算得到标准状态下甘油与DMC酯交换合成GC的焓变=10.42kJ/mol、 熵变=124.65J/(mol·K)、 吉布斯自由能变=-26.85kJ/mol和平衡常数lnKθ=10.83。
在300~390K范围内, 进一步分析该反应的焓变、 吉布斯自由能变和平衡常数随温度的变化关系,分析结果表明,反应的焓变随温度的升高而降低,且其值总是大于零,说明在此温度范围内,该反应为吸热反应,升高温度有利于反应的进行;反应的吉布斯自由能变随温度的升高而降低,且其值总为负值, 进一步表明升高温度有利于反应的进行;反应的平衡常数随温度的增大而增大,也说明升高反应温度有利于反应的进行。 同时,采用Aspen对该反应的热力学数据进行模拟,得到该酯交换反应的焓变为正值、吉布斯自由能变为负值,表明在标准状态下, 酯交换反应为吸热反应且可自发进行,与计算结果相一致。
符号说明
△Hi—基团i的焓值,kJ/mol;△Si—基团i的 熵值,J·mol-1·K-1;—基团i的热容值,J·mol-1·K-1;—反应的焓变, kJ·mol-1;—反应的吉布斯自由能变,kJ/mol;—理想气体的标准摩尔生成焓,kJ/mol;—理想气体的标准摩尔体熵,J·mol-1·K-1;—理想气体的标 准摩尔热容,J·mol-1·K-1;—液体的标准摩尔生成焓,kJ/mol;—液体的标准摩尔熵,J·mol-1·K-1;—液体的标准摩尔热容,J·mol-1·K-1;△Hν—化合物的蒸发焓,kJ/mol;Tb—化合物的沸点,K;Tc—化合物的临界温度,K;ω—偏心因子;Kθ—平衡常数;δ—对称数;η—对映(光学)异构体;Scorrect—化合物熵值的环式修正值,J·mol-1·K-1。
