超声“萤火虫”成像鉴别诊断乳腺占位病变
2019-10-08谭荣,张英,唐奇,袁圆
谭 荣,张 英,唐 奇,袁 圆
(长沙市第一医院超声诊断科,湖南 长沙 410005)
乳腺癌是中国女性发病率最高的恶性肿瘤疾病[1],多来源于导管且常伴有微钙化,故分析微钙化对于鉴别乳腺良恶性疾病具有重要价值[2]。常规乳腺X线摄影术(mammography, MMG)能够发现可疑微钙化,是最常用的乳腺疾病筛查方法之一,但存在辐射损伤。超声检查对于诊断可疑微钙化具有一定价值[3],而传统成像模式无法满足临床需要。“萤火虫”成像(micropure imaging, MI)是超声成像新模式,去除了斑点噪声,并以蓝色图像覆盖周围组织,使表现为强回声点的微钙化灶较传统超声更为明显,有助于定位病灶及鉴别乳腺良恶性肿块[4]。本研究探讨MI鉴别诊断乳腺良恶性病变的临床应用价值。
1 资料与方法
1.1 一般资料 选取2014年1月—2017年3月于我院就诊的女性乳腺占位病变患者134例,年龄17~88岁,平均(47.8±14.7)岁;肿块最大径0.56~6.68 cm,平均(2.68±1.34)cm。排除怀孕、哺乳期女性以及有放射治疗或化学治疗史者。本研究经长沙市第一医院伦理评审委员会批准,患者均对研究内容知情同意。
1.2 仪器与方法 对所有患者于入院后先行乳腺超声扫查,记录分屏模式下MI所示微钙化灶(强回声点)的数量和分布(图1A),并在皮肤表面定位肿块及微钙化位置,而后行MMG检查。
采用Aplio 400型彩色多普勒超声诊断仪,L14-5线阵探头,频率5~14 MHz。乳腺超声扫查均采用轻度压迫,所有图像均需显示胸肌,以确保整个乳腺均获扫查。采用Selenia Performance Digital MMG system (Hologic, HAWK-2MSDR),获得标准乳腺内外侧斜位(mediolateral oblique, MLO)和头足位(craniocaudal, CC)MMG(图1B、1C)。由5年及以上工作经验的1名放射科医师和1名超声科医师分别盲读MMG和MI图像,计数每平方厘米病灶内钙化点数/强回声点数(钙化点及强回声点均认为是微钙化灶)。以“少量”“散在”“簇状”或“线性”描述微钙化分布。少量:病灶内出现1个或无钙化点/强回声点;散在:病灶内出现2个钙化点/强回声点;簇状:病灶内出现≥3个钙化点/强回声点;线性:病灶内出现≥3个钙化点/强回声点且呈线样分布。
参考2013年版乳腺影像报告和数据系统(breast imaging reporting and data system, BI-RADS)对病变进行分级[5],BI-RADS Ⅱ级、BI-RADS Ⅲ级为良性病变,BI-RADS Ⅳ级、BI-RADS Ⅴ级提示恶性。
1.3 活检及病理检查 对最大径<3 cm的病灶采用麦默通微创旋切系统(Johnson & Johnson Corp, New Brunswick, NJ)微创切除;对最大径≥3 cm的病灶行传统手术切除。上述操作均由具有5年及以上工作经验的外科医师完成。将乳腺肿块标本以10%多聚甲醛固定,石蜡包埋,每隔20~30 mm行4 mm厚切片,常规HE染色(图1D)。病理诊断均由1名具有20年工作经验的病理科医师完成,参照WHO乳腺肿瘤分类标准[6]给出最终病理结果。
1.4 统计学分析 采用SPSS 19.0统计分析软件。以术后病理结果作为诊断金标准,采用ROC曲线评价MMG、MI对乳腺恶性病变的诊断效能。P<0.05为差异有统计学意义。
2 结果
肿块位于左乳外上象限38例,左乳外下象限15例,左乳内上象限10例,左乳内下象限5例;右乳外上象限32例,右乳外下象限18例,右乳内上象限8例,右乳内下象限8例。MMG示脂肪型乳腺1例,少量腺体型乳腺10例,中量腺体型乳腺34例,多量腺体致密型乳腺89例。病理诊断良性85例、恶性49例。MI正确诊断良性82例、恶性44例,MMG正确诊断良性69例、恶性34例。病理诊断微钙化100例(100/134,74.63%),良性66例、恶性34例。恶性病变中,MMG显示微钙化47例,MI为39例;良性病变中,MMG显示微钙化58例,MI为80例;见表1。

图1 患者女,56岁,高级别导管原位癌 A.分屏模式MI示左乳2点方位强回声点,与MMG所示微钙化位置一致; B、C.MLO位(B)和CC位(C)MMG示不均匀致密乳腺伴簇状微钙化(箭); D.病理示病变组织见恶变的伴核坏死的导管上皮细胞(HE,×40)
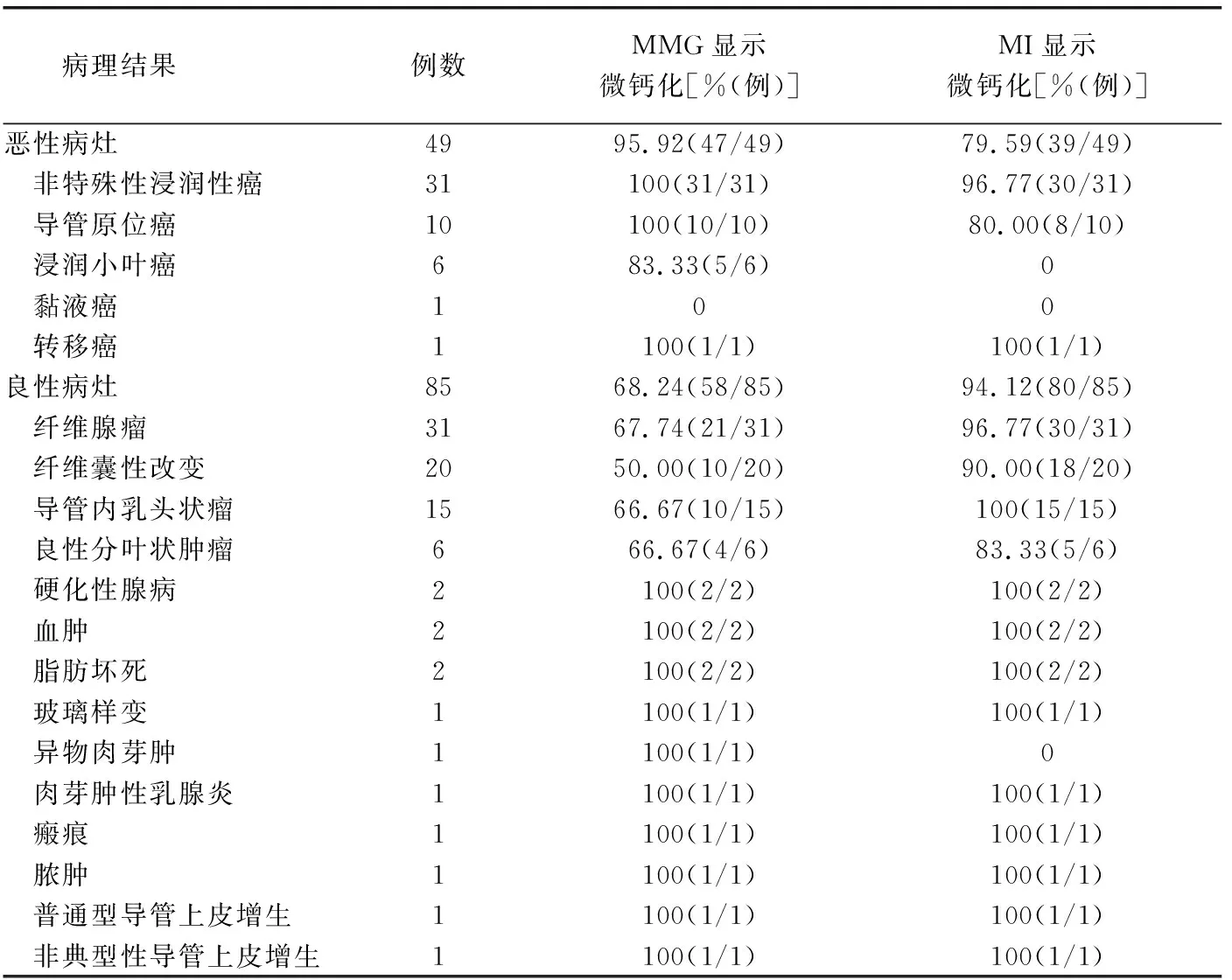
表1 MMG、MI显示微钙化与病理结果对照
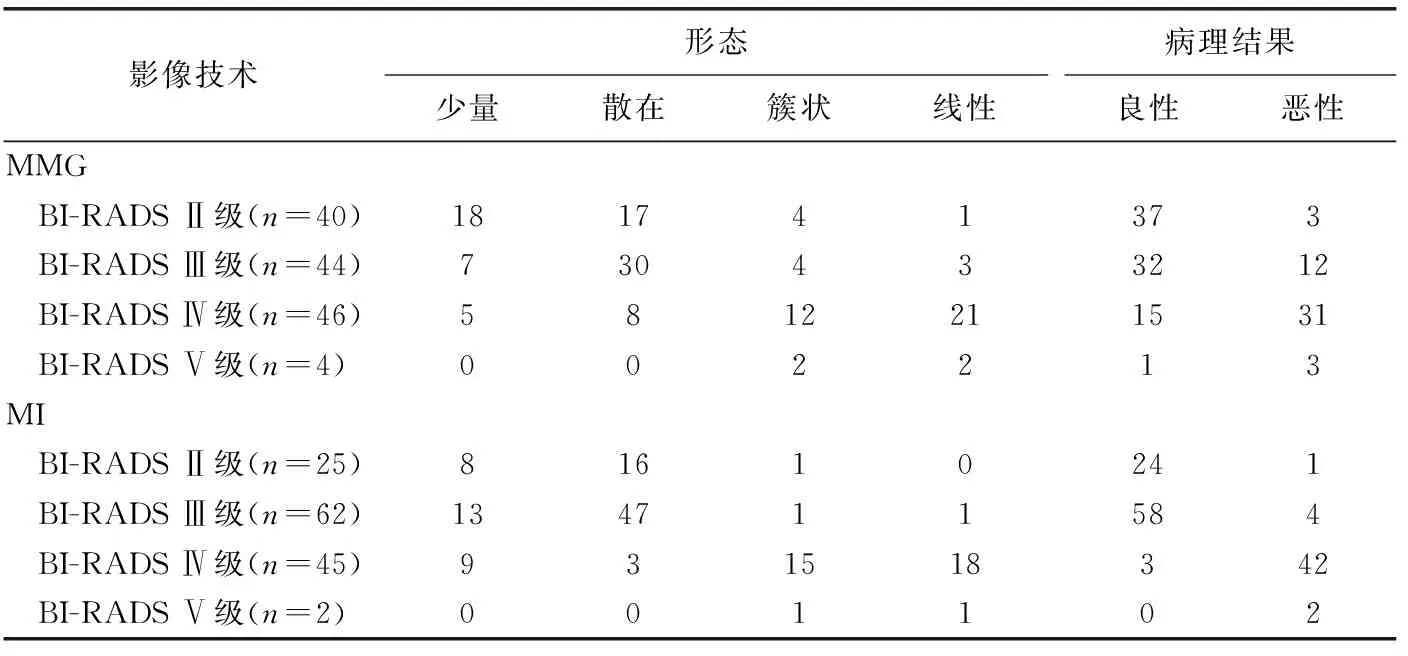
表2 MMG、MI所示不同BI-RADS分级微钙化的形态及病理结果(例)
MI显示微钙化119例(119/134,88.81%),误诊19例,其中纤维化或玻璃样变9例,微血栓7例,原因不明(病理医师未找到相应组织)3例;MMG显示微钙化105例(105/134,78.36%),误诊5例,其中纤维化2例,原因未明(病理医师未找到相应组织)2例,手术缝线造成的异物肉芽肿1例。
簇状和线性分布的微钙化更倾向于恶性病变;BI-RADS Ⅱ级、BI-RADS Ⅲ级病变更多表现为少量或散在分布的微钙化,BI-RADS Ⅳ级、BI-RADS Ⅴ级病变则更多表现为簇状或线性分布;见表2。
ROC曲线结果显示,以MMG所示每平方厘米病灶内存在5个钙化点为截断值,诊断恶性病变的AUC为0.64(P=0.01),敏感度69.39%(34/49),特异度81.18%(69/85),准确率76.87%(103/134),阳性预测值68.00%(34/50),阴性预测值82.14%(69/84);以MI所示每平方厘米病灶内存在3个强回声点为截断值,诊断乳腺恶性病变的AUC为0.76(P<0.01),敏感度89.80%(44/49),特异度96.47%(82/85),准确率94.03%(126/134),阳性预测值93.62%(44/47),阴性预测值94.25%(82/87);见图2。

图2 MMG、MI诊断乳腺恶性病变的ROC曲线
3 讨论
乳腺钙化形成机制复杂。引起乳腺钙化的因素较多,如肿瘤组织变性、导管内癌坏死及微血管钙化等。微钙化是判断乳腺良恶性疾病的独立危险因素。因此,一些影像学检查方法通过凸显微钙化来鉴别诊断乳腺良恶性病变[7]。MMG根据钙化灶大小、形态、数量和分布对乳腺病变进行识别和分类,其中微钙化灶的数量和分布对其鉴别乳腺良恶性病变具有重要作用;但其所示钙化点并非均为微钙化,亦可能为纤维化或异物,错误描述可能导致病变被误诊为恶性。本研究发现MMG对于恶性病变微钙化显示率高于MI,而对良性病变微钙化的显示率低于MI,原因可能在于二者成像原理不同:MI图像中可能存在较MMG更多的易被误认成分,且仅突出显示最大径小于0.5 mm的微钙化,如果介质声阻抗差异不明显,则MI很难识别小的病灶。本研究中,MI误诊微钙化19例(纤维化或玻璃样变9例、微血栓7例、原因不明3例),MMG仅误诊5例(纤维化2例、原因未明2例、手术缝线造成的异物肉芽肿1例)。MI判断微钙化取决于观察对象显示的回声强度,声速大的物质声阻抗高、回声强,纤维化、玻璃样变及微血栓和手术异物在声像图上均与钙盐相似,具有较高的声速值,故其回声较周边组织更高,MI显示为类似微钙化的强光点,难以鉴别。
MI虽然在显示病灶方面未能克服传统超声的局限性,却可抑制不必要的信息而突出有意义的微钙化,其易将纤维化、玻璃样变或微血栓形成等误诊为微钙化,但上述改变通常存在于传统超声易于识别的纤维囊性变中,故MI在分屏模式(左侧为传统超声,右侧为蓝色叠加图像,图1A)下更易鉴别存在微钙化的良恶性病灶。本研究ROC曲线结果显示,以MI所示每平方厘米病灶内存在3个强回声点为截断值,诊断乳腺恶性病变的AUC为0.76、敏感度89.80%(44/49),特异度96.47%(82/85),准确率94.03%(126/134);而以MMG所示每平方厘米病灶内存在5个钙化点为截断值,诊断恶性病变的AUC为0.64,敏感度69.39%(34/49),特异度81.18%(69/85),准确率76.87%(103/134),提示MI对乳腺良恶性病变的诊断效能高于MMG。本组患者中致密乳腺多达91.79%(123/134),致密乳腺包括BI-RADS分级中量腺体和多量腺体两类,如果乳腺腺体不均匀或极度致密,小肿块在MMG中可能显示不清。临床实践中可先参考传统超声区分囊肿和实质性病变,而后选择MI模式,将实质性病变伴随的微钙化凸显出来,以增加诊断恶性病灶的准确率[8-9]。此外,并非所有乳腺占位性病变均含有微钙化,本组134例乳腺占位病变,存在微钙化的病例占74.63%(100/134)。因此,常规超声鉴别乳腺良恶性病变不仅依靠MI显示的微钙化,还应结合其他声像图表现,并应尽可能联合应用多种超声模式,以减少或避免误诊[10-11]。
本研究还发现,MMG、MI所示微钙化分布对诊断恶性病变亦有一定临床价值。乳腺浸润性导管癌是乳腺癌的最常见类型,坏死灶及钙盐沉积多沿导管腔内分布或聚集在小分叶内呈灶性分布[12],使得乳腺恶性病灶的微钙化在形态学上多呈簇状或线性分布。美国放射协会制定的BI-RADS分级参考了钙化灶形态和分布的特点,簇状或线性分布的微钙化提示病变的BI-RADS级别更高。
综上所述,MI和MMG所示微钙化的数量及分布均有助于鉴别诊断乳腺良恶性病变,MI的诊断效能更高。但本研究样本量小,研究对象多为致密乳腺,且微钙化并非乳腺癌的特异征象,有待进一步完善。
