抑制α-葡萄糖苷酶活性乳酸菌筛选与鉴定
2019-10-08谢玉锋韩雪梅路福平
谢玉锋,韩雪梅,路福平*
(1.省部共建食品营养与安全国家重点实验室,天津科技大学生物工程学院,天津 300457;2.哈尔滨学院食品工程学院,哈尔滨学院食品生物技术重点实验室,黑龙江 哈尔滨 150086)
【研究意义】α-葡萄糖苷酶是评价糖尿病的重要指标,糖尿病是一种以血糖量偏高为特征的可以导致以糖代谢为主的糖、脂肪和蛋白质物质的一种代谢紊乱综合症[1-2]。是一种不能彻底治愈的疾病,一般以缓解病情为主,目前,糖尿病预防和治疗主要依赖于药物治疗,但目前药物治疗通常易发生胰岛素过敏、耐药性等副作用,对肝、肾等器官损伤也较为严重[3-5],因此有效的糖尿病管理策略是最重要的。通过抑制α-葡萄糖苷酶活性,从而可以减缓肠道生成葡萄糖的速度,缓解餐后血糖上升症状和高胰岛素血症,同时还可改善糖耐受量,从而预防和治疗糖尿病及其并发症。因此通过克服α-葡萄糖苷酶活性表达以达到对糖尿病患者保健作用的研究也得到了广泛关注。【前人研究进展】乳酸菌作为世界公认的可安全使用的微生物,已经用于多种发酵食品的加工。国内外在研究乳酸菌降血糖有很多涉足。范文娅等[6-8]研究表明,乳酸菌对有效抑制α-葡萄糖苷酶活性,缓解糖尿病具有非常重要的意义。Otieno等[9-11]研究结果表明,乳酸菌发酵大豆制品具有预防心脑血管疾病,降低血脂和血糖的功能。因此,乳酸菌在糖尿病中的应用和研究已成为糖尿病新的研究热点。开发具有α-葡萄糖苷酶抑制活性、保健功能、有一定降糖效果的日用功能性产品非常有必要。【本研究切入点】本研究拟从传统发酵食品中分离筛选具有抑制α-葡萄糖苷酶活性特性的乳酸菌。对其进行菌种鉴定及对α-葡萄糖苷酶抑制活性进行检测,将其应用于发酵豆浆产品并进行α-葡萄糖苷酶抑制活性验证。【拟解决的关键问题】以期得到能缓解糖尿病的日用功能性食品。
1 材料与方法
1.1 材料与仪器
1.1.1 材料 传统发酵食品(酸粥、奶豆腐、大酱、酸菜、酸面团);RCM培养基;MRS培养基;TaqDNA聚合酶、α-PNPG、DNA Marker、细菌基因组提取试剂盒、α-葡萄糖苷酶。
1.1.2 仪器与设备 TCL-12 台式高速冷冻离心机(Sigma),SHA-B水浴恒温振荡器(江苏国华仪器厂),SCD-II型高纯水装置(Millipore),HH-B11-420型电热恒温培养箱(上海智城),PTC-200型PCR基因扩增仪(Eppendorf),全自动凝胶成像仪(SYNGENE),SP-2012UV型紫外可见分光光度计(北京普析仪器),NanoDrop(Thermo),光学显微镜M102(Motic),超低温冰箱(Forma Scientific)。
1.2 实验方法
1.2.1 乳酸菌分离筛选 富集培养:称取1 g样品(或液体1 mL),直接加入到无菌的10 mL RCM富集培养基中,37 ℃富集培养24 h。
平板初筛:采用十倍稀释倾注法[12]实验操作后于37 ℃条件下培养48 h,观察,挑取溶钙圈较大的单菌落进行3次划线分离纯化。
抑制α-葡萄糖苷酶乳酸菌筛选:将初筛菌种接入RCM液体培养基中增殖,取出100 μl加于酶标板中,再向酶标板中加入0.2 U/mL的α-葡萄糖苷酶100 μl,37 ℃温育10 min,点接于含α-PNPG的平板培养基培养,选择菌落周围形成黄色色泽较浅的菌株进行编号,初步筛选出抑制α-葡萄糖苷酶活性的乳酸菌菌株。
复筛:将编号菌株接入MRS液体培养基中,37 ℃培养24 h,再转入MRS液体培养基中同等条件下培养,当乳酸菌种达到稳定期的时候,离心培养液,取离心后的上清液进行α-葡萄糖苷酶抑制酶活力的测定,进行3次平行实验,取其平均值,通过α-PNPG与α-葡萄糖苷酶作用显色后在405 nm处光吸收的比较,进一步确定能较强抑制α-葡萄糖苷酶酶活的乳酸菌菌株。
1.2.2 乳酸菌的鉴定 16S rDNA测序分析:采用 16S rDNA 检测与 Biolog 检测结合作为菌株鉴定手段。16S rDNA 扩增使用引物V3-4F和V3-4R,委托上海派森诺公司测序,测序结果在GeneBank中对比分析。
乳酸菌形态学和生理生化鉴定:菌株的生理生化鉴定参照《常见细菌鉴定手册》[13]。
1.2.3 乳酸菌特性分析 乳酸菌生长曲线的测定:将经活化后的乳酸菌按10 %(v/v)的接种量接入到装有100 mL MRS培养基的锥形瓶中,放置于恒温恒湿培养箱中,温度控制在37 ℃。每2 h取样测OD600值。
乳酸菌活菌计数:将发酵后的酸豆浆用无菌生理盐水进行适当稀释,然后采用十倍稀释倾注法计数。
体外模拟耐胃酸实验[14]:将活化后的乳酸菌按 10 %(v/v)的接种量接种于pH 2.0和pH 3.0的 MRS液体培养基中,37 ℃分别培养0和2 h 后,用十倍梯度稀释法稀释后倾注处理进行菌落计数,计算乳酸菌存活率。

(1)
体外模拟耐胆盐实验:将活化后的乳酸菌按 10 %(v/v)的接种量接种于含0.3 %牛胆酸钠的 MRS 液体培养基中,37 ℃分别培养0 和4 h 后,用十倍梯度稀释法稀释后倾注处理进行菌落计数,计算乳酸菌存活率。

(2)
1.2.4 α-葡萄糖苷酶活性抑制分析 将冻干样品用少量DMSO溶解,用0.1 mol/L pH 6.8磷酸钾缓冲液稀释定容。取不同浓度的稀释样品50 μl,加入50 μl α-葡萄糖苷酶(以0.1 mmol/L pH 6.8磷酸钾缓冲液溶解稀释)在37 ℃下温育5 min,再加入30 μl 0.2 mmol/L α-PNPG(以0.1 mol/L pH 6.8磷酸钾缓冲液稀释),37 ℃条件下培养30 min,最后加入100 μl 0.1 mol/L pH 9.8的碳酸钠溶液终止反应,在波长为405 nm下测定吸光度。以阿卡波糖做为IC50对照,同时设立阴性对照和阳性对照。
α-葡萄糖苷抑制率=
(3)
2 结果与分析
2.1 乳酸菌的分离筛选
2.1.1 乳酸菌平板分离筛选 由图1显示,在筛选平板上挑选有较大溶钙圈的单菌落 46个,经3次3区划线分离出单菌落,培养基活化培养后保存于20 %甘油中,置于-80 ℃冰箱,以上述菌株为原始菌株,进行进一步实验。
2.1.2 α-PNPG筛选平板筛选 通过α-PNPG筛选平板筛选,共选出8株黄色色泽较浅的菌株,通过观察各菌株发现,1-1号乳酸菌菌株菌落色泽最浅。
将8株菌株进行三角瓶发酵复筛,经37 ℃发酵培养24 h,将上清培养液与α-葡萄糖苷酶温育,加入α-PNPG反应30 min,在405 nm 下进行OD值测定,OD值见表1。得到OD相对较低的菌株1-1,和平板初筛结果相一致。将菌株1-1保存菌种,进行菌种鉴定和进一步发酵特征研究。
2.2 乳酸菌的鉴定
2.2.1 菌株1-1形态学特征 由图2显示,菌株1-1在琼脂培养基上形成表面光滑湿润、微微隆起状、色乳白、呈圆形的菌落;镜检下菌体呈杆状,革兰氏染色呈阳性。
2.2.2 菌株1-1生理生化特征 在菌种鉴定中,应用最广泛的是分子生物学技术中的16S rDNA序列同源性分析,而表型实验以生理生化实验为主要显形。检测细菌生理生化反应可以了解其对自然界中营养物质分解利用特性,细菌代谢类型的差异反映了细胞内酶系统的差异,因此,生理生化反应成为细菌分类鉴定的重要依据之一。如表2所示,表中特征与文献[15]中描述的副干酪乳杆菌特征相同,初步将菌株1-1化为副干酪乳杆菌。2007年副干酪乳杆菌直接划分为干酪乳杆菌菌群[16]。

图1 乳酸菌平板初筛Fig.1 Plate selection method for lactic acid bacteria
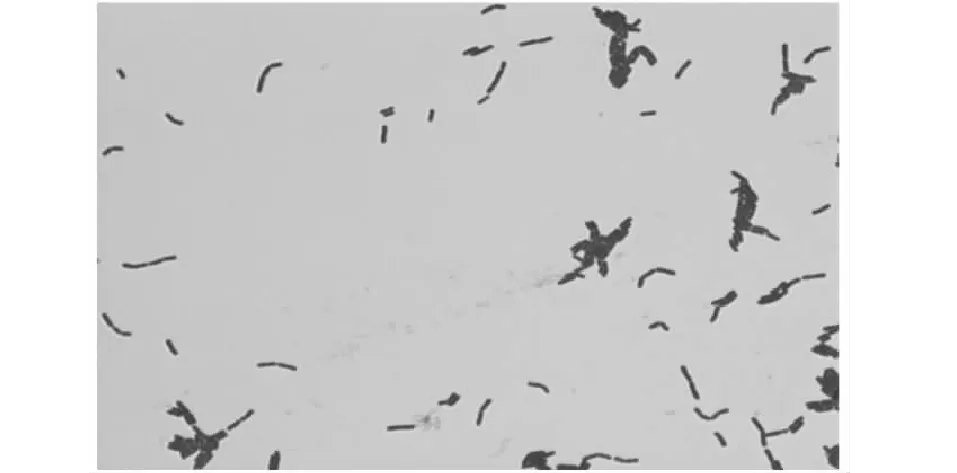
图2 菌株1-1的菌体形态(10×100)Fig.2 Mycelial morphology of strain 1-1

鉴定项目结果鉴定项目结果碳源利用氮源利用D-葡萄糖+蛋白胨+棉籽糖-牛肉膏+果糖+酵母粉+乳糖+硝酸铵+麦芽糖+硫酸铵+D-甘露糖+氯化铵+D-木糖-精氨酸-纤维二糖+脲+生理生化反应 酶反应明胶液化-接触酶-H2S生成-蛋白酶+联苯胺反应+脲酶+
注:“+”代表结果呈阳性,“-”代表结果呈阴性。
2.2.3 菌株1-1分子生物学鉴定 由图3显示,取扩增反应完毕后的 PCR 产物 2 μl,加样品于0.8 %琼脂糖凝胶点样孔中进行电泳,电泳液为 1×TAE。电泳后,用溴化乙锭溶液染色(3~5 min),在紫外凝胶成像仪下观察并拍照,在250~500 bp之间出现了长度约为480 bp条带的琼脂糖凝胶电泳图。
将 PCR 产物送到上海派森诺生物测序公司测序,利用 BLAST软件鉴定其种属。
由图4可以看出,应用BLAST功能将序列与GenBank中已有的16s rDNA序列进行相似性比对并构建系统进化树,菌株1-1与菌株L.paracaseiN1115的相似性为99 %。因此,结合菌株1-1菌落、菌体形态和生理生化实验结果,可以鉴定菌株1-1为副干酪乳杆菌,并命名为L.paracaseiTK1501,将该菌株保于中国微生物菌种保藏中心,编号为CGMCC13130。

M:DNA marker;1:菌株1-116S rDNA PCR产物图3 16S rDNA的PCR扩增产物Fig.3 Production of 16S rDNA amplification by PCR

图4 菌株1-1的系统进化关系图Fig.4 Phylogenetic tree of strain 1-1
2.3 乳酸菌特性分析
2.3.1 乳酸菌生长曲线的测定 由图5可以看出,按照实验方法测定OD600,以培养时间为横坐标,以对应的菌体的生物量(吸光度)为纵坐标,绘制得到了L.paracaseiTK1501的生长曲线。
L.paracaseiTK1501的生长规律为:延滞期为0~4 h,对数生长期为4~16 h,自16 h开始,菌体进入稳定期。
2.3.2 乳酸菌活菌计数 按照实验方法进行L.paracaseiTK1501的活菌计数,活菌数可达8.9×108CFU/mL。
2.3.3 体外模拟耐胃酸实验 从表3显示,按照实验方法进行L.paracaseiTK1501的体外模拟耐胃酸实验。
正常情况下,胃液pH 1.3~1.8,饭后胃液被稀释,pH值可上升至3.5。人体食用的食物通过胃的时间一般在1~2 h。胃液中的胃酸能抑制或者杀死进入胃中的微生物。酸度越大,对菌体的抑制作用越明显。L.paracaseiTK1501在模拟胃酸环境下存活率较高,在pH 3.0时达到84.93 %,符合作为益生菌的基本特性。

图5 L.paracasei TK1501生长曲线Fig.5 Growth curve of L.paracasei TK1501
Table 3 Resistance ofL.paracaseiTK1501 to simulated stomach acid

pH胃液pH 2.0pH 3.0时间(h)0 2 0 2 活菌数(lg CFUmL-1)8.21±0.354.66±0.208.23±0.236.99±0.27存活率( %)56.76 84.93
2.3.4 体外模拟耐胆盐实验 从表4显示,按照实验方法进行L.paracaseiTK1501的体外模拟耐胆盐实验。
胆盐(Bile salt)是由肝细胞分泌的胆汁酸与甘氨酸或牛磺酸结合而形成的钠盐或钾盐。人体中胆汁含有75 %的甘氨胆酸钠和25 %的牛磺胆酸钠。人体小肠的胆盐浓度一般在0.03 %~0.3 %,可以在细胞外产生高渗透压,对菌体细胞造成影响。据了解,胆盐的毒性作用对细胞膜和DNA都有一定程度的损伤。L.paracaseiTK1501在模拟胃胆盐0.3 %环境下存活率达到80.59 %,符合作为益生菌的基本特性。
2.4 α-葡萄糖苷酶活性的抑制作用分析
按实验方法1.2.4 中的方法测定经L.paracaseiTK1501发酵豆浆前后样品对α-葡萄糖苷酶活性的抑制作用。
由图6可知,L.paracaseiTK1501发酵豆浆在其测试浓度范围内均对α-葡萄糖苷酶有一定的抑制作用,并且随着发酵豆浆产物提取液浓度增大,其α-葡萄糖苷酶活性抑制也随之增大,当发酵产品提取液浓度为10 mg/mL时,发酵样品对α-葡萄糖苷酶活性抑制率为85.38 %,高于未发酵空白对照70.35 %,发酵豆浆产品抑制α-葡萄糖苷酶的IC50为1.88 mg/mL,而同等条件下的降糖药物阿卡波糖的IC50为0.40 mg/mL。未发酵的空白对照为2.37 mg/mL。

表4 L.paracasei TK1501在模拟胆盐环境中的耐受性

图6 α-葡萄糖苷酶活性抑制图Fig.6 α-glucosidase inhibitory activities
3 讨论与小结
采用α-PNPG平板初筛和三角瓶发酵复筛,从传统发酵食品样品中分离筛选到一株具有抑制α-葡萄糖苷酶酶活特性的副干酪乳杆菌。通过发酵豆浆对抑制α-葡萄糖苷酶活性进行验证发现发酵豆浆产品对α-葡萄糖苷酶活性有较好的抑制作用,这可能是因为在发酵过程中L.paracaseiTK1501将豆浆中的某些大分子物质降解产生小分子的生物活性更强的降血糖成分[17-19]。对于糖尿病患者来说,抑制α-葡萄糖苷酶活性可以缓解其病症。服用α-葡萄糖苷酶抑制剂后可以使得糖吸收面积减少,吸收时间后延,从而对降低餐后高血糖有益, 在长期使用后亦可降低空腹血糖, 估计与提高胰岛素敏感性有关。
对该副干酪乳杆菌作为益生菌的基本特性进行了检测,在模拟胃酸pH 3.0和胆盐0.3 % 的环境下存活率分别达到84.93 % 和80.59 %,有较强的耐酸和耐胆盐能力,其具有作为益生菌的基本特性。
