美丽箬竹和菲白竹根系呼吸与抗氧化系统对水淹的响应
2019-09-30沈莉娟冯嘉雨雷佩雯干诗颖张汝民高培军
沈莉娟,冯嘉雨,雷佩雯,干诗颖,张汝民,高培军
(浙江农林大学 省部共建亚热带森林培育国家重点实验室,浙江 杭州311300)
随着全球气候变暖,季节性降水使洪涝灾害频现[1],特别是河流坡岸湿地及低矮地区水淹情况尤为严重。植物耐水淹抗性与活性氧的清除、厌氧代谢和碳水化合物的累积有关[2]。水淹、缺氧等非生物胁迫条件下,植物体内产生过量活性氧(ROS),会引起膜脂过氧化,产生丙二醛(MDA),损伤细胞完整性[3]。细胞内外ROS的积累诱导大量活性氧清除酶[4],包括超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)[5],减轻活性氧自由基的损伤[6]。Wu L等[7]研究发现烟草(Nicotiana tabacum)干旱、寒冷、盐和脱落酸处理下SOD酶活性增强;马丽峰等[8]对水稻(Oryza sativa)研究发现水淹胁迫导致体内SOD和POD酶活性呈先升高再降低的趋势,CAT酶活性持续增加;孙小艳等[9]对北美鹅掌楸(Liriodendron tulipifera)耐淹性研究发现SOD和POD酶活性持续增加。水淹也易导致根系缺氧,产生的乳酸使细胞内PH值降低,丙酮脱羧酶(PDC)与乙醇脱氢酶(ADH)可缓解细胞酸中毒导致的细胞死亡[10]。Sairam R K等[11]对缺乏ADH基因的玉米(Zey mays)研究发现缺氧胁迫导致玉米植株迅速死亡;陈强等[12]对甜樱桃(Prunus avium)研究发现水淹胁迫促进无氧呼吸酶ADH和PDC活性升高。
非结构性碳水化合物提供能量供应参与生命代谢[13],可溶性糖可作为渗透剂或抗氧化剂[14-15]。Das K K等[16]研究发现水稻在胁迫条件下存活依靠碳水化合物的储存量和利用效率;可溶性糖可参与产生ROS的代谢途径,帮助清除活性氧[17],抗性强的植物通过积累碳水化合物稳定细胞膜和渗透压[18];Vriezen W H等[19]研究表明可溶性糖含量用于供应无氧呼吸能量消耗,积累量多少关系到植物存活时间;Peng等[20]研究发现低温胁迫下烟草(Nicotiana nudicaulis)和三叶柑桔(Poncirus trifoliata)可溶性糖含量上升。
竹类植物具有易造林、成林快、耐水淹、生态适应性强等特点。地被类竹种具有强大的鞭根系统,对稳定边坡、固土保土具有良好效应,其种群密度高,色彩鲜艳,维护成本低,既可美化绿化,又可防止水土流失,近年来在河道、溪流边坡治理方面的应用受到高度重视。地被类观赏竹种抗逆性研究,主要包括CO2胁迫[21]、低温胁迫[22-23]、酸雨胁迫[24]、干旱胁迫[25-26]、铅胁迫[27]等,对地被类观赏竹种水淹胁迫的研究报道较少。研究是以菲白竹(Sasa fortunei)和美丽箬竹(Indocalamus decorus)为实验材料,研究水淹胁迫后菲白竹和美丽箬竹可溶性糖含量变化,抗氧化酶和无氧呼吸酶的活性以及MDA含量、相对电导率和根系活力,旨在探究地被类观赏竹对水淹胁迫及恢复的生理生化响应机制,为其逆境栽培利用提供理论依据。
1 材料与方法
1.1 植物材料
供试材料为2年生菲白竹和美丽箬竹实生苗,苗高约20~30 cm。2019年6月,将实生苗移栽于花盆中(盆高15 cm、直径12 cm;取当地的黄壤土作为栽培土壤,经测定pH为6.55,每盆1株),于浙江农林大学温室内培育1个月,正常栽培管理。
1.2 试验材料处理
2019年8月初选取长势较一致、生长良好、无病虫害、大小相近的美丽箬竹和菲白竹,采用双层套盆的盆栽方法进行,置于具有排水孔的塑料箱(长153 cm、宽120 cm、高55 cm)进行水淹处理。水淹处理:以水恰好没过植株根部为标准;对照(CK):未水淹处理。每个竹种处理15盆,其中,对照组3盆,水淹处理12盆,每盆作为一个独立重复实验,每个处理3次重复。分别在水淹7、14 d和恢复7、14 d的9∶00 am取各级根系混合用液氮冷冻,并放置于-80℃低温冰箱内保存,用于测定相关指标。
1.3 测定方法
1.3.1 MDA含量和相对电导率测定 MDA含量测定参照[28]的方法;电导率用DDSJ-307A型电导仪测定。
1.3.2 可溶性糖含量和根系活力测定 可溶性糖采用蒽酮比色法测定;根系活力采用TTC法。
1.3.3 抗氧化酶活性和无氧呼吸酶活性测定 酶液提取方法:取0.2 g样品液氮研磨细碎均匀,加入5 mL磷酸缓冲溶液(50 mmol·L-1,pH 7.8),混匀后10 000×g离心10 min(4℃),上清液用于SOD、POD和CAT活性的测定。
POD和CAT活性测定参照[29]的方法;SOD活性测定采用试剂盒(南京建成科技有限公司生产)测定;ADH和PDC测定分别采用ADH和PDC试剂盒(南京建成科技有限公司生产)测定。
1.4 数据处理
所有数据均为5次重复的平均值±标准误差。采用SPSS 25软件进行One-Way ANOVA对水淹胁迫2个竹种分别进行检验,Two-Way ANOVA分析水淹恢复处理×竹种交互作用的影响,并进行Ducan多重比较(P<0.05),绘图采用origin 2018软件。
2 结果与分析
2.1 水淹胁迫对菲白竹和美丽箬竹可溶性糖含量的影响
如图1显示,菲白竹和美丽箬竹可溶性糖含量无显著差异。水淹处理14 d时,分别比CK增加了153.2%和34.3%(P<0.05),菲白竹的可溶性糖含量比美丽箬竹高63.8%(P<0.05);恢复处理7 d时,菲白竹和美丽箬竹在恢复处理期间可溶性糖含量与对照无显著差异,菲白竹可溶性糖含量比美丽箬竹高33.4%(P<0.05)。
2.2 水淹胁迫对菲白竹和美丽箬竹MDA含量的影响
如图2可知,菲白竹和美丽箬竹可溶性糖含量无显著差异。水淹处理14 d时,分别比CK增加了47.8%和79.0%(P<0.05),美丽箬竹的MDA含量比菲白竹高30.5%(P<0.05);恢复处理7 d时,菲白竹和美丽箬竹MDA含量与对照无显著差异,美丽箬竹的MDA含量比菲白竹高21.3%(P<0.05)。
2.3 水淹胁迫对菲白竹和美丽箬竹相对电导率的影响
如图3可知,菲白竹电导率比美丽箬竹低26.1%(P<0.05)。水淹处理14 d时,菲白竹和美丽箬竹分别比CK增加了35.5%和29.7%(P<0.05),菲白竹的相对电导率比美丽箬竹低22.8%(P<0.05);恢复处理7 d时,菲白竹和美丽箬竹相对电导率与对照无显著差异,菲白竹的相对电导率比美丽箬竹低27.0%(P<0.05)。
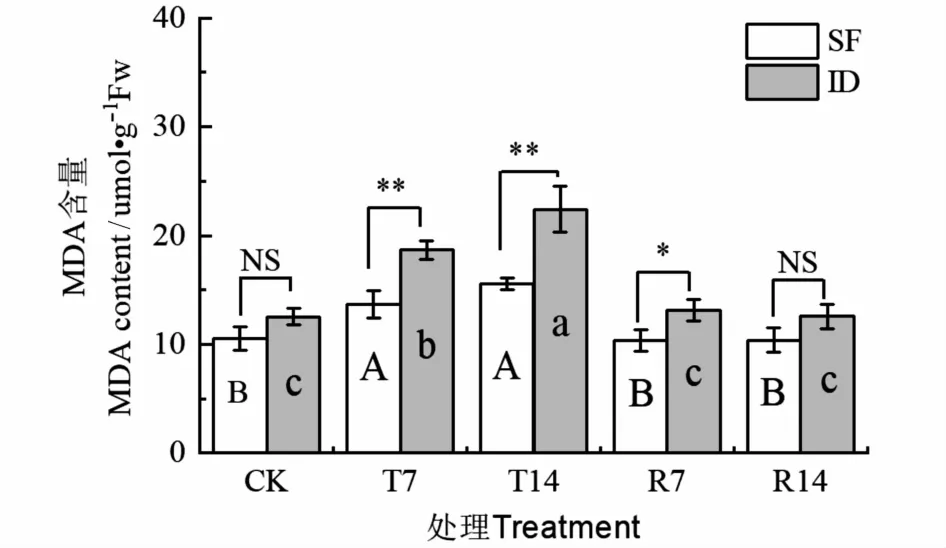
图2 水淹胁迫对菲白竹和美丽箬竹根系丙二醛含量的影响(平均值±标准误差,n=3)Fig.2 Effect of flooding stress on malondialdehyde content in roots of SF and ID(mean±SE,n=3)

图3 水淹胁迫对菲白竹和美丽箬竹根系相对电导率的影响(平均值±标准误差,n=3)Fig.3 Effect of flooding stress on relative electrical conductance in roots of SF and ID(mean±SE,n=3)
2.4 水淹胁迫对菲白竹和美丽箬竹根系活力的影响
图4显示,菲白竹根系活力比美丽箬竹高33.6%(P<0.05)。在水淹处理14 d时,菲白竹和美丽箬竹分别比CK减少了14.1%和27.9%(P<0.05),菲白竹的根系活力比美丽箬竹高59.1%(P<0.05);恢复处理7 d时,菲白竹和美丽箬竹根系活力与对照无显著差异,菲白竹根系活力比美丽箬竹高27.5%(P<0.05)。

图4 水淹胁迫对菲白竹和美丽箬竹根系活力的影响(平均值±标准误差,n=3)Fig.4 Effect of flooding stress on root activity in roots of SF and ID(mean±SE,n=3)
2.5 水淹胁迫对菲白竹和美丽箬竹抗氧化酶活性的影响
图5显示,菲白竹POD酶活比美丽箬竹低32.9%(P<0.05)。水淹处理14 d时,菲白竹POD酶活性比CK增加了55.4%(P<0.05),美丽箬竹减少了53.3%(P<0.05),菲白竹的POD酶活性比美丽箬竹高123.3%(P<0.05);恢复处理7 d时,菲白竹和美丽箬竹POD酶活性与对照无显著差异,菲白竹POD酶活性比美丽箬竹低35.9%(P<0.05)。
菲白竹CAT酶活比美丽箬竹低44.7%(P<0.05)。水淹处理14 d时,菲白竹CAT酶活性比CK增加了126.8%(P<0.05),美丽箬竹减少了19.8%(P<0.05),菲白竹CAT酶活性比美丽箬竹竹高56.3%(P<0.05);恢复处理7 d时,菲白竹和美丽箬竹CAT酶活性与对照无显著差异,菲白竹CAT酶活性比美丽箬竹低41.3%(P<0.05)。
菲白竹和美丽箬竹SOD酶活性无显著差异。水淹处理14 d时,菲白竹和美丽箬竹的SOD酶活性比CK分别增加了80.6%和28.8%(P<0.05),菲白竹的SOD酶活性比美丽箬竹高14.9%(P<0.05);恢复处理7 d时,菲白竹和美丽箬竹在恢复处理期间SOD酶活性与对照无显著差异,菲白竹SOD酶活性比美丽箬竹低26.4%(P<0.05)。
2.6 水淹胁迫对菲白竹和美丽箬竹无氧呼吸酶活性的影响
如图6可知,菲白竹PDC酶活比美丽箬竹低23.5%(P<0.05)。水淹处理14 d时,菲白竹和美丽箬竹的PDC酶活性比CK分别增加了145.4%和9.1%(P<0.05),菲白竹的PDC酶活性比美丽箬竹高72.0%(P<0.05);恢复处理7 d时,菲白竹和美丽箬竹PDC酶活性与对照无显著差异,菲白竹PDC酶活性比美丽箬竹低31.9%(P<0.05)。
菲白竹和美丽箬竹ADH酶活性无显著差异。水淹处理14 d时,菲白竹和美丽箬竹的ADH酶活性比CK分别增加了247.2%和26.6%(P<0.05),菲白竹的ADH酶活性比美丽箬竹高170.6%(P<0.05);恢复处理7 d时,菲白竹和美丽箬竹在恢复处理期间ADH酶活性与对照无显著差异,菲白竹ADH酶活性比美丽箬竹高15.4%(P<0.05)。

图5 水淹胁迫对菲白竹和美丽箬竹根系抗氧化酶活性的影响(平均值±标准误差,n=3)Fig.5 Effect of flooding stress onantioxidant enzyme activity in roots of SF and ID(mean±SE,n=3)

图6 水淹胁迫对菲白竹和美丽箬竹根系的无氧呼吸酶活性的影响(平均值±标准误差,n=3)Fig.6 Effect of flooding stress on anaerobic respiratory enzyme activity in roots of SF and ID(mean±SE,n=3)
3 讨论
MDA作为膜脂过氧化产物与电解质变化呈正相关,可反映植物细胞膜透性及损伤程度[30]。研究表明抗氧化酶保护植物免受胁迫伤害[31-32]。Alpuerto等[33]研究发现水稻缺氧胁迫导致MDA含量升高。崔豫川等[34]对栓皮栎(Quercus variabilis)干旱及复水处理研究发现MDA含量与抗氧化酶相互协调;陈文佳等[35]研究表明干旱胁迫细叶小羽藓(Haplocladium microphyllum)POD和SOD酶活性增加;李兆佳等[36]研究发现水淹胁迫狗牙根(Cynodon dactylon)和牛鞭草(Hemarthria altissima)的SOD酶活性升高,解除胁迫后仍保持较高水平。研究结果表明,随水淹时间增加菲白竹的抗氧化酶活性均升高,美丽箬竹的POD和CAT酶活性降低,菲白竹和美丽箬竹的MDA含量和相对电导率增加(图2、图3),与美丽箬竹相比,菲白竹的MDA含量和相对电导率更低。说明美丽箬竹POD和CAT酶活性降低可能是胁迫时间的延长,耐受性达到最大限度,MDA含量增加,美丽箬竹受水淹胁迫影响较重;耐淹的菲白竹抗氧化作用更强,清除植物体内的活性氧,膜损伤较轻[8,37]。恢复处理时,菲白竹的抗氧化酶活性显著降低(图5),美丽箬竹抗氧化酶活性升高,2个竹种的抗氧化酶活性恢复到对照水平,菲白竹较美丽箬竹抗氧化酶活性低;菲白竹和美丽箬竹的MDA含量和相对电导率恢复到对照水平,与菲白竹相比,美丽箬竹的MDA含量和相对电导率保持较高水平,说明在恢复处理时,相比菲白竹,当缺氧的美丽箬竹再次暴露于氧气时,过量形成ROS[38-39]使美丽箬竹仍受胁迫,恢复能力较慢。
可溶性糖是已知的保护生物膜免受化学失活的重要物质,同时也是冷胁迫的保护剂[40]。Eleni F等[41]研究发现植物抗涝性与其积累量密切相关;张艳婷等[42]研究发现中山杉(Taxodium‘Zhongshansha’)水淹胁迫引起可溶性糖含量不断积累,生长受到抑制;Tamang B C等[43]研究发现大豆(Glycine max)缺氧胁迫导致碳水化合物增加,去水后碳水化合物和ATP含量恢复;Gautam P等[44]研究表明在水淹期间和水淹后非结构性碳水化合物的减少是影响植物在水淹和恢复期间生存和生长的重要生化过程之一。研究结果表明,随着水淹时间的延长菲白竹的可溶性糖含量显著增加(p<0.05),美丽箬竹呈先升高再降低的趋势,菲白竹的可溶性糖含量比美丽箬竹高(图1),表明2个竹种通过提高积累的可溶性糖含量来减少非结构性碳水化合物的消耗,抵御水淹逆境,提高耐淹能力,美丽箬竹的可溶性糖含量在水淹后期降低,说明随着胁迫加剧,美丽箬竹生长受到抑制,能量供应不足,消耗体内积累的可溶性糖,耐淹能力较弱;恢复处理2个竹种均恢复到对照水平,与菲白竹相比,美丽箬竹的可溶性糖含量较高,说明可能菲白竹体内积累的大量可溶性糖被用于恢复时期的生长能量供应,从而含量减少,提高恢复时期的生存率,菲白竹的恢复能力较强[45-46]。
陈鹭真等[47]对红树植物水淹胁迫研究发现PDC与ADH酶活性增加是植物应对缺氧环境的重要手段;Li C等[48]分析表明耐缺氧胁迫能力较高的苹果(Malus domestica)品种的PDC和ADH酶活性较高;郑俊鶱等[49]研究发现黄瓜土壤紧实胁迫导致无氧呼吸酶活性增加;Bryanin S V等[50]研究发现非生物胁迫导致根系活力下降;杜澜等[51]研究发现干旱胁迫绿竹(Dendrocalamopsis oldhami)解除胁迫后根系活力升高。研究结果表明,随着水淹时间的延长美丽箬竹的ADH和PDC酶活性呈先升高再降低的趋势,菲白竹的ADH酶活性增加,菲白竹的无氧呼吸酶活性较美丽箬竹高(图6)。说明可能是美丽箬竹水淹后期无氧呼吸达到阈值,从而无氧呼吸酶活性降低,2个竹种相比,菲白竹乙醇发酵作用更强水淹耐受性更强;恢复处理时,2个竹种的无氧呼吸酶活性降低,与菲白竹相比,美丽箬竹的无氧呼吸酶活性较高,说明解除胁迫后无氧呼吸减弱,开始恢复,菲白竹的恢复能力更强。水淹处理时美丽箬竹的根系活力迅速降低,菲白竹的根系活力在水淹后期降低,恢复处理时2个竹种的根系活力恢复到对照水平,菲白竹的根系活力较美丽箬竹高(图4),表明水淹初期菲白竹的根系活力对水淹响应积极,由于胁迫加剧导致2个竹种呼吸代谢紊乱,根系活力降低,可能是水淹胁迫时的无氧呼吸抑制根系活力,解除胁迫后根系活力有所恢复,与美丽箬竹相比,菲白竹的耐淹能力和恢复能力更强[52-53]。
综上所述,菲白竹和美丽箬竹适应水淹胁迫通过提高抗氧化酶POD、CAT和SOD活性,消除对植物有害的活性氧,减少膜脂过氧化作用产物丙二醛MDA和外渗物质,降低相对电导率。同时提高无氧呼吸酶ADH和PDC活性促进厌氧代谢,减少乳酸增加,减轻细胞内PH值降低引起的细胞酸中毒,并且增加可溶性糖含量为呼吸代谢提供能量供应,维持植物生存。水淹胁迫条件下菲白竹的抗性较强,美丽箬竹较弱。试验为菲白竹和美丽箬竹在季节性水淹环境条件下竹种选择、栽培管理提供理论依据。
