siRNA-P300鞘内注射对神经病理性疼痛大鼠模型HIF-1α/VEGF和ERK通路的影响
2019-09-29刘志军彭从斌
刘志军 彭从斌
[摘要] 目的 探讨神经鞘內注射P300小分子干扰RNA(siRNA-P300)对神经病理性疼痛(NP)大鼠模型低氧诱导因子1α(HIF-1α)/血管内皮生长因子(VEGF)及细胞外信号调节激酶(ERK)通路的影响。 方法 32只鞘内置管成功的雄性SD大鼠,随机平均分为假手术组、模型组、阴性对照组(加入阴性对照质粒)、siRNA-P300组(加入siRNA-P300),每组各8只。坐骨神经慢性压迫性损伤法(CCI)构建NP大鼠模型。于术前1 d及术后1 d、3 d、5 d、7 d、9 d、14 d检测各组大鼠机械痛阈与热痛阈;qRT-PCR检测P300 mRNA水平;Western blot检测P300、Ac-H3、HIF-1α、VEGF及ERK通路相关蛋白表达;ELISA法检测脊髓液中疼痛介质及神经炎性因子水平。 结果 与术前相比,术后不同时间点各组大鼠机械痛阈、热痛阈降低(P<0.05)。与假手术组相比,模型组、阴性对照组、siRNA-P300组大鼠IL-4及IL-10水平显著降低(P<0.05),P300 mRNA和蛋白、Ac-H3蛋白、疼痛介质5-HT、SP、GABA、炎性因子IFN-γ、TNF-α、IL-1β水平、HIF-1α、VEGF、p-ERK、p-CREB及BDNF蛋白水平显著升高(P<0.05)。与模型组相比,siRNA-P300组大鼠IL-4及IL-10水平显著升高(P<0.05),P300 mRNA和蛋白、Ac-H3蛋白、疼痛介质5-HT、SP、GABA及炎性因子IFN-γ、TNF-α、IL-1β水平、HIF-1α、VEGF、p-ERK、p-CREB及BDNF蛋白水平显著降低(P<0.05)。 结论 鞘内注射siRNA-P300可能通过抑制HIF-1α/VEGF和ERK通路减轻NP大鼠神经病理性疼痛。
[关键词] P300;siRNA;神经鞘内转染;神经病理性疼痛
[中图分类号] R363.1 [文献标识码] A [文章编号] 1673-9701(2019)20-0037-06
Effect of intrathecal injection of siRNA-P300 on HIF-1α/VEGF and ERK pathways in the rat model of neuropathic pain
LIU Zhijun PENG Congbin
Department of Anesthesiology, Zhejiang Provincial Tongde Hospital, Hangzhou 310012, China
[Abstract] Objective To investigate the effect of intrathecal injection of P300 small interfering RNA (siRNA-P300) on the hypoxia-inducible factor 1α (HIF-1α)/vascular endothelial growth factor (VEGF) and extracellular signal-regulated kinase (ERK) pathways in the rat model of neuropathic pain (NP). Methods 32 male SD rats with successful intrathecal intubation were randomly divided into sham operation group, model group, negative control group(given negative control plasmid) and siRNA-P300 group(given siRNA-P300) 8 rats in each group. The NP rat model was constructed by the chronic compression injury(CCI) of the sciatic nerve. The mechanical pain threshold and thermal pain threshold of rats in each group were detected 1 day before operation and 1 day, 3 days, 5 days, 7 days, 9 days and 14 days after operation; qRT-PCR was used to detect P300 mRNA levels; Western blot was used to detect the expression of P300, Ac-H3, HIF-1α, VEGF and ERK pathway-related proteins; the level of pain mediators and neuroinflammatory factors in spinal fluid was measured by ELISA. Results There was no statistically significant difference in mechanical pain threshold and thermal pain threshold in NP rats between sham operation group before operation and 1 day to 14 days after operation(P>0.05). Compared with the model group, the negative control group and the siRNA-P300 group before operation, the mechanical pain threshold and thermal pain threshold of the NP rats in each group were significantly decreased at different time points(P<0.05). Compared with the sham operation group, the IL-4 and IL-10 levels in the model group, negative control group and siRNA-P300 group were significantly lower(P<0.05). P300 mRNA and protein, Ac-H3 protein, pain mediators of 5-HT, SP, GABA, inflammatory factors of IFN-γ, TNF-α, IL-1β levels,HIF-1α,VEGF,p-ERK, p-CREB and BDNF protein levels were significantly increased(P<0.05). Compared with the model group, IL-4 and IL-10 levels were significantly increased in the siRNA-P300 group(P<0.05). P300 mRNA and protein, Ac-H3 protein, pain mediators of 5-HT, SP, GABA and inflammatory factors of IFN-γ,TNF-α,IL-1β levels, HIF-1α, VEGF, p-ERK, p-CREB and BDNF protein levels were significantly reduced(P<0.05). Conclusion Intrathecal injection of siRNA-P300 may attenuate neuropathic pain in NP rats by inhibiting HIF-1α/VEGF and ERK pathways.
[Key words] P300; siRNA; Intrathecal transfection; Neuropathic pain (NP)
神經病理性疼痛(neuropathic pain,NP)主要是指神经系统原发性损害及其功能障碍引发的一种慢性疼痛疾病,其主要临床特征为痛觉过敏、感觉异常、自发性疼痛等[1]。NP发病机制较为复杂,既往研究显示NP发病机制涉及生物化学、解剖学、分子生物及电生理基础等方面[2]。研究表明P300蛋白作为组蛋白乙酰化转移酶家族一员可通过调控疼痛介质及神经炎症反应等表达进而参与神经疼痛发生及发展过程[3]。故而P300蛋白是否可作为NP治疗靶点成为热点研究。研究表明细胞外信号调节激酶(extracellular-signa1 regulated kinase,ERK)信号通路活化与NP发生有关,甘丙肽受体-1可通过抑制ERK通路激活进而发挥镇痛作用[4]。ERK还可调控低氧诱导因子-1α(hypoxia inducible factor,HIF-1α)/血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路,研究发现通过抑制ERK表达可抑制HIF-1α/VEGF信号通路进而抑制高糖诱导视网膜血管生成[5]。关于HIF-1α/VEGF、ERK信号通路与NP发生及发展的研究相对较少,因此本研究采用鞘内注射P300小分子干扰RNA(siRNA-P300)并分析其对NP大鼠模型的镇痛效果,探究其对HIF-1α/VEGF、ERK信号通路的影响,为探寻NP治疗方案提供可能治疗靶点。
1 材料与方法
1.1 实验动物
清洁级雄性SD大鼠32只,体重为200~230 g,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2016-0012。
1.2 方法
1.2.1 主要试剂与仪器 脂质体Lipofectamine2000转染试剂盒购自美国Invitrogen公司(批号:20171203);siRNA-P300购自上海吉玛公司;Trizol(批号:2017 1003)、反转录(批号:20171105)及SYBRTM GreenERTM Kit试剂盒(批号:20171014)均购自北京宝日医生物技术有限公司;兔抗鼠P300(批号:2026035)、Ac-H3多克隆抗体(批号:2026021)均购自美国Santa Cruz公司;兔抗鼠HIF-1α单克隆抗体(批号:2022056)购自美国Millipore公司;兔抗鼠VEGF多克隆抗体购自美国Abcam公司(批号:GR51277);ERK(批号:12607)及其磷酸化p-ERK(批号:12608)、转录环磷腺苷效应元件结合蛋白(cAMP response element binding protein,CREB)(批号:12713)及其磷酸化p-CREB(批号12715)、脑源性神经营养因子(brain derived neurotrophic factor,BDNF)(批号:12806)多克隆抗体均购自美国Cell Signaling公司;辣根过氧化物酶标记的山羊抗兔IgG抗体(批号:102063)购自北京中杉金桥生物技术有限公司;人5羟色胺(5-HT)(批号:20170613)、SP(批号:20170621)、A型γ-氨基丁酸(GABA)(批号:20170615)、γ-干扰素(IFN-γ)(批号:20170618)、肿瘤坏死因子-α(TNF-α)(批号:20170622)、白细胞介素-1β(IL-1β)(批号:20170701)、白细胞介素-4(IL-4)(批号:20170712)、白细胞介素-10(IL-10)(批号:20160608)酶联免疫吸附试剂盒(ELISA)均购自上海酶联生物科技有限公司;蛋白裂解液与BCA蛋白定量试剂盒均购自上海碧云天生物科技有限公司。CFX96Touch实时荧光定量PCR仪购自美国Bio-RAD公司;iBright 智能凝胶成像分析系统及Quantity One分析软件均购自美国Thermo Fisher公司;Electronic von Frey Anesthesiometer型电子Von Frey测痛仪购自自然基因科技有限公司;7370热痛仪购自意大利UGO公司;Du-640紫外分光光度计购自美国贝克曼公司。
1.2.2 NP模型建立及分组 麻醉大鼠并将其仰卧固定,采用腰段鞘内置管法进行鞘内置管,其具体操作参照相关文献报道[6],术后导管外口被封闭的硬膜外导管罩住以防止脑脊液外漏,并观察术后大鼠活动情况并对导管置入位置进行评价,所有大鼠均使用青霉素进行抗感染且均单独饲养。选取鞘内置管成功的大鼠32只,随机选取8只大鼠作为假手术组,其余大鼠建立NP模型,采用坐骨神经慢性压迫性损伤法(chronic constriction jinury,CCI)构建NP大鼠模型,术后NP大鼠痛阈明显升高提示造模成功[7]。将造模成功的大鼠分为模型组、阴性对照组、siRNA-P300组,每组各8只。阴性对照组:配置20 μL阴性转染试剂(4 μg siRNA-NC阴性质粒溶于20 μL Lipofectamine),术后3 d时鞘内注射剂量为每天2次,每次10 μL;siRNA-P300组:配置20 μL siRNA-P300(4 μg siRNA-P300转染试剂溶于20 μL Lipofectamine),术后3 d时鞘内注射剂量为每天2次,每次10 μL;模型组与假手术组大鼠每天注射等量生理盐水,继续培养14 d。
1.2.3 监测机械痛阈与热痛阈 分别于术前1 d及术后1 d、3 d、5 d、7 d、9 d、14 d检测各组大鼠机械痛阈与热痛阈,机械痛阈检测方法:将透明塑料鼠笼作为测试地,分别将各组大鼠置于测试圈内,30 min后校正Von Frey测痛仪零点并采用探针刺激大鼠后爪脚掌,此时大鼠缩爪时测痛仪显示的压力值即为机械痛阈值。热痛阈检测方法:分别将各组大鼠置于玻璃板上(厚度约3 mm)并采用透明塑料笼罩住,30 min后采用红外光源照射大鼠足底并计时,大鼠感到疼痛自觉将后足抬起时停止计时,红外光源照射前后时间差值即为热痛阈。机械痛阈与热痛阈检测均重复3次并求取平均值。
1.2.4 实时荧光定量聚合酶链反应(qRT-PCR)检测P300 mRNA表达水平 转染培养14 d后处死大鼠并采集各组大鼠腰段脊髓并置于-80℃超低温冰箱保存待测。采用实时荧光定量聚合酶链反应(qRT-PCR)检测P300 mRNA表达水平,取冻存脊髓,液氮中研磨,加入10 μL Trizol试剂提取总RNA,应用紫外分光光度计检测RNA浓度及纯度,参照反转录试剂盒合成cDNA,qRT-PCR反应体系共20μL:SYBR Green Mstermix 10 μL,cDNA样本1 μL,引物各0.5 μL,ddH2O 8 μL。P300上游引物5'-GCCAAGTATGCCAACCCTAA-3',下游引物5'-TGTTCATTTGCTGAGCTTGG-3';GAPDH上游引物-TGGTGAAGGTCGGTGTGAAC-3',下游引物5'-GGTGGTGAAGACGCCAGTAG-3'。反应条件:95℃ 5 min,95℃ 30 s,60℃ 30 s,72℃ 30 s,共32个循环。以GAPDH为内参,采用2-ΔΔCt相对定量法计算P300 mRNA的相对表达量。
1.2.5 检测NP大鼠脊髓液中疼痛介质及神经炎性因子水平 转染后14 d时处死大鼠并分离第5腰椎对应的脊髓组织,加入0.3 mL蛋白裂解液并在冰上充分研磨,3000 r/min转速离心10 min,分离上清液并采用ELISA法检测5-HT、SP、GABA、IFN-γ、TNF-α、IL-1β、IL-4、IL-10水平,严格按照试剂盒说明书进行操作,同时采用BCA蛋白定量试剂盒检测总蛋白含量,计算每毫克总蛋白中各指标含量。
1.2.6 蛋白免疫印迹法(Western blot)检测P300、Ac-H3、HIF-1α/VEGF及ERK通路相关蛋白表达 取冻存大鼠脊髓,采用蛋白免疫印迹法(Western blot)检测大鼠脊髓中P300、Ac-H3、HIF-1α、VEGF、ERK、p-ERK、CREB、p-CREB及BDNF蛋白表达。根据蛋白浓度加入SDS样本缓冲液,加入蛋白裂解液将各样本配制终浓度为100 mg/mL的溶液,取10 μL蛋白样品点入15% SDS-PAGE上并分离不同分子量蛋白,采用预冷转移缓冲液将蛋白移至PDVF膜上,用5%脱脂奶粉室温下封闭1 h,TBST洗膜,加入一抗,稀释比均为1:200,放入4℃冰箱保存过夜,次日采用TBST洗膜,加入二抗(1:5000),室温孵育1 h,TBST洗膜,采用ECL液显色并曝光显影,置于凝胶分析仪并采用图像合理性软件分析各蛋白条带。以GADPH为内参,各目的蛋白条带灰度值与内参GADPH的比值表示各目的蛋白的相对表达水平。
1.3 统计学方法
采用统计学软件SPSS22.0分析数据,计量资料符合正态分布的数据均以均数±标准差(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析;计数资料用[n(%)]表示,采用χ2检验,各组数据均以P<0.05为差异具有统计学意义。
2 结果
2.1 siRNA-P300鞘内注射对NP大鼠机械痛阈的影响
与术前比较,术后不同时间点各组NP大鼠机械痛阈均显著降低(P<0.05);与假手术组比较,模型组、阴性对照组及siRNA-P300组术后NP大鼠机械痛阈均显著降低(P<0.05);与模型组比较,siRNA-P300组术后5 d、7 d、9 d、11 d NP大鼠机械痛阈显著升高(P<0.05),模型组与阴性对照组比较差异不显著(P>0.05)。见表1。
2.2 siRNA-P300鞘内注射对NP大鼠热痛阈的影响
与术前比较,术后不同时间点各组NP大鼠热痛阈均显著降低(P<0.05);与假手术组比较,模型组、阴性对照组及siRNA-P300组术后不同时间点NP大鼠热痛阈均显著降低,差异有统计学意义(P<0.05);与模型组和阴性对照组比较,siRNA-P300组术后5 d、7 d、9 d、14 d時NP大鼠热痛阈显著升高,差异有统计学意义(P<0.05),模型组与阴性对照组比较,差异无统计学意义(P>0.05)。见表2。
2.3 各组NP大鼠P300、Ac-H3蛋白表达水平
与假手术组比较,模型组、阴性对照组及siRNA-P300组NP大鼠P300 mRNA蛋白及Ac-H3蛋白表达水平均显著升高,差异有统计学意义(P<0.05);与模型组及阴性对照组比较,siRNA-P300组NP大鼠P300 mRNA蛋白及Ac-H3蛋白表达水平均显著降低,差异有统计学意义(P<0.05),模型组与阴性对照组比较,差异不显著(P>0.05)。见图1、表3。
2.4 siRNA-P300鞘内注射对NP大鼠神经疼痛及炎症反应程度的影响
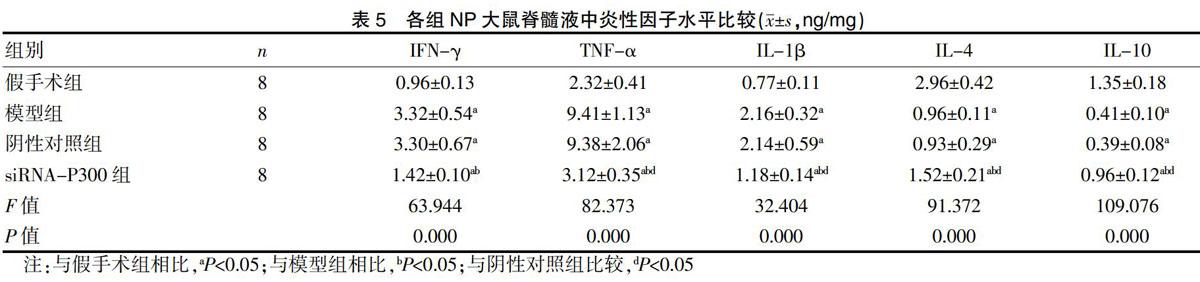
与假手术组比较,模型组、阴性对照组及siRNA-P300组NP大鼠脊髓液中疼痛介质5-HT、SP、GABA及炎性因子IFN-γ、TNF-α、IL-1β水平均显著升高(P<0.05),IL-4与IL-10水平显著降低,差异有统计学意义(P<0.05);与模型组及阴性对照组相比,siRNA-P300组NP大鼠脊髓液中5-HT、SP、GABA及炎性因子IFN-γ、TNF-α、IL-1β水平均显著降低(P<0.05),IL-4与IL-10水平均显著升高,差异有统计学意义(P<0.05);模型组与阴性对照组比较,差异无统计学意义(P>0.05)。见表4、表5。
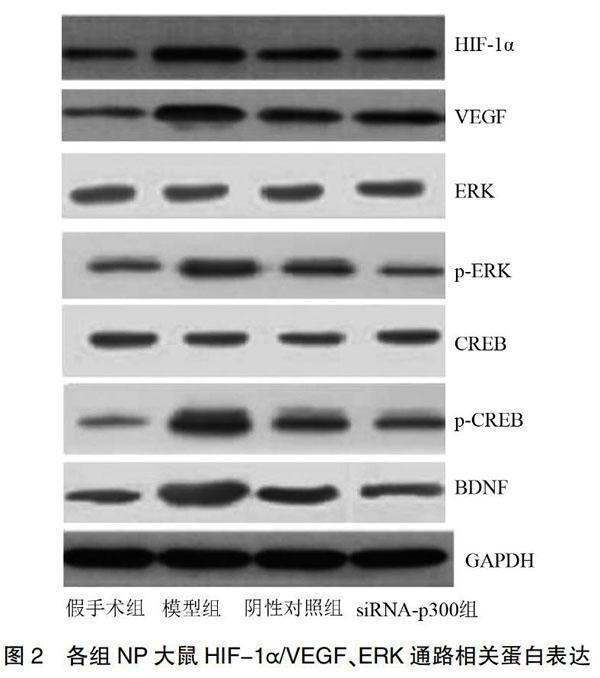
2.5 siRNA-P300鞘内注射对NP大鼠HIF-1α/VEGF、ERK通路的影响
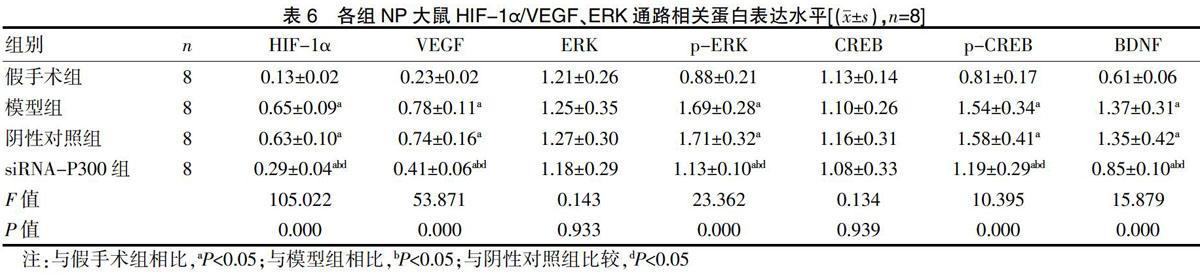
与假手术组比较,模型组、阴性对照组及siRNA-P300组NP大鼠HIF-1α、VEGF、p-ERK、p-CREB及BDNF蛋白表达水平均显著升高(P<0.05),ERK与CREB蛋白表达水平比较差异不显著(P>0.05);与模型组及阴性对照组相比,siRNA-P300组NP大鼠HIF-1α、VEGF、p-ERK、p-CREB及BDNF蛋白表达水平均显著降低(P<0.05),ERK与CREB蛋白表达水平比较,差异差异无统计学意义(P>0.05),且模型组与阴性对照组比较,差异无统计学意义(P>0.05)。见图2、表6。
3 讨论
目前关于NP确切发病机制及其具体发生过程均尚未完全阐明,临床尚缺乏有效治疗手段,因而探究NP发生机制及有效治疗方法成为研究热点[8]。既往研究表明物理性机械损伤、病毒感染、缺血性神经损害等均可引发NP[9]。为了进一步研究NP发病机制建立各种动物NP模型,研究表明CCI、坐骨神经分支选择损伤模型(SNI)、脊神经选择结扎模型(SNL)等均为常用NP模型,其中CCI模型主要特征为外周及中枢敏化,并可采用机械痛阈、热痛阈检测疼痛行为,且具有操作简单、创伤性小等优点[10]。因此,本研究通过构建CCI模型进一步探究NP有效治疗方法及其可能作用机制,为提高NP治疗效果提供一定理论依据。
P300属于组蛋白乙酰转移酶且具有辅助激活因子作用,组蛋白去乙酰化酶可对NP发挥镇痛作用,进一步研究显示大鼠脊髓中P300表达水平升高并可促进NP发生[11-12],但关于其具体作用机制及可能作用通路尚未解释清楚。研究显示在SNL大鼠模型鞘内注射P300抑制剂可能通过抑制P300介导p65乙酰化并促使核因子κB(NF-κB)表达水平降低,这可为神经疼痛的治疗提供靶点[13]。本研究构建CCI模型并采用siRNA-P300鞘内注射观察大鼠机械痛阈及热痛阈变化,结果显示术后不同时间点各组NP大鼠机械痛阈及热痛阈均明显降低,提示NP模型大鼠造模成功。术后5 d、14 d siRNA-P300组NP大鼠机械痛阈及热痛阈均明显高于模型组、阴性对照组,说明鞘内注射P300的siRNA可有效提高NP大鼠痛阈,提示P300在NP发生过程中发挥重要作用。本研究结果显示模型组、阴性对照组及siRNA-P300组NP大鼠P300 mRNA、蛋白及Ac-H3蛋白表达水平均显著高于假手术组,siRNA-P300组显著低于模型组,其中组蛋白Ac-H3属于P300乙酰化作用底物[14],分析原因可能为siRNA-P300可通过抑制脊髓P300表达并减弱P300介导的组蛋白乙酰化作用进而抑制下游疼痛基因表达。提示siRNA-P300鞘内注射可提高NP大鼠痛阈。神经免疫系统紊乱及炎症介质异常分泌可引发NP,因而探讨siRNA-P300鞘内注射对NP大鼠体内炎性介质的影响具有重要意义[15]。进一步分析siRNA-P300鞘内注射对NP大鼠神经炎症反应及疼痛介质的影响,结果显示模型组、阴性对照组及siRNA-P300组NP大鼠脊髓液中5-HT、SP、GABA及炎性因子IFN-γ、TNF-α、IL-1β水平均显著高于假手术组,siRNA-P300组显著低于模型组、阴性对照组;模型组、阴性对照组及siRNA-P300组NP大鼠脊髓液中IL-4與IL-10水平显著低于假手术组,siRNA-P300组显著高于模型组,其中疼痛介质合成及分泌异常均可引起疼痛觉,神经源性炎性因子激活又可进一步促进疼痛介质分泌,SP物质属于速激肽并可与膜受体结合进而增加神经元放电导致疼痛觉的产生,5-HT可与神经元受体结合并启动内向电流进而增加痛觉敏感性,GABA可与神经元突出结构相互作用进而引发疼痛觉,同时促炎因子IFN-γ、TNF-α、IL-1β与抗炎因子IL-4、IL-10分泌紊乱可促进神经源性炎症发生进而引起疼痛[16]。本研究结果表明促炎因子水平升高及抗炎因子水平降低可促进神经源性炎症发生并进一步促进疼痛介质5-HT、SP、GABA异常分泌进而引起NP的发生,鞘内注射siRNA-P300可通过抑制促炎因子、疼痛介质分泌并增加抗炎因子分泌进而神经源性炎症从而减缓疼痛程度。提示鞘内注射siRNA-P300可有效减轻NP大鼠疼痛程度。
ERK/CREB通路磷酸化可参与BDNF保护及修复背根神经节过程,BDNF是神经营养因子之一并可调控神经细胞分化及再生[17]。BDNF可与其受体结合进而促进疼痛形成,抑制ERK/CREB通路可降低BDNF表达水平并有效改善CCI诱发痛觉过敏特征,ERK/CREB、BDNF通路激活可参与NP形成过程[18]。研究表明通过抑制丝裂原活化蛋白激酶/ERK(MAPK/ERK)信号通路可降低HIF-1α、VEGF相关蛋白表达水平进而有效改善老年缺血性脑卒中患者认知功能障碍[19]。推测ERK/CREB信号通路与HIF-1α/VEGF信号通路是否共同参与NP发生过程。吕翠岩等[20]研究表明通过抑制HIF-1α/VEGF信号通路相关蛋白表达可对糖尿病大鼠坐骨神经发挥保护作用。同时P300还可通过与CREB结合蛋白相互作用进而参与NP发生及发展过程[21]。以上研究均表明ERK/CREB及HIF-1α/VEGF信号通路均与NP发生密切相关。本研究结果显示模型组、阴性对照组及siRNA-P300组NP大鼠HIF-1α、VEGF、p-ERK、p-CREB及BDNF蛋白表达水平均高于假手术组,siRNA-P300组低于模型组、阴性对照组,说明siRNA-P300可有效抑制ERK/CREB及HIF-1α/VEGF信号通路。提示siRNA-P300可能通过抑制HIF-1α/VEGF及ERK/CREB信号通路进而抑制NP大鼠神经病理性疼痛。
综上所述,鞘内注射siRNA-P300可缓解NP大鼠神经病理性疼痛,其可能作用机制与抑制HIF-1α/VEGF及ERK/CREB信号通路有关,其将会增加对NP发病机制的认识并可能成为治疗NP的新靶点,为未来疼痛药物的开发提供重要方向。但关于siRNA-P300可能通过作用于哪些蛋白发挥镇痛作用及其可能分子机制均需深入研究。
[参考文献]
[1] Patel R,Dickenson AH.Mechanisms of the gabapentinoids and α2δ-1 calcium channel subunit in neuropathic pain[J].Pharmacol Res Perspect,2016,4(2):e00205.
[2] Kalangara JP,Galor A,Levitt RC,et al.Burning eye syndrome:Do neuropathic pain mechanisms underlie chronic dry eye?[J]. Pain Med,2016,17(4):746-755.
[3] Carlos VB,Janine W,Hannah G,et al.Effects of transcutaneous vagus nerve stimulation(tVNS) on the P300 and alpha-amylase level:A pilot study[J]. Frontiers in Human Neuroscience,2018, 12(7):202-213.
[4] 徐焕焕,张颖,李霞,等.甘丙肽及受体1在神经病理性痛大鼠伏核的镇痛作用及对ERK1/2信号通路的调节研究[J]. 中国病理生理杂志,2015,16(10):1864-1866.
[5] Yu Z,Zhang T,Gong C,et al.Erianin inhibits high glucose-induced retinal angiogenesis via blocking ERK1/2-regulated HIF-1α-VEGF/VEGFR2 signaling pathway[J].Sci Rep,2016, 6(5):34306-34312.
[6] 王鹏,郝伟,张颖,等.神经鞘内转染siRNA-P300对大鼠神经病理痛阈值的影响[J]. 中国中西医结合外科杂志,2016,22(5):471-474.
[7] 王立凤,张志宇,李真真,等.静脉注射免疫球蛋白对神经病理性疼痛大鼠的治疗作用[J]. 中国临床药理学与治疗学,2015,20(8):849-853.
[8] Kamerman PR,Wadley AL,Davis KD,et al.World health organization essential medicines lists:Where are the drugs to treat neuropathic pain?[J]. Pain,2015,156(5):793-797.
[9] Vadivelu N,Maslin B,Kai A,et al.Tapentadol extended release in the management of peripheral diabetic neuropathic pain[J].Ther Clin Risk Manag,2015,23(11):95-105.
[10] Espinosa-Juárez JV,Jaramillo-Morales OA,López-Munoz FJavier.Haloperidol decreases hyperalgesia and allodynia induced by chronic constriction injury[J]. Basic Clin Pharmacol Toxicol,2017,121(6):471-479.
[11] 李燕红,杨谦,李锦亮,等.加味当归芍药散抑制组蛋白乙酰化酶P300/血清环加氧酶-2通路调控核因子E2相关因子2在黄褐斑形成中的作用机制研究[J]. 山西医药杂志,2017,46(24):2975-2978.
[12] Zhuofeng D,Jiawei C,Yu S,et al.Resveratrol promotes nerve regeneration via activation of P300 acetyltransferase-mediated VEGF signaling in a rat model of sciatic nerve crush injury[J].Frontiers in Neuroscience,2018,12(5):341-356.
[13] 王依慰,劉清珍,陈春龙,等.鞘内注射乙酰化酶P300抑制剂Garcinol对大鼠神经病理性痛的影响[J]. 临床麻醉学杂志,2016,32(6):581-585.
[14] Wu T,Kamikawa YF,Donohoe ME.Brd4's bromodomains mediate histone H3 acetylation and chromatin remodeling in pluripotent cells through P300 and brg1[J].Cell Rep,2018,25(7):1756-1771.
[15] Wang IC, Chung CY, Liao F,et al. Peripheral sensory neuron injury contributes to neuropathic pain in experimental autoimmune encephalomyelitis[J]. Sci Rep,2017,7(2):42304-42310.
[16] 鲁智生,周江平,刘禹利,等.神经病理性疼痛大鼠模型接受免疫球蛋白干预后疼痛程度及神经炎症反应程度的分析[J]. 海南医学院学报,2017,23(7):865-867.
[17] 张瑞,夏志明,孙小余,等.ERK/CREB信号通路在异菝葜皂苷元促进Aβ损伤SH-SY5Y细胞BDNF表达中的作用[J]. 上海交通大学学报(医学版),2016,36(5):642-647.
[18] 徐良,裘涛,张丽娟,等.慢性压迫损伤性神经病理性疼痛大鼠模型中脊髓背角ERK、CREB、BDNF表达的变化[J]. 浙江医学,2016,38(16):1341-1344.
[19] 苏洲,田小军,王玉梅,等.依达拉奉对急性缺血性脑卒中患者丝裂原活化蛋白激酶/细胞外调节蛋白激酶信号通路蛋白表达的影响[J]. 中华老年医学杂志,2018, 37(12):1372-1376.
[20] 吕翠岩,张胜容,赵文景,等.糖痹康对糖尿病大鼠坐骨神经VEGF和HIF-1α调控机制研究[J]. 中华中医药学刊,2016,34(2):312-314.
[21] 武干生,吴树彪,胡盼盼,等.P300与CREB结合蛋白在神经病理性痛形成过程中的表达及分布[J]. 中华实验外科杂志,2015,32(4):867-869.
