水产品中11种海洋生物毒素的高效液相色谱-四极杆/静电场轨道阱高分辨质谱检测方法研究
2019-09-27方科益陈树兵徐旭文周虹玲李露青曹国洲陈先锋
方科益,陈树兵,李 双,徐旭文,周虹玲,李露青,曹国洲,陈先锋
(1.宁波海关技术中心,浙江 宁波 315040;2.宁波中盛产品检测公司,浙江 宁波 315040)
海洋生物毒素是海洋生物体内存在的一类高活性的特殊代谢成分,通常拥有剧烈毒性,主要由藻类或浮游植物产生,通过食物链传递进入海洋动物体内,可在滤食性的软体贝壳类动物、鱼类等海产品的组织内蓄积。人体一旦过量食入,将引起中毒反应[1-6]。目前,市售海产品中常见的海洋生物毒素种类包括麻痹性贝毒(Paralytic shellfish poisoning,PSP)、腹泻性贝毒(Diarrhetic shellfish poisoning,DSP)、记忆缺失性贝毒(Amnesic shellfish poisoning,ASP)、神经性贝毒(Neurotoxic shellfish poisoning,NSP)、河豚毒素(Tetrodotoxin,TTX)、西加毒素(Ciguatoxin,CTX)及其它藻类毒素。根据其理化性能可以分为亲水性和亲脂性,其中麻痹性贝毒(PSP)、记忆缺失性贝毒(ASP)、河豚毒素(TTX)及大部分藻类毒素属于亲水性毒素;腹泻性贝毒(DSP)、神经性贝毒(NSP)及西加毒素(CTX)属于亲脂性毒素[7]。
目前,对于水产品中海洋生物毒素的检测方法主要有生物学测试方法和化学分析法,早期应用广泛且较为成熟的有小鼠测试法、免疫分析法等生物学测试法。气相色谱法、薄层色谱法及液相色谱法等化学分析方法也有一定报道[8]。近年来,液相色谱-质谱联用技术的高灵敏度和高选择性使其逐渐成为水产品中海洋生物毒素的首选检测手段。GB 5009.198-2016《食品安全国家标准 贝类中失忆性贝类毒素的测定》等多个国家标准均基于液相色谱-质谱联用技术,建立了相应海洋生物毒素的定量检测方法[9]。在食品残留及污染物筛查技术研究中,高分辨质谱(HRMS)已得到一定的推广和应用,如静电场轨道阱高分辨质谱技术(Orbitrap MS)及飞行时间质谱技术(TOF-MS)等可依靠精确质量数和保留时间实现对待测物的定性识别[10-13]。HRMS技术可通过全扫描进行非定向和未知化合物的筛选,精确质量数进行定性,必要时还可设定质量数进行二级扫描,通过再打碎得到MS/MS谱图进行谱库检索或与标准物质比对来确证待测物。Monica等[14]采用HRMS实现了海产品中8种PSP毒素的测定。
但现有检测毒素的方法中,较多仅适用于一类毒素,如于慧娟等[15]采用固相萃取法检测10种麻痹性贝类毒素;高通量检测方法所对应的目标物也均为同一理化性质,如Rubies等[16]采用QuEChERS技术建立对贝类中脂溶性贝类毒素的高通量检测方法。可见研究针对复杂的水产品基质,建立适用于亲水性及亲脂性两类理化性质的海洋生物毒素的通用型前处理及检测方法具有较大意义。本文选取不同类别和理化性质的11种海洋生物毒素作为研究目标,建立了基于分散固相萃取技术(dSPE)和载体辅助液液萃取技术(SLLE)的前处理及净化体系,并借助高效液相色谱-高分辨质谱仪(HPLC-HRMS)实现了对水产品中亲水性及亲脂性海洋生物毒素的“一站式”提取、净化及测定。
1 实验部分
1.1 仪器、试剂与材料
高效液相色谱-四极杆/静电场轨道阱高分辨质谱(美国Thermo Fisher Scientific),配备ESI源;Hypersile Gold C8色谱柱(150 mm×2.1 mm,3 μm,美国Thermo Fisher);电子天平(感量分别为0.1 mg和0.01 g,瑞士Mettler Toledo);超纯水器(美国Millipore);旋涡混合仪(瑞士Mettler Toledo);超声波清洗仪(昆山超声波仪器有限公司)。
乙腈、甲醇(HPLC级,美国Tedia);氨水、甲酸、甲酸铵、二甲基亚砜、无水硫酸镁、中性氧化铝(AL-N)(分析纯,国药集团化学试剂有限公司);石墨化炭黑(GCB)、C18粉(上海安谱实验科技股份有限公司)。0.1%甲酸:取1 mL甲酸,用水定容至1 000 mL。甲醇-氨水(99∶1):99 mL甲醇中加入1 mL氨水。流动相A为含2 mmol/L 甲酸铵+0.1%甲酸的水溶液:取0.126 g甲酸铵和1 mL甲酸,用超纯水定容至1 000 mL;流动相B为含 2 mmol/L甲酸铵+0.1%甲酸的乙腈水溶液:取0.126 g甲酸铵,1 mL甲酸,用乙腈+水(95+5)定容至1 000 mL。非特别说明,所列试剂均为色谱纯,实验用水为GB/T 6682规定的一级水。
标准物质:河豚毒素(上海安谱实验科技股份有限公司);微囊藻毒素LR、微囊藻毒素RR(农业部环境保护科研检测所);柱孢毒素、软骨藻酸、脱氨甲酰基石房蛤毒素、膝沟藻毒素、新石房蛤毒素、蛤蚌毒素、鳍藻毒素、冈田软海绵酸(加拿大国家研究院海洋生物研究所)。11种目标物所属类别及理化性质见表1。
硅藻土柱(上海安谱实验科技股份有限公司):处理量3 mL;15 mL具刻度离心管。
1.2 前处理步骤
称取样品2.00 g于离心管中,加入2 mL 0.1%甲酸溶液,涡旋振荡1 min,加入5 mL乙腈,涡旋振荡1 min,超声5 min,以9 000 r/min离心5 min,取上清液;残渣加入1 mL 0.1%甲酸溶液,涡旋振荡1 min,超声5 min,以9 000 r/min离心5 min,取上清液;取残渣再加入3 mL乙酸乙酯,涡旋1 min,超声5 min,以9 000 r/min离心5 min,取上清液,合并各次离心所得上清液;将合并液加入0.1 g甲酸铵,涡旋振荡1 min,以9 000 r/min离心5 min,得到上层有机相和下层水相;将下层水相倒入硅藻土柱中,静置15 min以上,下接鸡心瓶,并向鸡心瓶中加入0.5 mL二甲亚砜;在上层有机相中加入500 mg AL-N、50 mg C18粉和15 mg GCB,涡旋振荡1 min,以9 000 r/min离心5 min,取上清液,用乙酸乙酯定容至15 mL,混匀后分多次倒至硅藻土柱中,用5 mL甲醇冲洗1次,再用5 mL 甲醇-氨水(99∶1,体积比)溶液冲洗2次,收集洗脱液在45 ℃下旋转蒸发至近干,用10 mL甲醇交换1次,旋转蒸发至近干,用甲醇-0.1 %甲酸溶液(1∶1,体积比)定容至2 mL,过0.22 μm尼龙滤膜,供HPLC-HRMS检测。
1.3 色谱-质谱条件
高效液相色谱条件:Hypersile Gold C8色谱柱(150 mm × 2.1 mm,3 μm);流动相A:含2 mmol/L甲酸铵+0.1%甲酸的水溶液;流动相B:含2 mmol/L甲酸铵+0.1%甲酸的乙腈水溶液,其中乙腈与水的体积比为95∶5;流速:0.3 mL/min;进样量:10 μL;洗脱程序为:0~4 min,95%A,4~7 min,95%~5% A,7~13 min,5%A,13~13.1 min,5%~95%A,13.1~18.1 min,95% A。
质谱检测条件:HESI-Ⅱ离子源;喷雾电压:正离子模式3 800 V/负离子模式2 700 V;气化温度:350 ℃;鞘气压:N2,35 arb;辅助气压:N2,10 arb;离子传输管温度:300 ℃;质量范围:m/z100~2 000。
1.4 定性与定量过程
根据精确分子量进行定性判断,与标准质量数偏差小于5 ppm。必要时可通过触发二级碎片进行子离子匹配定性。
分别吸取一定量各物质标准溶液,采用空白基质溶液配制成系列浓度标准工作溶液,采用基质匹配标准工作曲线进行外标法定量。
2 结果与讨论
2.1 质谱条件的优化
本实验的质谱方法采用全扫描和正、负离子切换模式进行测定,通过提取一级质谱的精确质量数进行定性和定量,必要时可设置自动触发二级模式进一步提高定性的准确性,其超高的分辨率有助于解析复杂的样品,确保Q-Orbitrap系统能够在一次色谱运行中最大限度地检测和鉴定代谢物。
通过直接进样,对每种海洋生物毒素的单标溶液进行全扫描,确定每种物质的电离方式和分子离子峰。结合其结构式及理论质量数,确定各物质的最佳电离模式及相应母离子的质量数,并进行二级质谱扫描,优化碰撞能量,获得碎裂片段。各物质的最优参数如表1所示,其中较为特殊的GTX的最强母离子为[M+H-SO3]+;RR则为双电荷,母离子为[M+2H]2+。

表1 11种海洋生物毒素标准物质及其方法参数列表Table 1 List name and method parameters of 11 marine biotoxins standards
(续表1)

No.AnalyteTypePhysic-chemical character Retention time(min)Exact mass(m/z)Type of parent ion8Dinophysistoxin(鳍藻毒素,DTX)DSPLipophilicity 9.59817.475 1[M-H]-9Okadaic acid(冈田软海绵酸,OA)DSPLipophilicity 9.29803.459 8[M-H]-10Microcystin LR(微囊藻毒素,LR)CyanotoxinsHydrophilic 8.67995.553 9[M+H]+11Microcystin RR(微囊藻毒素,RR)CyanotoxinsHydrophilic 8.52519.789 9[M+2H]2+
2.2 色谱柱的选择
由于11种毒素的理化性质各异,实验比较了Hypersile Gold C8色谱柱(150 mm×2.1 mm,3 μm)、Atlantis T3 色谱柱(150 mm×2.1 mm,3 μm)及HILIC亲水性色谱柱(150 mm×2.1 mm,3 μm)对待测物的分离效果,发现HILIC亲水性色谱柱适合于保留亲水性物质,但无法兼顾亲脂性物质;Hypersile Gold C8色谱柱及Atlantis T3 色谱柱对极性物质的保留均优于普通C18色谱柱,但Hypersile Gold C8色谱柱对亲水性物质的保留更优。因此,本实验选择Hypersile Gold C8(150 mm×2.1 mm,3 μm)进行色谱分离,各物质的选择离子流图见图1。


2.3 提取体系的确定
基于分级提取原理,采用水系(0.1%甲酸溶液)和有机系(乙酸乙酯)两类溶剂对海产品基质中理化性质各异的目标物进行提取。其中采用0.1%甲酸可对碱性亲水性目标物(如CYN、dc-STX、STX等)进行提取,并通过加入乙腈进行蛋白沉淀。采用乙酸乙酯则可实现对OA、DTX等亲脂性目标物的提取。
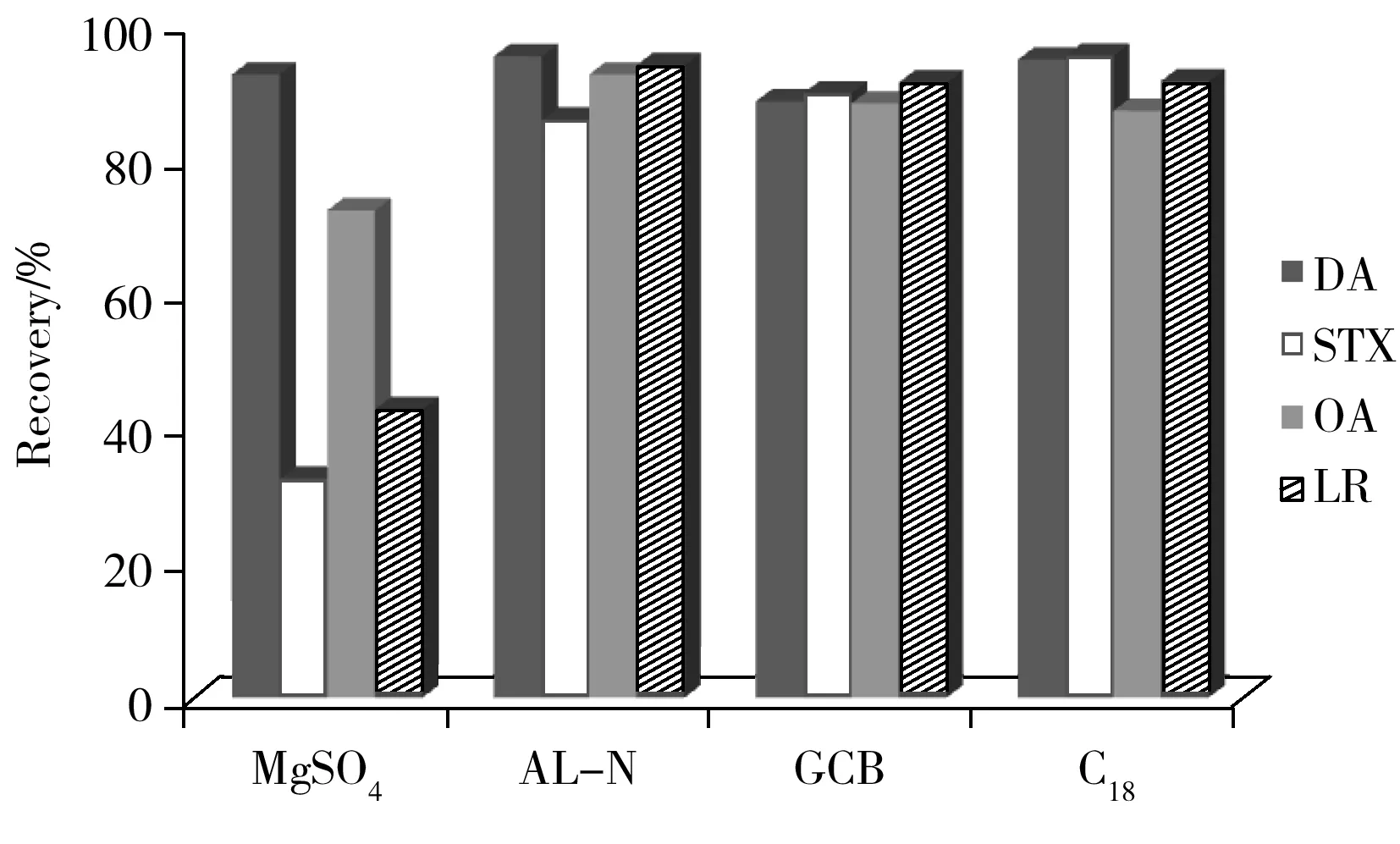
图2 不同净化载体对目标物回收率的影响Fig.2 Influence of different purification carriers on recoveries of analytes
2.4 dSPE净化体系的考察
dSPE技术中常用的净化载体有C18、PSA、GCB、中性氧化铝(AL-N)、无水硫酸镁等。Rubies等[16]采用QuEChERS法对水产品中亲脂性贝类毒素进行净化,并比较了C18和PSA作为净化载体的回收率,发现PSA对OA、DTX等多种贝类毒素的回收率影响较大。因此,本文仅对C18、GCB、中性氧化铝、无水硫酸镁4种净化载体进行比较。分别采用500 mg无水硫酸镁、500 mg中性氧化铝粉、15 mg GCB、50 mg C18粉作为净化载体[16-18],以DA、STX、OA及LR 4种物质为考核对象,考察了不同净化载体对目标物回收率的影响(见图2)。结果显示,无水硫酸镁对STX、LR的回收率影响较大,其回收率分别为32.5%及42.8%;而AL-N对STX、LR等极性物质略有影响,但总体回收率均大于85%;GCB由于其片层结构以及氢键作用,对于含内环、羟基及氨基结构的物质均有不同程度的影响,但由于添加量较少,总体回收率大于88%;C18除了对亲脂性的OA略有影响(回收率为87.1%)外,其余3种物质的回收率均超过90%。
进一步采用500 mg无水硫酸镁、500 mg AL-N、15 mg GCB、50 mg C18粉作为净化载体对基质液的有机相进行净化,将净化前后的基质液氮吹至恒重后进行比较。实验发现,无水硫酸镁对油脂等杂质虽具有一定的吸附,但效果不突出;AL-N对油脂的吸附能力最明显,能有效减少基质液中的油脂含量;GCB能将基质中的天然色素基本去除;而C18粉对减少油脂量和吸附色素均有一定效果。结合回收率和净化效果,本实验的dSPE法净化部分确定采用500 mg AL-N、15 mg GCB和50 mg C18粉3种净化载体组合。

表2 不同洗脱体系回收率的对比Table 2 Comparison of recoveries of different elution systems (%)
2.5 SLLE净化体系的考察
SLLE部分的净化根据前处理提取液水相部分的体积,采用处理量3 mL的硅藻土柱。该步净化的关键在于洗脱体系的优化。本文比较了有机相15 mL乙酸乙酯+乙腈洗脱后,再分别用10 mL乙酸乙酯、5 mL乙酸乙酯+5 mL甲醇、5 mL甲醇+5 mL甲醇(含1%氨水)3种洗脱体系对待测物进行洗脱,回收率结果见表2。可见,单纯使用乙酸乙酯洗脱时,其对亲脂性物质OA具有较好的效果,但其他3种亲水性物质的回收率欠佳。采用5 mL乙酸乙酯+5 mL甲醇替换后,DA和LR的回收率提升明显,但STX的回收率提高不明显。分别用5 mL甲醇和5 mL含氨水的甲醇依次洗脱后,由于在碱性或弱碱性环境下,碱性化合物以分子态形式存在,易被甲醇溶剂洗脱,且依次采用乙酸乙酯、甲醇、含氨水甲醇的洗脱顺序,减少了水溶性杂质,使得4种待测物均获得较高的回收率。因此,最终确定采用经dSPE净化的有机相,以5 mL甲醇、5 mL甲醇(含1%氨水)依次洗脱的程序进行。
2.6 线性关系、检出限与定量下限
将11种待测物的标准溶液用基质液稀释成不同浓度级别的标准工作溶液,并按优化后的条件进行测定,以质量浓度(x,μg/L)为横坐标,对应目标物的峰面积(y)为纵坐标,绘制标准曲线。结果表明,11种待测物在一定质量浓度范围内具有良好的线性关系,相关系数(r)均大于0.99(见表3)。采用逐级稀释的方式,并结合信噪比S/N>3以及S/N>10的要求,确定方法的检出限与定量下限。结果表明,11种毒素的检出限为1~10 μg/kg,定量下限为2~20 μg/kg,方法具有较高的灵敏度。

表 3 11种海洋生物毒素的线性范围、相关系数、检出限及定量下限Table 3 Linear ranges,correlation coefficients(r),LODs and LOQs of 11 marine biotoxins
2.7 回收率与相对标准偏差
分别选取黄鱼、蛏子空白基质,加入适量的混合标准溶液,使样品中目标物的加标浓度分别为定量下限的1、2、5倍,按上述方法处理后,测定样品的加标回收率及相对标准偏差(见表4)。结果显示,上述化合物的回收率为55.6%~122%,相对标准偏差(RSD)为5.4%~16%,除个别实验结果存在偏差,方法的精密度和准确度基本满足方法学的验证要求。

表4 11种海洋生物毒素的加标回收率及相对标准偏差(n=6)Table 4 Spiked recoveries and RSDs of 11 marine biotoxins(n=6)
2.8 实际样品的测定
采用本方法对市场采购的2个黄鱼样品、2个蛏子样品及2个梭子蟹样品进行检测。结果发现,除了在1黄鱼及1梭子蟹样品中分别检出12.5 μg/kg和19.3 μg/kg河豚毒素,1蛏子样品检出21.3 μg/kg鳍藻毒素以外,其余样品均未检出毒素。
3 结 论
本文基于dSPE及SLLE技术,通过一次性前处理,完成了对水产品中亲水性及亲脂性海洋生物毒素的提取、净化,并采用HPLC-Q-Orbitrap HRMS进行分析测定。该方法解决了不同理化性质的海洋生物毒素的“一站式”检测问题,操作简便可行,灵敏度及回收率良好,可为水产品中海洋生物毒素的快速筛查提供技术支撑。
