HDAC抑制剂通过miR-200c调控靶向CRKL抑制乳腺癌细胞增殖和侵袭的研究
2019-09-27李婧婷边学海
谭 洁,李婧婷,边学海
(吉林大学中日联谊医院 甲状腺外科·吉林省外科转化医学重点实验室,吉林 长春130033)
组蛋白的乙酰化修饰离不开组蛋白去乙酰化酶(HDACs),HDACs可影响多种癌基因或抑癌因子的表达,导致细胞的恶性增殖和肿瘤的发生[1]。HDAC抑制剂在体外实验中已证实可抑制乳腺癌细胞增殖,侵袭和迁移[2],然而HDAC抑制剂在乳腺癌中的抗癌机制以及调控信号等方面知之甚少。miRNAs是19-25个核苷酸的非编码RNA,在乳腺癌中异常表达,并为肿瘤行为和进展起调节作用[3]。据报道miR-200c可作为潜在肿瘤抑制因子,调节乳腺癌肿瘤血管生成、增殖、侵袭和迁移[4]。最近报道HDAC抑制剂与miR-200家族成员之间有直接关系[2]。据报道,衔接蛋白(CRKL)在人乳腺癌中过度表达,它作为肿瘤发生的启动因子可能在乳腺癌的肿瘤增殖和迁移中起重要作用[5],可能成为潜在的新型诊断标志物和治疗靶点。本研究探讨HDAC-miR200c-CRKL信号轴在乳腺癌细胞调节中意义,现报告如下。
1 材料和方法
1.1 细胞株、细胞转染及HDAC抑制剂处理
人乳腺癌细胞株MDA-MB-231,HCC-1143,HCC-1395,MCF-7,SKBR3,HCC-1419和MDA-MB-361,及两种正常的乳腺上皮细胞株MCF-10A和A1N4均购自美国典型培养物保藏中心,细胞维持在含10%胎牛血清的RPMI-1640中。 MCF-7需在培养基中加入5 mg/mL胰岛素生长。 MCF-10A和A1N4细胞在含0.5%胎牛血清、0.5 mg/mL氢化可的松、5 mg/mL胰岛素和10 ng/mL表皮生长因子的IMEM中培养。 所有细胞在5%CO2、37℃培养箱中生长并保持,每3-4 d传代一次,取对数生长期的细胞进行实验。
hsa-miR-200c-3p模拟物(目录号4464066),hsa-miR-200c-3p抑制剂(目录号4464084)和CRKL siRNA(目录号4392420)购自美国ThermoFisher公司,通过Lipofectamine 2000进行细胞转染。HDAC抑制剂Vorinostat(SAHA)购自美国Shelleckchem公司,用1 μM SAHA处理MDA-MB-231乳腺癌细胞24小时。
1.2 定量RT-PCR分析
用Trizol法从细胞提取总RNA。U6和β-Actin分别作为miR-200c和CRKL、HDAC1-11扩增的内参。用紫外分光光度计进行定量,测量D260 nm/D280 nm比值定量PCR分析。PCR扩增条件:95℃10分钟,紧接95℃20秒和60℃30秒,36个循环。由PCR仪自带软件自动完成扩增过程及数据分析。
1.3 Western-blotting印迹分析
使用RIPA缓冲液提取处理细胞的总蛋白质。加载蛋白质并在10%SDS-PAGE凝胶上分离,然后转移到PVDF膜上。用5%脱脂奶粉以1∶10 000稀释度将膜在4℃与抗CRKL的单克隆抗体温育过夜。用TBST洗涤后,膜与1∶20 000稀释度的抗小鼠IgG孵育1小时,按DAB显色试剂盒说明进行DAB显色。用凝胶图像分析系统扫描,进行吸光度分析,计算与其对应的内参条带的比值表示蛋白质水平。使用ImageJ软件测量蛋白质条带定量。
1.4 细胞增殖测定
通过MTT法测定MDA-MB-231细胞的活力和增殖。将以1×104个细胞接种于96孔培养板,每孔培养液总量100 μl,并留用SAHA处理。孵育24、48、72、96 h后,每孔加入20 μl的MTT,并在37℃下再温育2 h,在酶谱仪测量490 nm处吸光度值。
1.5 基质胶侵袭实验
为反映细胞浸润能力,在用miR-200c模拟物转染或用SAHA处理后,将5×104/孔细胞接种于适配于24孔培养板的BioCoat Matrige培养小室中。 使上室细胞在37℃、5%CO2孵育箱中过夜。棉签擦去上室内未侵入的细胞。侵入细胞用100%乙醇固定15分钟,苏木精-伊红染色,40倍放大光学显微镜下随机拍摄10个视野并进行细胞计数,取平均值。
1.6 划痕实验
为反映细胞迁移能力,将转染的细胞接种在6孔板中,当细胞数量达到80%时,去除上清液并用无菌200 μl移液枪头沿板中线划痕,用PBS清洗碎片。使用倒置显微镜在不同时间点获得连续照片。测量并记录刮痕两侧细胞前端之间的距离。
1.7 统计分析
每个实验重复三次。应用SPSS 19.0统计软件,各组之间的统计学差异使用t检验或χ2检验进行分析。P<0.05为有差异;P<0.01为显著性差异,具有统计学意义。
2 结果
2.1 miR-200c在乳腺癌细胞中呈低表达,与HDAC IIa成员的表达水平反比
与正常乳腺上皮细胞株相比,miR-200c在乳腺癌细胞株中均呈低表达;在三阴性乳腺癌细胞株MDA-MB-231,HCC-1143和HCC-1395中显著低表达(图1 A)。相反,HDAC2和IIa类HDAC包括HDAC9,HDAC4,HDAC5和HDAC7在乳腺癌细胞株中呈高表达(图1 B);尤其HDAC9在所有乳腺癌细胞株中均显著高表达。结果显示,miR-200c与HDAC2和IIa类HDACs的表达水平呈负相关。
2.2 过表达miR-200c可抑制乳腺癌细胞的增殖,侵袭和迁移
将miR-200c模拟物转染到MDA-MB-231中以过表达miR-200c(图2A)。过表达miR-200c显著抑制MDA-MB-231细胞的增殖和生长(图2A)。基质胶侵袭实验结果表明,过表达miR-200c转染的MDA-MB-231细胞的侵袭性显著降低(图2B)。划痕实验结果表明,miR-200c的过表达抑制了细胞的迁移(图2C)。结果支持miR-200c对乳腺癌增殖,侵袭和迁移起重要的抑制作用。
图1 (A) miR-200c在乳腺癌细胞中呈低表达。(B) HDAC9,HDAC4,HDAC5和HDAC7在乳腺癌细胞株中呈高表达,尤其HDAC9在所有乳腺癌细胞株中均显著高表达
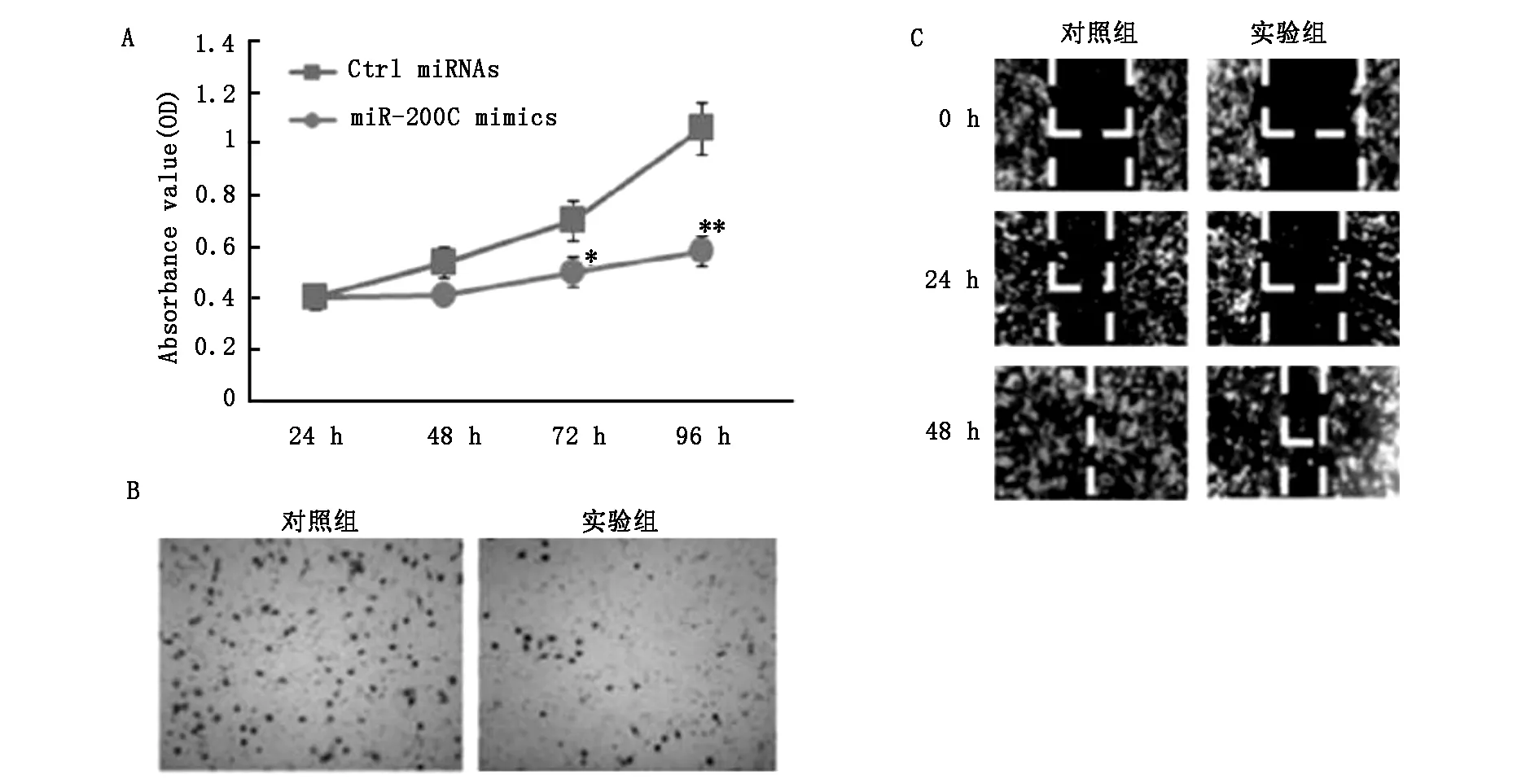
图2 (A) miR-200c模拟物转染乳腺癌MDA-MB-231细胞与非转染细胞,24,48,72或96 h增殖分析,与对照相比,*P<0.05和**P<0.01。 (B) 100 nM miR-200c转染MDA-MB-231细胞与非转染细胞,基质胶侵袭16 h后对比。(C) 100 nM miR-200c转染MDA-MB-231细胞与非转染细胞,划痕实验24 h、48 h后对比。
2.3 miR-200c直接靶向CRKL作用
CRKL在乳腺癌细胞株中均呈高表达,表明在乳腺癌细胞中,miR-200c水平与CRKL呈反相一致。为了鉴定miR-200c靶基因,利用生物信息学分析扫描了基因组中推定miR-200结合位点,并将CRKL鉴定为miR-200的预测靶基因。用miR-200c模拟物转染MDA-MB-231细胞后,Western blotting分析CRKL的蛋白表达,显示过表达miR-200c使CRKL表达下调了约68%(图3)。
2.4 HDAC抑制剂通过调节miR-200c和CRKL抑制乳腺癌细胞的增殖和侵袭
为了证实miR-200c是HDAC抑制剂的抗癌机制的功能性介质,将SAHA作为本研究的典型HDAC抑制剂。先用miR-200c抑制剂转染MDA-MB-231细胞,再用SAHA处理,结果显示,SAHA处理后miR-200c表达上升(图4A),相反CRKL表达下降(图4B);显著降低乳腺癌细胞的增殖并阻止其侵袭。通过用100 nM miR-200c抑制剂转染下调miR-200c可部分削弱SAHA对乳腺癌细胞增殖和侵袭的抑制。
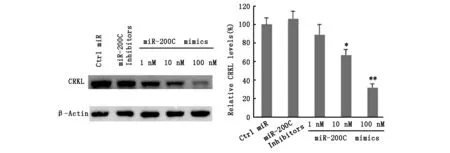
图3 分别用100 nM miR-200c抑制剂或1 nM,10 nM和100 nM miR-200c模拟物的对MDA-MB-231细胞处理24小时。通过蛋白质印迹试验,异位miR-200c表达的乳腺癌细胞的CRKL表达水平。 β-Actin用做对照。与对照相比,*P<0.05和**P<0.01。
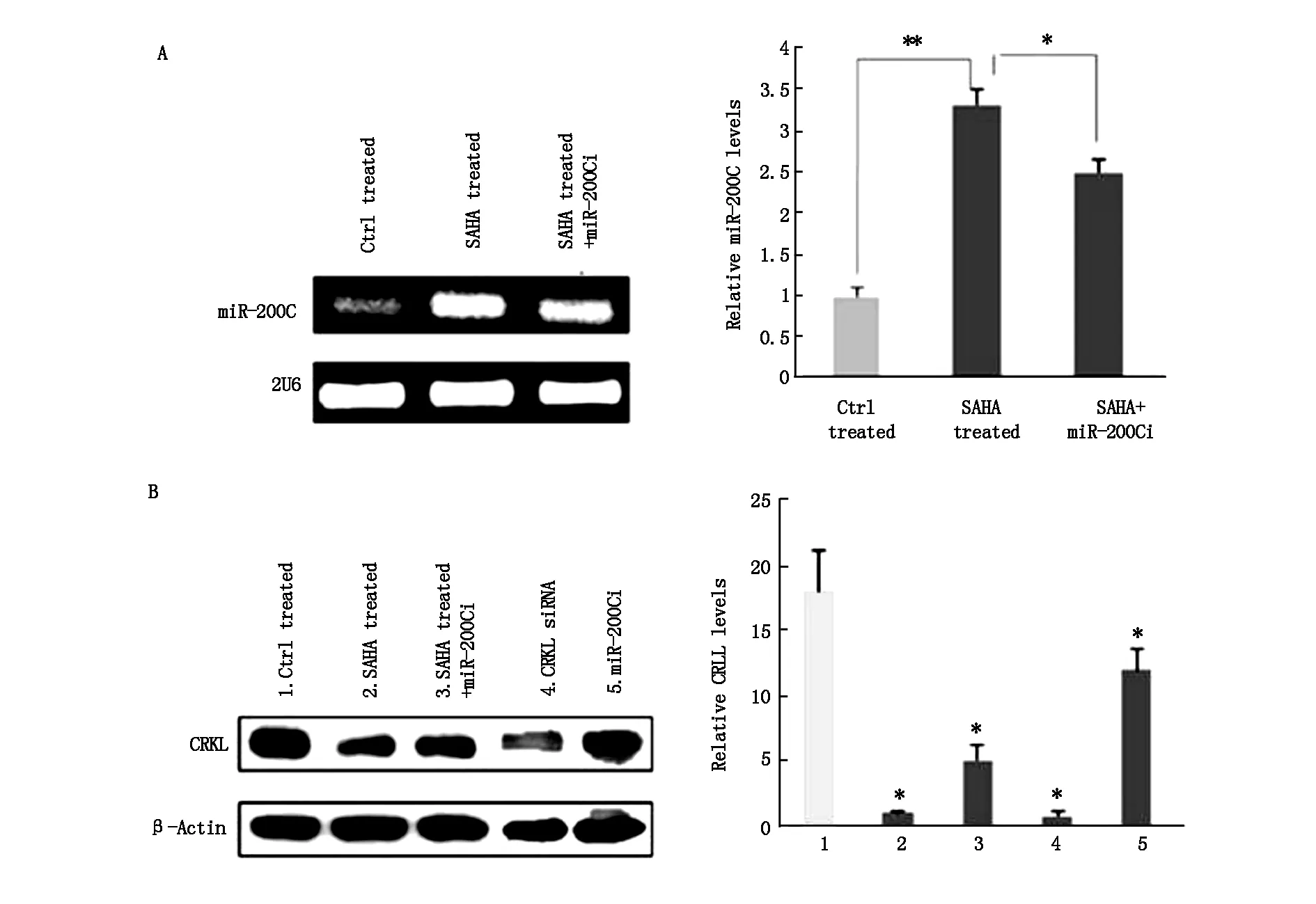
图4 (A)用1 μM SAHA单独处理或SAHA及100 nM miR-200C抑制剂联合处理MDA-MB-231细胞24 h,然后RT-PCR定量分析miR-200c表达水平,与对照相比,*P<0.05和**P<0.01。 (B)用1 μM SAHA,100 nM miR-200c,100 nM CRKL siRNA单独处理或SAHA及 miR-200c抑制剂的联合处理MDA-MB-231细胞24 h,然后Western印迹分析CRKL表达水平,与对照相比,*P<0.01
3 讨论
乳腺癌是女性恶性肿瘤死亡的主要原因之一[6]。与乳腺癌发生、发展相关的表观遗传学改变成为近年研究热点。HDAC抑制剂在乳腺癌中的抗癌机制目前尚不清楚。本研究结果表明HDAC抑制剂部分通过miR-200c下调CRKL表达,发挥抑制乳腺癌细胞发展、侵袭等的作用,为HDAC抑制剂治疗乳腺癌机制提供了新证据。
miR200家族成员作为潜在抑制因子与乳腺癌的生长,迁移和侵袭相关[7]。我们的研究显示miR-200c在乳腺癌细胞中呈现低表达;在用miR-200c模拟物转染乳腺癌细胞后,明显抑制了肿瘤细胞增殖,侵袭和迁移;相反,抑制miR-200c表达时,可促进细胞增殖和迁移。因此,这些结果表明miR-200c抑制乳腺癌的发生、发展。
本项研究证实:乳腺癌细胞中,miR-200c的直接靶标是CRKL。提高外源性miR-200c表达可显著降低CRKL蛋白水平。在用miR-200c抑制剂转染MDA-MB-231乳腺癌细胞,抑制miR-200c表达后,呈现CRKL蛋白表达上调。因此,miR -200c表达水平与CRKL蛋白水平呈负相关。CRKL作为致癌基因在许多恶性肿瘤中呈过度表达。CRKL过度表达在乳腺癌细胞的迁移和侵袭中发挥作用,并与不良预后显著相关[8]。研究结果首次确定CRKL蛋白水平与miR-200c表达之间呈显著负相关性,这为乳腺癌提供一种新的诊断标记和潜在的治疗靶点。
我们的数据显示在HDAC抑制剂处理后,乳腺癌细胞中miR-200c的表达水平显著上调,而CRKL表达在mRNA和蛋白质水平均下调。已有研究表明,HDAC抑制剂可以激活基因表达,抑制肿瘤细胞的生长和存活,HDAC抑制剂可作为潜在治疗癌症的新药。Vorinostat是美国FDA批准用于治疗皮肤T细胞淋巴瘤的第一个HDAC抑制剂[9]。HDAC抑制剂已证实能诱导p21Waf1/Cip1 mRNA的表达而抑制肿瘤的增殖[10]。最近研究,HDAC抑制剂SAHA可通过诱导上皮-间质转化(EMT)抑制乳腺癌细胞的迁移[11]。而HDAC抑制剂在乳腺癌中下游抗癌机制以及信号传导是否涉及其他表观遗传变化仍然不清楚。本研究结果证实miR-200c表达降低削弱了HDAC抑制剂在乳腺癌细胞中的抑制功能,表明miR-200c与HDAC抑制剂在抗乳腺癌过程中的相互作用。此外,miR-200c通过下调CRKL表达而抑制细胞增殖,迁移和侵袭。研究中,当乳腺癌细胞转染miR-200c抑制剂时,不完全阻断SAHA抑制细胞增殖和侵袭的作用。我们认为HDAC抑制剂SAHA抗癌作用至少部分通过miR-200c-CRKL轴来实现。
总之,本项研究表明miR-200c是通过下调CRKL水平来抑制乳腺癌的增殖,侵袭和迁移的。明确HDAC抑制剂的抗癌作用部分是通过调节miR-200c直接靶向CRKL来实现的。因此,HDAC-miR200c-CRKL信号轴可能在HDAC抑制剂抗乳腺癌机制中起重要作用。本研究揭示了HDAC抑制剂临床治疗乳腺癌的理论,并提示HDAC-miR200c-CRKL信号轴可能成为乳腺癌新的诊断标志物和潜在的治疗靶点。
