利用DMF溶解顺铂制备的DDP/PLA膜对口腔癌CAL-27细胞增殖抑制作用研究
2019-09-27贾颜鸿王欣琦郝秀峰张泽兵
贾颜鸿,周 童,王欣琦,栗 达,郝秀峰,张泽兵*
(1.吉林大学口腔医院,吉林 长春130021;2.吉林大学化学院)
静电纺丝技术所制备的纳米纤维膜具有优良的载药性能,广泛应用于抗生素、抗肿瘤药物和生物大分子等控制释放中[1]。本课题组在前期工作中,以H2O/CHCl3作为溶剂制备载顺铂(DDP)聚乳酸(PLA)静电纺丝膜(DDP/PLA膜),并作用于口腔鳞状细胞癌细胞CAL-27细胞取得了很好的抑制效果[2]。但因顺铂在H2O中的溶解度小,导致DDP/PLA膜载药量受到限制,影响对口腔癌细胞的抑制作用。本研究对该载药体系加以改进,改用N,N-二甲基甲酰胺(DMF)作为顺铂的溶剂,探讨改进后的DDP/PLA膜的载药效果及其对口腔癌CAL-27细胞的增殖抑制作用。
1 材料与方法
1.1 细胞、主要试剂和仪器
口腔鳞状细胞癌CAL-27细胞株由上海交通大学附属口腔医学院陈万涛教授惠赠。DMEM培养基、胎牛血清、胰蛋白酶消化液(以色列BI公司)、聚乳酸(PLA)(Mw≈150000)由吉林大学化学院提供,顺铂(DDP)(中国食品药品检定研究所),N,N-二甲基甲酰胺(DMF)(天津天泰精细化学品有限公司),噻唑蓝(MTT)(美国中杉金桥公司),牛血清白蛋白(BSA)(美国Sigma公司),注射泵(型号:SPLab02,保定申辰泵业有限公司),静电发生器(型号:DW-P303-1ACFO,东文高压电源(天津)有限公司),扫描电镜(型号:SU8020,HITACHI),紫外分光光度计(日本岛津公司),酶标仪(型号:SynergyHT,美国Biotek公司)。
1.2 静电纺丝纳米纤维的制备
1.2.1纺丝液配制 将PLA溶解在氯仿中,分别配制成5%wt、6%wt、7%wt、8%wt、9%wt的溶液。超声30分钟后室温搅拌直至聚乳酸全部溶解。加入体积分数为35%的无水乙醇,室温搅拌至溶液澄清均匀。
称取DDP使其与PLA质量比分别为1×10-3:1、2×10-3:1、3×10-3:1,并将其溶于1 ml DMF中配制成DDP溶液,将DDP溶液加入8%wtPLA溶液中,室温搅拌至溶液澄清均匀。
将200 mg BSA溶于1 ml去离子水中,超声至完全溶解,将BSA溶液加入11 ml 8%wtPLA溶液中,同时加入57 mg SDS,室温下磁力搅拌至溶液呈均一乳白色。
1.2.2静电纺丝 分别取上述纺丝液各5 ml于注射器中,针头连接静电发生器的电极,将铝箔固定在接受屏表面用以收集纳米纤维,接收屏与接地线相连,两端电压差设定为17 kV。设置注射泵推进速度为10 μl/min,纺丝距离 11 cm。烘箱干燥后密封保存。
1.3 扫描电镜测试/微观结构观测/形貌观察
将制备好的静电纺丝纳米纤维膜充分干燥后表面喷金处理,进行扫描电镜观察。采用Photoshopcc2019统计8种静电纺丝纳米纤维图片中的直径,根据标尺计算出纤维直径,每种纳米纤维选取至少50根进行统计。
1.4 体外释放性能测试
通过电子天平称取BSA/PLA膜66 mg,其中含有BSA 6 mg。将样品放入磷酸盐缓冲液(PBS溶液)浸泡,37℃条件下进行动态透析,每隔24 h取5 ml释放液,每取完一次后即时补充同等体积空白PBS液。收集18 d缓冲液,采用紫外分光光度计测试BSA在PBS缓冲液中的溶解浓度。测试波长范围为250 nm-300 nm,经检测BSA的特征吸收峰为280 nm,因此选择样品于波长280 nm处的吸光度数值,根据标准曲线方程,将相应吸光度换算成溶出的BSA的量,并绘制成体外释放曲线。
1.5 生物相容性测试
实验分为两组,对照组与PLA膜组。CAL-27细胞以3×104个/mL的密度接种于96孔细胞培养板中(0.2 mL/孔),于37℃、5%CO2孵箱中培养24 h后,对照组重新加入0.2 ml培养液,PLA膜组加入未载药空白PLA膜(8%wt)。继续培养24 h后,每孔加入20 μl MTT液,培养4 h后,弃掉上清液,每孔加入150 μl DMSO,室温下震荡10 min后使用酶标仪(490 nm波长)检测各孔OD值,根据数值计算细胞生存率。细胞生存率计算公式:细胞生存率=PLA膜组OD值/对照组OD值×100%。
1.6 检测加入不同载药量DDP/PLA膜后CAL-27细胞的生存率
实验分为4组,分别为对照组,DDP/PLA膜1(1×10-3:1)组,DDP/PLA膜2(2×10-3:1)组、DDP/PLA膜3(3×10-3:1)组,每组设置9个复孔。CAL-27细胞以6×104个/mL的密度接种于96孔细胞培养板中(0.2 mL/孔),于37℃、5%CO2孵箱中培养24 h,然后弃掉孔内上清液,各组加入相应药膜和新鲜培养液。培养1、3、5、7 d后,每孔加入20 μl MTT液,继续培养4 h,弃掉上清液,每孔加入150 μl DMSO,室温下震荡10 min后使用酶标仪(490 nm波长)检测各孔OD值,根据数值计算细胞生存率。
1.7 MTT法对比两种载药体系载相同量DDP对CAL-27细胞的生存率影响情况
根据溶解DDP的不同方法将两种载药体系命名为DDP/PLA(H2O)膜和DDP/PLA(DMF)膜,DDP/PLA(H2O)膜参考Hao等[2]所用方法制备,并向两种不同方法制备的载药膜中加入相同质量的DDP。实验分为3组,分别为对照组、DDP/PLA(H2O)膜组和DDP/PLA(DMF)膜组,每组设置9个复孔,CAL-27细胞以6×104个/mL的密度接种于96孔细胞培养板中(0.2 mL/孔),于37℃、5%CO2孵箱中培养24 h,然后弃掉孔内上清液各组加入相应药膜和新鲜培养液。培养1、3、5、7 d,每次取出一个孔板,分别加入20 μl MTT液,培养4 h后,弃掉上清液,每孔加入150 μl DMSO,室温下震荡10 min后使用酶标仪(490 nm波长)检测各孔OD值,根据数值计算细胞生存率。
1.8 统计学分析
2 结果
2.1 不同质量分数的PLA膜及不同载药量的DDP/PLA膜的微观形貌观察
SEM观察可见(如图1):当纺丝溶液浓度低于6%wt时,纤维出现弯曲断裂的情况,随着PLA质量分数的增加,纤维由杂乱扭曲逐渐变得均匀光滑,纤维直径也逐渐变大,当纺丝浓度达到7%时,基本可以得到连续的纤维,但仍存在纤维直径不均匀现象,当纺丝溶液浓度增加至8%wt时,纤维则表现的更加均匀连续,当继续增加纺丝溶液浓度至9%wt时,纺丝溶液粘度过高易导致注射器堵塞,纺丝困难。
向浓度为8%wt的PLA溶液中加入DDP溶液进行纺丝,载DDP后纤维表面光滑无结节或凸起,说明DDP很好的包裹在了纤维当中,加入DDP后直径明显增大,但提高载DDP的量对纤维直径并无明显影响(见表1)。

表1 各组静电纺丝纳米纤维直径统计表(单位:nm)
2.2 紫外分光光度分析法测定体外释放性能
根据图2累积释放曲线可以看出:药膜在PBS中释放均匀缓慢。第1天时,BSA/PLA膜中BSA的累积释放量为32.05%,随后逐渐表现为均匀缓慢的释放趋势,直至第19天释放率几乎与前一天持平达80.61%,表明BSA释放趋于完全。
2.3 生物相容性测试
通过对空白PLA膜进行细胞实验,以检验PLA作为药物载体在体外实验中的生物相容性。图3为加入空白PLA膜24 h后实验组与对照组细胞的生存率的对比情况。如图所示,与对照组相比,未载药PLA膜组的细胞生存率为(99.63±7.61)% (P>0.05),说明本实验中的药物载体PLA膜有很好的生物相容性。
2.4 不同载药量DDP/PLA膜作用后CAL-27细胞的生存率
图4为加入不同载药量DDP/PLA膜作用不同时间CAL-27细胞的细胞活性情况,第1天DDP/PLA膜1组、DDP/PLA膜2组、DDP/PLA膜3组对细胞的抑制作用不明显(P>0.05);第3天以后,各组细胞生存率下降明显(P<0.05),且细胞生存率的下降趋势呈时间和药物浓度依赖性,说明该载药体系成功提高了DDP载药量并增强了对CAL-27细胞的抑制作用。
2.5 两种载药体系载相同量DDP作用后CAL-27细胞的生存率
图5为投入等量DDP的两种载药体系对CAL-27细胞的增殖抑制情况,第1天,两种方法所制备的载药膜对CAL-27细胞的抑制效果没有明显差异(P>0.05),DDP/PLA(H2O)膜组细胞生存率为(89.36±3.10)%,略低于DDP/PLA(DMF)膜组(93.07±6.88)%;随后的第3、5、7天,DDP/PLA(DMF)膜组细胞生存率均明显低于DDP/PLA(H2O)膜(P<0.05),这表明改进后的体系具有更高的药物利用率和包封效果,使得等量的药物发挥更强的作用。

a:PLA膜(5%wt);b:PLA膜(6%wt);c:PLA膜(7%wt);d:PLA膜(8%wt);e:PLA膜(9%wt);f:DDP/PLA膜(1×10-3:1);g:DDP/PLA膜(2×10-3:1);h:DDP/PLA膜(3×10-3:1)
图1 SEM观察PLA膜与DDP/PLA膜表面形态
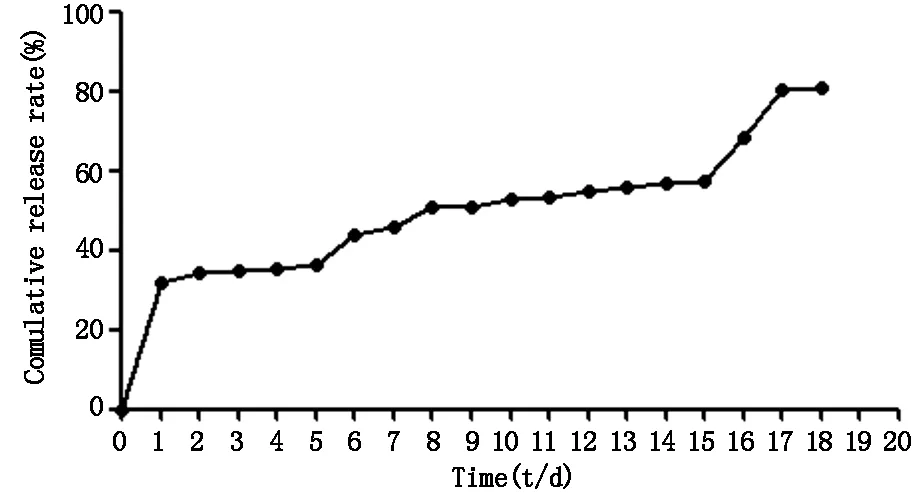
图2 BSA/PLA膜体外释放曲线
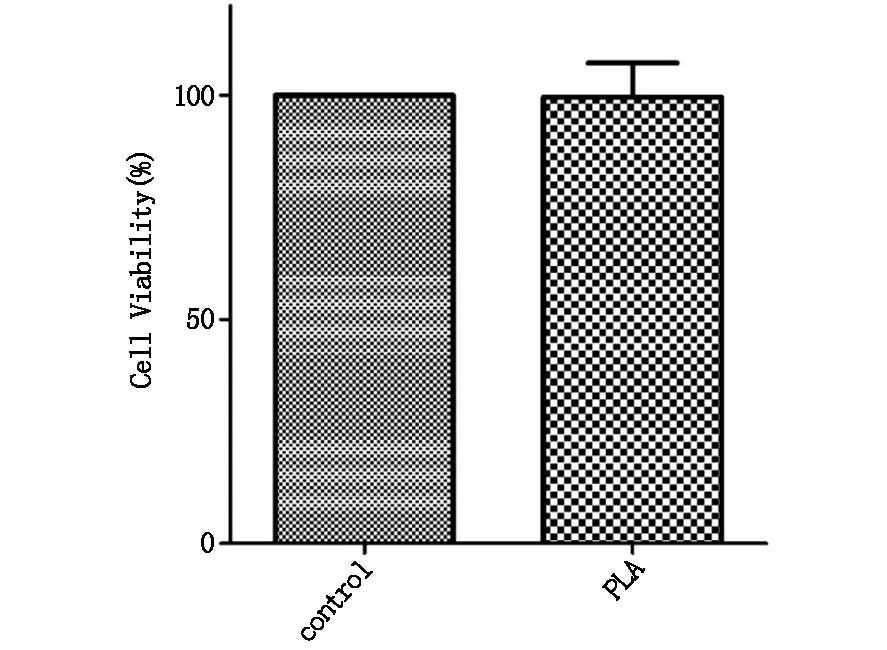
图3 加入空白PLA膜24 h后CAL-27细胞活性
3 讨论
纳米药物是纳米技术在生物学和医学领域迅速发展起来的重要产品,其中纳米纤维作为缓慢控制药物释放的载体,已被广泛应用于药物转运方面[3]。
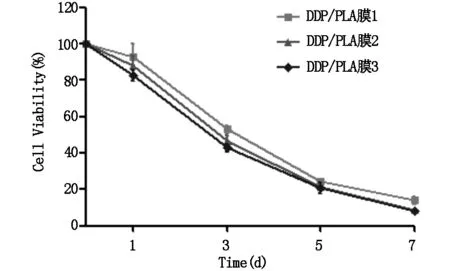
图4 加入不同载药量DDP/PLA膜后CAL-27细胞活性
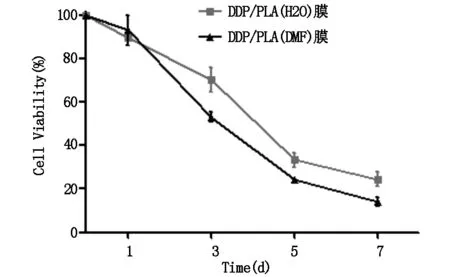
图5 两种载药体系载相同量DDP作用后CAL-27细胞的生存率
静电纺丝纳米纤维膜是一种利用静电纺丝技术制备的纳米材料,单位质量下表面积越大载药率和包封率越高,柔软无锐角可适应各种创口的形状,这些特性使其在伤口敷料、局部治疗、组织工程应用中均呈现良好效果[4]。在癌症治疗中,这种载体材料多用于局部化疗以减少对周围组织造成损害,实现高效安全的治疗目的。
Xu等[5]在聚乙二醇-聚乳酸二联支架中封装抗肿瘤药物卡莫司汀,作用于鼠恶性胶质瘤细胞,取得了持续的生长抑制效果,显示了电纺支架在化疗中的价值;Zhang等[6]制备了多层载顺铂静电纺丝膜用于防止肝癌术后的复发,结果显示,与其他治疗组相比,多层载顺铂静电纺丝膜组能够延长顺铂的释放时间,推迟肿瘤复发时间,延长生存时间并具有更少的毒性;Liu等[7]针对继发性肝癌(SHCC)研制了以PLA为载体包封抗癌药物阿霉素的静电纺丝载药纳米纤维,并对结节性、弥散性SHCC模型小鼠进行治疗效果的研究。结节性SHCC小鼠体内肿瘤生长受到显著抑制,弥散性SHCC小鼠的中值生存时间从14天延长到38天。局部化疗为预防SHCC及不能手术的患者提供了理想的选择。
本课题组多年来致力于口腔癌的治疗和发病机制的研究,制备了载顺铂聚乳酸静电纺丝纳米纤维膜(DDP/PLA膜)并进行表征,体外观察了该载药膜对口腔癌细胞CAL-27的抑制作用,结果显示,与直接给药相比,随着时间的推移,DDP/PLA膜对CAL-27的抑制作用逐渐增强,显示出缓释的优点[2]。但该载药体系存在载药量受限的问题,因DDP在H2O中溶解度低,每1gPLA最多搭载2 mg DDP;同时,纺丝液需要添加表面活性剂——十二烷基硫酸钠(SDS)才可使互不相溶的PLA溶液与DDP水溶液乳化成为乳液,造成载药体系不稳定。因此,为了使载药体系稳定、增加DDP载药量,本研究将DMF作为溶剂溶解DDP,结果表明:每 1 gPLA最多可搭载24 mgDDP,载药量得到了极大的提升;另一方面,利用DMF溶解DDP不需要SDS的乳化作用,得到的纺丝液更为稳定。扫描电镜显示顺铂较好的包裹在纤维中,静电纺丝纳米纤维微观形貌变化表现随着PLA浓度由5%增加到9%纤维趋向均匀平滑,纳米纤维平均直径由(181.58±66.22)nm增加到(1624.27±369.57)nm;载DDP后纤维直径平均维持在(2186.61±568.2)nm;体外释放速度测试显示24 h时累计释放量在35%左右,后期释放平缓,持续释放到18天左右。载DDP的纳米纤维膜对CAL-27细胞增殖能力的抑制作用具有药物浓度依赖性;改进后的体系表现出了更强的增殖抑制能力。
综上,本研究保持了原体系优良的生物相容性,以及缓慢释放药物的性能,但对DDP的搭载能力有了大幅度的提升,增强了对CAL-27细胞增殖抑制能力,并且提高了药物的利用率,为口腔鳞状细胞癌局部化学药物治疗奠定基础。
