MiR-217调节ERK1/2表达对结直肠癌细胞增殖的作用机制
2019-09-25唐玲玉李全朋葛贤秀聂俊杰
唐玲玉,李全朋,葛贤秀,聂俊杰,王 飞,缪 林
0 引 言
结直肠癌是世界上第三大常见的恶性肿瘤,同时是导致死亡的第四大癌症,约导致了2012年140万的新发病例和70万左右的死亡人数[1-2]。我国的结直肠癌发生率和死亡率也一直居高不下[3],故结直肠癌的诊断和治疗方面的研究极为重要。
微小RNA(microRNA,miRNA)是一类非编码的、内源性的、长约21~23nt的单链RNA,miRNA的发现人类了解癌症开拓了新的视角[4]。近年来,研究发现微小miRNA除了有作为癌症诊断和预后生物标志物的潜力之外,目前最热门的研究内容之一是研发靶向差异表达的miRNA的治疗策略[5-6]。
在之前的研究中,部分miRNA已经被发现与结直肠癌的进展相关[7],如miR-31可以通过负性调节RASA1(RAS P21 Protein Activator 1),从而激活KRAS系统,以发挥其在结直肠癌中的促癌作用后添加的参考文献[8]。MiR-217在结直肠癌中的研究甚少,本研究旨在阐明miR-217在结直肠癌患者癌组织中的表达水平、生物学作用和临床意义。此外,我们还进一步探索了miR-217在结直肠癌肿瘤细胞增殖中通过ERK1/2发挥部分作用。
1材料与方法
1.1 来源标本收集2015年1月至2019年1月于在南医大二附院50份结直肠癌组织标本(结直肠癌和癌旁组织),并迅速保存于液氮。根据瘤体直径分为肿瘤>5 cm(n=22)和≤5 cm(n=28)。病理分期、分级和淋巴结有无转移等信息由本院经验丰富的临床病理医师评估,结直肠癌Ⅰ-Ⅱ期标本有18份,IIIIV期32份。根据miR-217的表达中位数,将标本分为miR-217高表达组和低表达组。
1.2 细胞培养结直肠癌细胞系HCT116、HT29、SW480以及正常肠上皮细胞HcoEpiC购自中国科学院细胞培养库(中国上海)。结肠直肠癌细胞HCT116、HT29和SW480在含有10%胎牛血清的DMEM培养基中培养,正常的结直肠上皮细胞Hco-Epic在含有10%胎牛血清的RPMI-1640培养基中培养。培养皿于37℃、5%CO2和相对湿度为90%的培养箱中培养。每2~3天更换培养基,细胞汇合度至70%~90%时用胰酶进行消化、传代。
1.3 RNA分离和qPCR分析根据说明书用Trizol试剂(Life,美国)从组织或细胞中提取总RNA 后 ,用 NanoDrop2000c(Thermo Fisher Scientific,美国)测定RNA的总量和提取质量。分别用逆转录试剂盒和定量试剂盒完成RNA的逆转录和cDNA的定量,并将所得CT值根据GAPDH 用 2^(-ΔΔCT)进行标准化计算。引物序列为:GAPDH,正义链CTCTGCTCCTCCTGTTCGAC,反义链 GCGCCCAATACGACCAAATC;miR-217,正 义 链 CATGCTCGAGCTTATCAAGGATAAAATACCAT,反 义 链 GTTACGGCCGCTTGAGATCTACTCTAATTTCTTTTTTAAC;CyclinD1,正义链CAATGACCCCGCACGATTTC, 反义链 CATGGAGGGCGGATTGGAA;Bax,正义链 CCCGAGAGGTCTTTTTCCGAG,反 义 链 CCAGCCCATGATGGTTCTGAT;Bcl-2,正义链,GGTGGGGTCATGTGTGTGG,反义链CGGTTCAGGTACTCAGTCATCC。相对表达量以2(-ΔΔCT)法表示。
1.4 细胞分组和处理细胞汇合度约50%~60%时对细胞转染mimic(control mimic、miR-217 mimic)或inhibitor(control inhibitor、miR-217 inhibitor)和进行ERK1/2抑制剂(U1026)处理。具体分组为:过表达对照组(转染control mimic)和miR-217过表达组(转染miR-217 mimic)、低表达对照组(转染control inhibitor)和miR-217低表达组(转染miR-217 inhibitor)以及miR-217&ERK1/2低表达组(转染miR-217 inhibitor+U0126)。细胞转染步骤具体参照Lipofectamine 2000试剂(Invitrogen,美国)说明书。ERK1/2抑制剂具体处理:将U0126用DMSO溶解,处理细胞的使用浓度为50µmol/L。用U0126处理细胞时每1~2天进行一次换液。
1.5 细胞增殖试验用CCK-8测定试剂盒(biosharp,中国)进行细胞增殖测定,具体操作步骤为:各组细胞进行相应处理24 h后,将SW480和HCT116细胞(3000个细胞/孔)转移至96孔板中生长,并在37℃、5%CO2培养箱中培养。每24小时使用CCK-8测定法(A450nm)检测细胞活力,具体来说,向每个孔中加入20µL CCK-8溶液,并在孵育2 h后通过酶标仪对每个孔进行测量。每个样品一式三份进行分析。
1.6 克隆形成试验细胞处理24 h后,在6孔板每个孔中接种100个细胞,将细胞放置于37℃、5%CO2培养培养箱中培养,每3天更换一次培养基。培养7~12 d后弃培养基,4%多聚甲醛固定30 min,随后用2 mg/mL甘氨酸中和,最后用0.1%结晶紫染色细胞,拍照并观察。所有实验独立进行至少3次。
1.7 Edu实验根据说明书使用EdU标记/检测试剂盒(Ribobio,广州)评估细胞的增殖。简言之,将SW480和HCT116细胞在96孔板的每孔种植5×103个细胞。用相应处理方法处理96孔板中的细胞48 h后,将含50µmol/L EdU的培养基加入细胞培养物中并在37℃、5%CO2孵箱中孵育2 h。此后,将细胞用4%多聚甲醛(pH7.4)固定30 min,并在室温下用0.5%Triton X-100处理20 min。用PBS洗涤后,将样品在室温下用抗EdU工作溶液染色30 min。随后,将细胞与100 µL Hoechst(5 µg/mL)在室温下孵育30 min后在荧光显微镜下观察和拍照。每个样品一式三份进行分析。

1.8 蛋白质印迹分析收集细胞后使用RIPA裂解细胞。将匀浆置于冰上30 min,并在4℃下以12 000×g离心15 min。然后,使用BCA试剂盒(Thermo Fisher Scientific,美国)测定裂解物的蛋白质浓度,加入Loading buffer后100℃处理10 min。将等量的总蛋白质加载到10%梯度聚丙烯酰胺凝胶上,电泳后使用转膜仪将蛋白转移到PVDF膜上,然后在室温下用10%脱脂牛奶封闭2 h。将PVDF膜与特异性一抗在4℃温育过夜,并在室温下用相应的二抗孵育1 h。使用ECL印迹检测试剂(Thermo Fisher Scientific,美国)显影拍照。
1.9 统计学分析采用SPSS19.0软件进行统计分析,定量资料以均数±标准差(±s)表示。组间均值比较采用t检验。组间的生存分析通过Log-rank检验法进行检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1 MiR-217在结直肠癌组织和细胞株中低表达癌组织中miR-217表达量低于癌旁组织(P<0.01);直径>5 cm的瘤体中miR-217的表达量显著低于直径≤5 cm的瘤体(P<0.01);Ⅰ-Ⅱ期结直肠癌组织中miR-217表达显著高于Ⅲ-Ⅳ期组织(P<0.05),见表1。MiR-217高表达组患者生存期低于miR-217低表达组(P<0.01),见图1。此外,miR-217在正常结肠上皮细胞HcoEpic中的表达(1.007±0.005)显著高于结直肠癌细胞株 SW480(0.306±0.068)、HT29(0.471±0.034)、HCT116(0.576±0.066)中的表达(P<0.01)。
表1 miR-217表达与临床特征之间的关系(±s)Table 1 Correlation of miR-217 expression and clinicopathological characteristics( ± s)
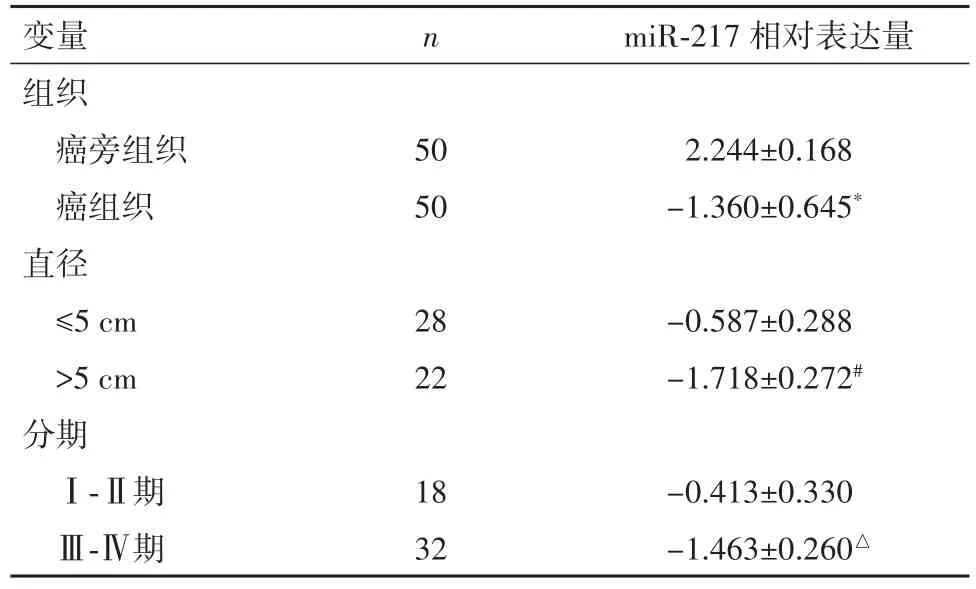
表1 miR-217表达与临床特征之间的关系(±s)Table 1 Correlation of miR-217 expression and clinicopathological characteristics( ± s)
与癌旁组织比较,*P<0.01;与直径≤5 cm,#P<0.01;与Ⅰ-Ⅱ期比较,△P<0.05
变量组织癌旁组织癌组织直径≤5 cm>5 cm分期Ⅰ-Ⅱ期Ⅲ-Ⅳ期n 50 50 28 22 18 32 miR-217相对表达量2.244±0.168-1.360±0.645*-0.587±0.288-1.718±0.272#-0.413±0.330-1.463±0.260△

图1 MiR-217高表达组和低表达组生存曲线Figure 1 Survival curve of high and low miR-217 expression groups
2.2 MiR-217过表达抑制SW480增殖MiR-217过表达组miR-217的表达量显著高于过表达对照组,克隆形成数量显著少于过表达对照组(P<0.01),见表2。MiR-217过表达组在转染后48、72、96h细胞活力均显著低于过表达对照组(P<0.01),见图2。MiR-217过表达组细胞增殖比例相较于过表达对照组也有所下降,见图3。
表2 SW480和HCT116细胞中各组MiR-217表达量和克隆形成情况(± s)Table 2 MiR-217 expression and colony formation ofeach group( ± s)
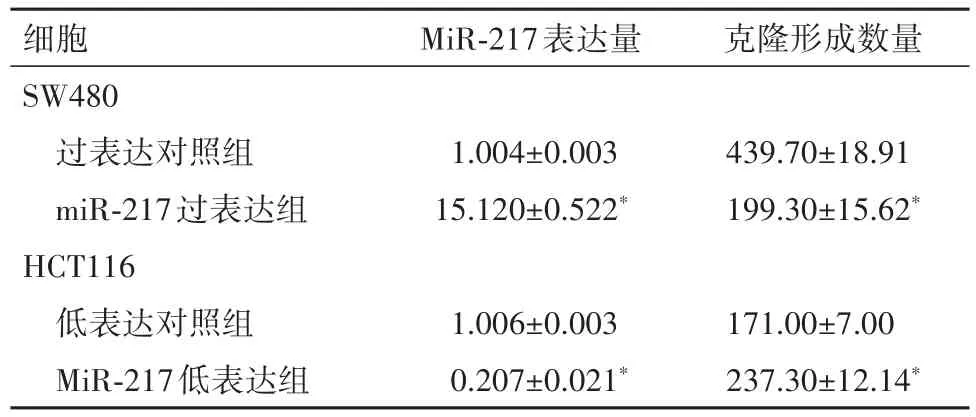
表2 SW480和HCT116细胞中各组MiR-217表达量和克隆形成情况(± s)Table 2 MiR-217 expression and colony formation ofeach group( ± s)
与过表达对照组比较,*P<0.01
细胞SW480过表达对照组miR-217过表达组HCT116低表达对照组MiR-217低表达组MiR-217表达量1.004±0.003 15.120±0.522*1.006±0.003 0.207±0.021*克隆形成数量439.70±18.91 199.30±15.62*171.00±7.00 237.30±12.14*
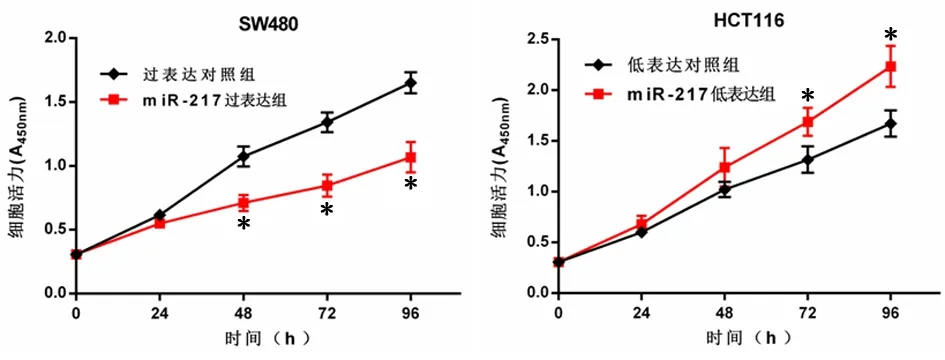
图2 MiR-217表达量对结直肠癌细胞株活力的影响Figure 2 Effects of miR-217 expression on cell viability of colorectal cell lines

图3 MiR-217表达对结直肠癌细胞增殖的影响(×200)Figure 3 Effects of miR-217 expression on proliferation of colorectal cell lines(×200)
2.3 抑制MiR-217促进HCT116增殖MiR-217低表达组miR-217的表达量显著低于低表达对照组,克隆形成数量显著多于低表达对照组(P<0.01),见表2。MiR-217低表达组在转染后72、96 h细胞活力均显著高于低表达对照组(P<0.01),见图2。细胞增殖比例相较于低表达对照组也有所增加,见图3。
2.4 MiR-217通过下调ERK1/2表达抑制结直肠癌细胞增殖MiR-217过表达组CyclinD1、Bcl-2(0.348±0.028、0.593±0.071)的mRNA水平显著低于过 表 达 对 照 组(1.008±0.006、1.008±0.005),Bax(2.108±0.189)的mRNA水平显著高于过表达对照组(1.012±0.009),差异具有统计学意义(P<0.05)。此外,miR-217在SW480中过表达后,ERK1/2的蛋白表达下降;而miR-217在HCT116中受到抑制后,ERK1/2的蛋白表达增加,见图4。在抑制miR-217表达的HCT116细胞中同时抑制ERK1/2,细胞活力在72、96 h重新得到下调(P<0.01),见图5。MiR-217低表达组较miR-217&ERK1/2低表达组克隆形成数量显著减少(P<0.01)。Edu实验也显示,在HCT116细胞中抑制ERK1/2的表达可使因miR-217下调而增强的增殖能力下降,见图6。

图4 SW480和HCT116细胞株中ERK1/2的表达Figure 4 Expression of ERK1/2 in SW480 and HCT116cell lines
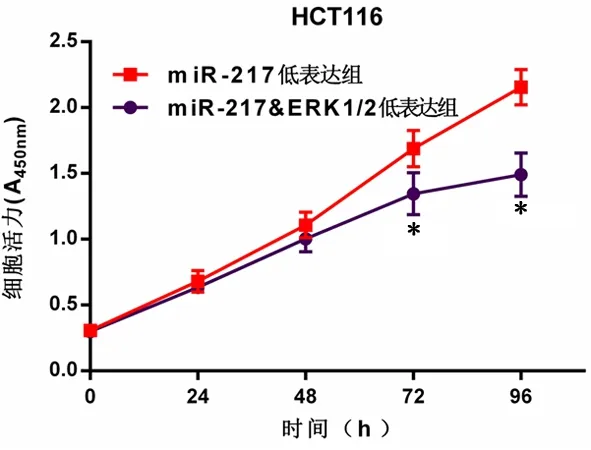
图5 MiR-217低表达组和miR-217&ERK1/2低表达组HCT116细胞活力Figure 5 CellviabilityofmiR-217inhibitorgroupandmiR-217 inhibitor+ERK inhibitor group in HCT116 cellline

图6 MiR-217低表达组和miR-217&ERK低表达组HCT116细胞株增殖情况Figure 6 ProliferationofmiR-217inhibitorgroupandmiR-217 inhibitor+ERK inhibitor group in HCT116 cellline
3 讨 论
根据时间概况和人口统计,预计到2030年结直肠癌的疾病负担将增加60%,将发生超过220万的新病例和110万结直肠癌死亡人数[9]。如果早期发现疾病,局部病变的治愈性手术是治疗结直肠癌的最佳方法。因此,结直肠癌的早期诊断是治疗该疾病的重要步骤之一[10-11]。越来越多的证据表明,各种生物标志物,包括DNA、mRNA、miRNA、lncRNA和蛋白质可用作各种疾病(如各种类型的癌症、中风、流产等)诊断和治疗的生物标志物[6,12-14]。例如,已有研究表明血清中的miRNA-141能够作为结直肠癌复发和发生肝转移的早诊标志物[15-17],且研究的初步结果已经证实miRNA-141与结直肠癌的疾病进展密切相关。
MiR-217在目前的研究中显示在多种癌症中下调[18-20],并且通过不同的机制来参与癌细胞凋亡、耐药、转移等。此外,miR-217在胃癌和乳腺癌中被发现表达上调[21-22]。这些发现表明,miR-217是作为促癌还是抑癌miRNA起作用取决于肿瘤类型。值得注意的是,结直肠癌中miR-217的研究甚少。与之前已有的研究一致[23-24],我们发现miR-217在结直肠癌组织和细胞中下调。MiR-217的过表达在体外抑制了结直肠癌细胞的表型,而抑制miR-217的表达则得到相反的结果,具体表现为miR-217可显著抑制结直肠癌细胞的增殖。之前的研究中显示大部分结直肠癌患者中,肿瘤细胞的增殖都由ERK1/2通路调控[25]。所以,ERK1/2一直是结直肠癌重要的治疗靶点。而在我们的研究中发现miR-217的表达被敲低后,ERK1/2的表达显著上调。相应的拯救实验也表明,即使在miR-217被敲低的HCT116细胞中,重新下调ERK1/2的表达可使HCT116的增殖受到抑制。简言之,miR-217抑制结直肠癌细胞增殖的作用与其下游的ERK1/2密不可分,但miR-217具体通过何种方式调节ERK1/2的表达仍需要进一步研究。
综上所述,本研究表明miR-217在结直肠癌组织和细胞中显著低表达,且与结直肠癌患者的临床分期、肿瘤大小、生存期相关。此外,进一步研究表明miR-217可通过下调ERK1/2的表达抑制结直肠癌细胞增殖。MiR-217或许有望成为结直肠癌患者诊断和治疗的新靶标。
