野生甘蒙锦鸡儿的组织培养研究
2019-09-25赵培霞
赵培霞, 王 雷
(内蒙古农业大学林学院, 内蒙古 呼和浩特 010019)
甘蒙锦鸡儿(CaraganaopulensKom.)是豆科锦鸡儿属植物,多年生灌木,高40~60 cm,主要分布于内蒙古、河北、山西、陕西、宁夏、甘肃、青海东部、四川北部、西藏昌都地区,生长于海拔高达3 400 m的干山坡、沟谷、丘陵[1-3]。甘蒙锦鸡儿是干旱地区良好的水土保持树种[4],枝叶营养物质含量高,为优良饲料;其茎干粗硬,耐燃烧,可做薪柴;是优良绿肥植物[5]。
甘蒙锦鸡儿是一种花色鲜艳、叶形美观、抗旱性极强、适应性比较广的我国特有野生植物。随着城市园林绿化建设的不断发展,野生花卉的引种驯化和开发应用越来越受到重视[6]。如果将乡土植物引种到北方城市园林绿化建设中,可在层次、色彩感方面起到一定的作用。除在园林方面价值显著外,药用方面的价值也很显著,具有抗炎、抗肿瘤、抗病毒、降压等多种药理作用[7]。目前,肖岸容[8]、杨中铎[9]等对甘蒙锦鸡儿的优良化学成分进行了详细的研究。冷肖荀[10]对甘蒙锦鸡儿芽苗切根移栽容器育苗进行了试验,指出使用IBA和ABT,可以极显著地促进侧根数的增加。瞿元清[11]在试验中发现甘蒙锦鸡儿在荒山造林的成活率方面明显较其他树种高。马成仓[12]对内蒙古高原地区的甘蒙锦鸡儿的光合作用和水分代谢进行研究。甘蒙锦鸡儿多用种子繁殖,但甘蒙锦鸡儿不仅果荚内种子数量极少,而且种子害虫严重,种子被害率很高。因此,依靠种子繁殖进行资源扩繁困难重重。锦鸡儿属其他种[13-15]在组培方面都有相关研究,而甘蒙锦鸡儿在组培方向的研究还处于相对空白状态。本试验拟利用植物组织培养技术,找到合适的激素搭配,培育出具有优良性状的植株,为甘蒙锦鸡儿今后的引种及扩大繁殖提供理论基础。
1 材料与方法
1.1 材料
试验用的甘蒙锦鸡儿成熟种子于学校指定种子公司购买,置于4℃冰箱保存,选取籽粒饱满的种子备用。
1.2 方法
1.2.1种子预处理与消毒 选取成熟饱满的种子置于圆柱瓶中用蒸馏水浸泡一晚(种子硬度强),将浸泡后的种子置于超净工作台中,用75%的酒精浸泡30 s,此浓度的酒精有很强的穿透力和杀菌力,但却不能彻底灭菌[16],用无菌水冲洗3~5次,再用2%的次氯酸钠浸泡,浸泡时不停的摇晃瓶子,作6种梯度进行灭菌:0,8,10,12,15,17 min,最后用无菌水冲洗3~5次,用滤纸吸干净种子表面的水分,接种于MS(Murashige and Skoog medium,MS培养基)培养基中,7 d统计污染率。
1.2.2种子萌发 在超净台中,将经过不同灭菌时间处理的种子接种于以MS+3%蔗糖+0.6%琼脂为基本培养基,分别添加不同质量浓度的6-BA(6-Benzylaminopurine,6-苄氨基腺嘌呤)(0.2,0.5,1.0,1.5 mg·L-1)和NAA(α-Naphthalene acetic acid,α-萘乙酸)(0.05,0.1,0.3 mg·L-1)共12个组合,每种培养基接种10瓶,每瓶接个2外植体,置于光培养,从接种之日起30 d观察芽的萌发情况,并统计种子诱导率及萌发新芽的生长状况。
1.2.3芽的增殖 甘蒙锦鸡儿的组培苗长到一定高度时,剪取含有一对腋芽的茎段,接种于以MS+3%蔗糖+0.6%琼脂为基本培养基,分别添加不同质量浓度的6-BA(0.2,0.5,1.0 mg·L-1)和NAA(0.05,0.1,0.2 mg·L-1)。按照2因素3水平正交实验安排,共9种组合,选择生长良好的芽增殖继代2~3次,继代周期为30 d,并在4周左右观察芽的增殖系数和植株生长状况。
1.2.4生根培养 将生长良好的植株,移植于以1/2 MS+2%蔗糖+0.6%琼脂为基本培养基,分别添加1)IBA(Indole-3-butyric acid,吲哚丁酸) 0.3 mg·L-1+ NAA 0.3 mg·L-1;2)IBA 0.5 mg·L-1+ NAA 0.5 mg·L-1;3)IBA 1.0 mg·L-1+ NAA 0.8 mg·L-1;4)IAA(Indole-3-acetic acid,吲哚乙酸)0.5 mg·L-1;5)IAA 0.5 mg·L-1+ GA3(Gibberellin,赤霉素) 0.15 mg·L-1;6)IAA 0.1 mg·L-1;7)IBA 0.3 mg·L-1;8)IBA 0.5 mg·L-1+ NAA 0.05 mg·L-1的培养基上进行生根培养,30 d后观察生根数,生根时间和试管苗的生长状况。
1.2.5炼苗与移栽 将经生根培养的甘蒙锦鸡儿幼苗移栽到已经灭菌的草炭土∶珍珠岩∶蛭石=6∶3∶1的混合基质中,前3 d密封处理,3 d后期间可揭少盖通风换气,15 d后统计成活率。
1.2.6培养条件 培养基PH范围为5.75~5.85,于121℃高压灭菌锅(1.1 Mpa)内灭菌,后放于工作台冷却备用。接种后放于温度为25±1℃,光照强度为50 μmol·m-2·s-1,光照时间为12 h的培养室。
1.2.7数据处理 利用SPSS 20.0对数据进行方差分析处理。
数据采用以下公式进行处理:
污染率(%)=被污染的外植体数/接种的外植体总数×100%;
芽诱导率(%)=发生萌发个数/外植体总数×100%;
丛生芽诱导率(%)=长丛生芽的外植体数/外植体总数×100%;
增殖系数=形成丛生芽的总数/外植体总数;
生根率(%)=生根的外植体个数/外植体总数×100%。
2 结果与分析
2.1 种子预处理与消毒
试验用种子含水率比较低,生理活动非常微弱。故对种子进行预处理,浸种于蒸馏水的目的是使种子较快地吸水,达到能正常发芽的含水量。外植体的消毒灭菌是组织培养的难点之一,因此确定合适的灭菌试剂和灭菌时间是极其重要的一步。试验所采用的外植体为成熟种子,材料消完毒后,将种子和药剂接触的种皮去除(种皮部分可能携带细菌)接种于MS培养基。接种7 d后统计污染率、褐化率和成活率见表1。污染率随着灭菌时间的加长而逐渐减小,褐化率也逐渐减小,但随着灭菌时间的加长,污染率、褐化率又逐渐加大,在15 min是污染率达到最小,种子出芽率为最高,而且种子生长状态比较好,如果灭菌时间过长,使种子失去活性,严重影响种子的发芽率。因此,在甘蒙锦鸡儿无菌苗体系建立过程中,采用75%酒精灭菌30 s配合次氯酸钠消毒15 min为较为适宜的方法。

表1 不同方式对甘蒙锦鸡儿种子灭菌效果的影响Table 1 Effect of different methods on seed disinfection of C. opulens
2.2 不同激素组合对初代培养的影响
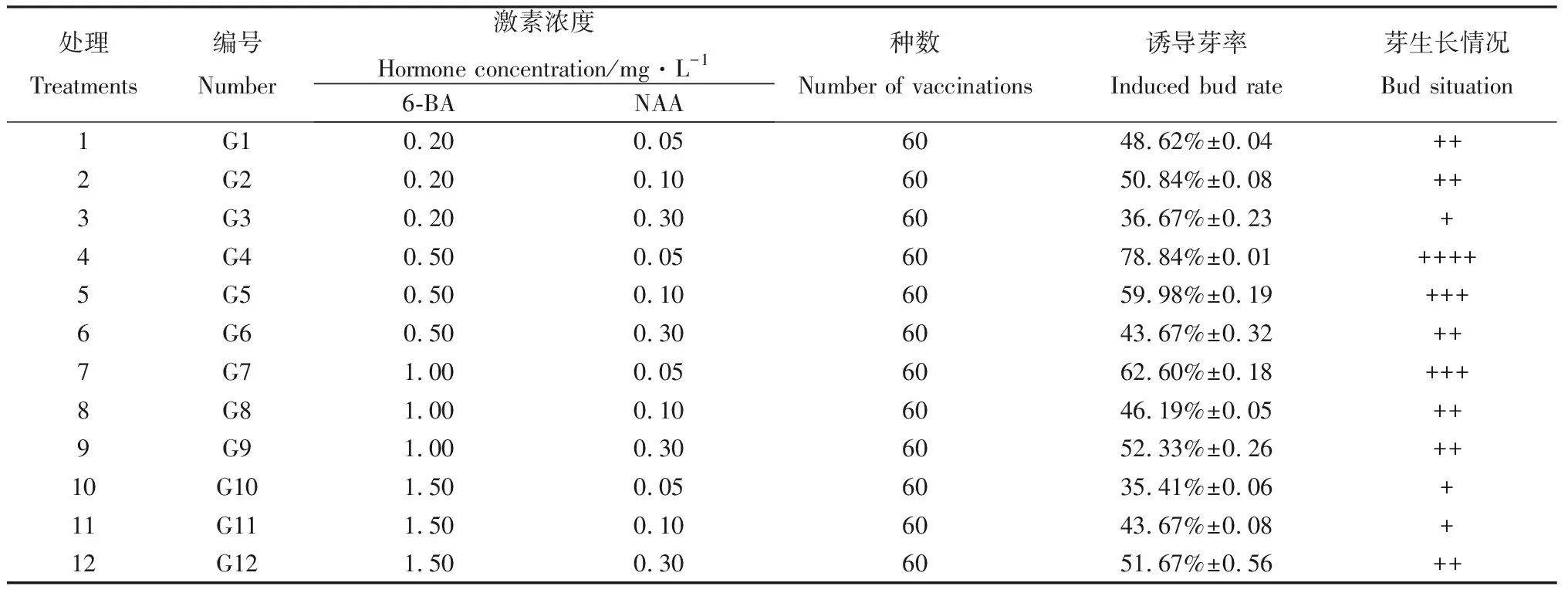
将甘蒙锦鸡儿的种子接于以MS培养基为基本培养基,添加不同浓度6-BA和NAA组合的12种培养基中,生长过程见图1。表2是甘蒙锦鸡儿在各不同浓度激素处理下培养30 d后,种子的萌发率及新芽的生长状况。

图1 甘蒙锦鸡儿组织培养过程Fig.1 Process of tissue culture of C. opulens注:a:外植体;b-c:丛生芽诱导;d-f:生根植株;g-i:试管苗生根;j-l:炼苗Note:a:Explants;b-c:Cluster bud induction;d-f:Rooting plants;g-i:Rooting of test-tube plantlets;j-l:Training seedling
表2 不同激素浓度组合对甘蒙锦鸡儿成熟胚芽诱导的影响Table 2 Effects of different hormone concentration combinations on induction of mature embryo of C. opulens
处理Treatments编号Number激素浓度Hormone concentration/mg·L-16-BANAA种数Number of vaccinations诱导芽率Induced bud rate芽生长情况Bud situation1G10.200.056048.62%±0.04++2G20.200.106050.84%±0.08++3G30.200.306036.67%±0.23+4G40.500.056078.84%±0.01++++5G50.500.106059.98%±0.19+++6G60.500.306043.67%±0.32++7G71.000.056062.60%±0.18+++8G81.000.106046.19%±0.05++9G91.000.306052.33%±0.26++10G101.500.056035.41%±0.06+11G111.500.106043.67%±0.08+12G121.500.306051.67%±0.56++
注:++++生长非常,+++好,++一般、+不是很好
Note:+++ growth is very,+++ good,++ average,+ not very good
F检验结果见表3:因素6-BA、NAA及两者的交互作用对种子诱导效果产生显著影响。6-BA、两者的交互作用及NAA的F值从大到小依次为13.18,8.86和7.48。说明6-BA对种子的诱导率影响最大,两者的交互作用次之,然后是NAA。要确定哪个水平影响效果显著,则需进行多重比较分析,采用Duncan方差分析见表4,5。
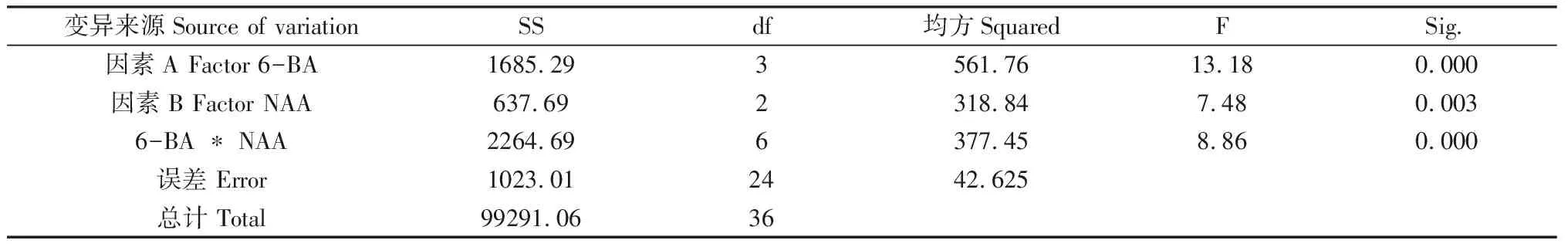
表3 诱导芽率的多因素方差分析Table 3 Multivariate variance analysis of induced bud rate
注:P<0.05.下同
Note:P<0.05. The same as below
从表4得出:在P<0.05水平下,6-BA在A2(0.5 mg·L-1)、A3(1.0 mg·L-1)水平时与其他2个浓度水平A1、A4呈现显著性差异,A2与A3水平间差异不显著、A1与A4水平间差异不显著;在P<0.01水平下,6-BA在A2、A3水平时与其他2个浓度水平A1、A4呈现极显著性差异,A2与A3、A1与A4水平间差异不显著;根据均值大小,即当6-BA为A2(0.5 mg·L-1)水平时对诱导芽率影响最显著。

表4 A因素(6-BA)4水平Duncan检验Table4 Duncan test of factor A(6-BA) on 4 levels
注:不同小写字母表示0.05水平差异显著,不同大写字母表示0.01水平差异显著,下同
Note:Different lowercase letters indicate significant differences at the 0.05 level,and different uppercase letters indicate significant differences at the 0.01 level,The same as below[17]
从表5得出:在P<0.05水平下,NAA在B1(0.05 mg·L-1)水平时与B2,B3水平呈现显著性差异,B2与B3水平间差异不显著;在P<0.01水平下,NAA在B1水平时与B3呈现极显著性差异,B1与B2,B2与B3水平间差异不显著,即诱导率最高时为NAA的B1(0.05 mg·L-1)水平。综上所述,甘蒙锦鸡儿成熟种子初代培养的适宜浓度组合为6-BA 0.5 mg·L-1+ NAA 0.05 mg·L-1,诱导率最高为78.84%。

表5 B因素(NAA)3水平Duncan检验Table5 Duncan test of factor B(NAA) on 3 levels
2.3 不同浓度激素配比对芽继代增殖的影响
试验采用2因素3水平正交设计,在添加不同质量浓度的6-BA和NAA的9种培养基中进行单芽继代增殖影响的试验,甘蒙锦鸡儿的实生苗长到一定高度时,将其茎剪下,并将茎切成小段进行接种,几天后基部开始膨胀产生愈伤组织,茎段上部在生长的同时产生从生芽。表6是30 d的统计结果。
为了对比2种因素各浓度水平对芽增殖的影响进行极差分析,从极差值R直观可知,NAA对增殖系数的影响最大,其次是6-BA,优选水平后,确定A2B1的增殖效果最好,即6-BA 0.5 mg·L-1+ NAA 0.05 mg·L-1,增殖系数最高为3.30(见图1-b,c),在该培养基上继代培养后,一年可以实现3.311≈510 000棵具有相同优良性状的植株,通过这种方式可以实现快速扩繁的目的。
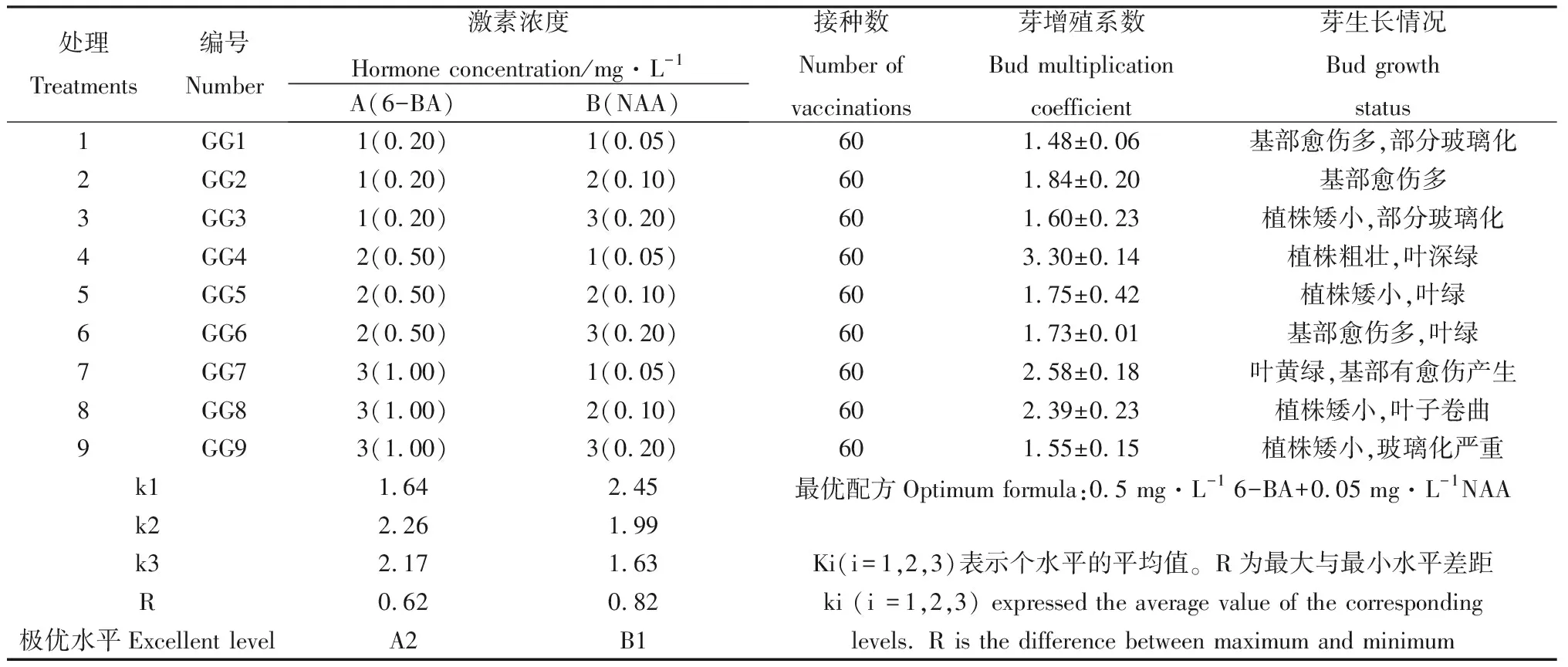
表6 不同激素组合对甘蒙锦鸡儿不定芽继代芽增殖的影响Table 6 Effects of different hormone combinations on increment of adventitious buds of C. opulens
对数据进行方差分析如表7所示,6-BA、NAA及两者的交互作用对芽增殖效果产生显著影响。两者的交互作用、NAA、6-BA的F值从大到小依次为10.21,6.67和6.39,说明两者的交互作用对继代增殖产生丛生芽的影响最大,NAA次之,然后是6-BA。为确定最佳激素组合,需进一步进行Duncan分析。
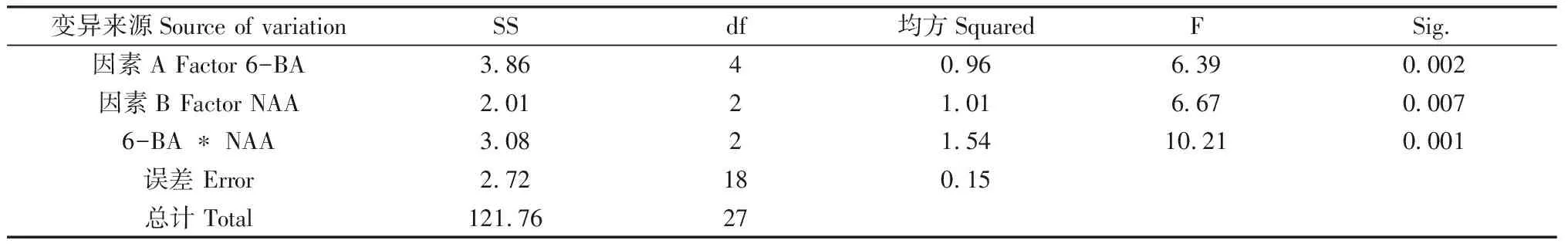
表7 芽增殖率的多因素方差分析Table 7 Multivariate variance analysis of bud proliferation rate
从表8得出:在P<0.05水平下,6-BA在A2(0.5 mg·L-1)、A3(1.0 mg·L-1)水平时与A1呈现显著性差异,A2与A3水平间差异不显著,在P<0.01水平下,6-BA在A2、A3水平时与A1呈现极显著性差异,A2与A3水平间差异不显著,故根据均值大小,6-BA为A2(0.5 mg·L-1)水平时对增殖率影响最显著。

表8 A因素(6-BA)3水平Duncan检验Table8 Duncan test of factor A(6-BA) on 3 levels
从表9得出:在P<0.05水平下,NAA在B1(0.05 mg·L-1)水平时与B2、B3水平呈现显著性差异,B2与B3水平间差异不显著;在P<0.01水平下,NAA在B1水平时与B3呈现极显著性差异,B1与B2水平间差异不显著、B2与B3水平间差异不显著,即NAA为B1(0.05 mg·L-1)时增殖率最高。综上所述,适宜增殖的浓度组合为6-BA 0.5 mg·L-1+ NAA 0.05mg·L-1,与极差分析结果一致。

表9 B因素(NAA)3水平Duncan检验Table 9 Duncan test of factor B(NAA) on 3 levels
2.4 不同浓度激素配比对芽生根的影响
在所设计的8种生根培养基上培养4周后发现,均有不同程度的生根(见表10、图1-g,h,i)。添加激素IAA的培养基生根效果要好于添加激素IBA的培养基的生根效果,生根时间短,生根率高,根数量多,植株健壮。在只添加IAA的培养基中,随着IAA浓度的增加生根率逐渐下降,高浓度激素对生根产生一定的抑制作用,但是当IAA浓度同为0.5 mg·L-1时,配合添加GA 0.15 mg·L-1时,生根率有所增加。随着IBA浓度的增加生根率无明显变化。S2与S1相比、S4与S3相比,IBA浓度不变,NAA浓度增加,生根率也明显增加但是生根时间明显加长,其原因主要是NAA浓度增加在切口处形成大量愈伤组织,延长了生根的时间。
接种培养30 d统计发现:在S7:1/2 MS + IAA 0.5 mg·L-1+ GA 0.15 mg·L-1和S8:1/2 MS + IAA 0.1 mg·L-1两种培养基上生根率都较高,但是在S7中生根大多数为单根,综合考虑S8:1/2 MS + IAA 0.1 mg·L-1这一培养基上的培养效果最好生长旺盛,植株高大,叶色深绿(如图1-f),主根明显(如图1-g),根系发达,其平均生根率为63.16%,平均生根数为2.17条·株-1,平均株高5.5 cm。
2.5 炼苗与移栽
将生根的甘蒙锦鸡儿取出,用水洗掉残余培养基,移栽到草炭土∶珍珠岩∶蛭石=6∶3∶1的混合基质中,7天后统计成活率为90%,并且植株健壮(见图1-j,k,l)。
3 讨论
组培试验中面临的最大问题是外植体极易受感染,因此,在试验各个步骤中都应该谨慎。试验过程中,灭菌不充分,工作台中有菌等都是感染的诱因,导致后期试验无法进行。甘蒙锦鸡儿种子病虫害较多,在灭菌过程中无法消除干净,对后期感染率有一定影响。目前来看,甘蒙锦鸡儿种子的灭菌以15 min最为适宜,种子的感染率最小,如果加长灭菌时间,种子活性下降。锦鸡儿属植物种子病虫害较多,影响种子发芽率,种子存储时间越长,发芽率和萌发速度都大大降低[18],因此在选择种子的时候应选择当年生的进行组织培养最好,萌发的植株生长状况良好,更有益于后期的继代增殖。
试验选择成熟种子为外植体萌发切取茎段诱导分化苗,没有经过愈伤组织的诱导及分化,简化了培养流程,极大程度上缩短了时间,此种方法培养的组培苗可以稳定地保持母体的优良特性[19]。
在组培试验中,激素种类以及浓度组合错综复杂,实验采用正交设计对增殖方案的优化,避免了单因素的局限性,发挥了正交设计的优势:即用最少的处理得到最佳的组合;另一方面可以确定组织培养各个阶段的关键因素[17]。成熟胚的组织培养研究比较少,沈海龙[20-21]是利用未成熟胚进行组织培养,本试验所用材料为甘蒙锦鸡儿成熟胚。在增殖方面,增殖系数不是特别理想,后期可以寻找更合适的激素配比使得诱导芽增殖系数更大。在植物根系的诱导过程中,根系的生长所需的营养物质主要来源于激素,不同激素配比对植物的作用明显不同。甘蒙锦鸡儿在生根方面,大多数植物使用IBA[22-23],但本试验发现使用IAA生根效果好,生根时间短,与武春燕试验结果相同[24]。目前关于甘蒙锦鸡儿组培方面研究暂处于相对空白状态,对后期的研究有参考价值。
4 结论
试验研究发现,在进行甘蒙锦鸡儿的组织培养时,其种子的灭菌以75%酒精灭菌30 s加氯酸钠灭菌15 min最为适宜,存活率高;种子萌发培养基以MS + 6-BA 0.5 mg·L-1+ NAA 0.05 mg·L-1最佳,诱导率最高为78.84%;增殖培养基以MS + 6-BA 0.5 mg·L-1+ NAA 0.05 mg·L-1最佳,增殖系数为3.30;以1/2 MS + IAA 0.1 mg·L-1生根效果最好,植株健壮;将生根的植株移栽到草炭土∶珍珠岩∶蛭石=6∶3∶1的混合基质中,成活率为90%;本研究最终建立了一套野生甘蒙锦鸡儿的组培体系,为以后野生甘蒙锦鸡儿引种到城市园林建设中提供一定的借鉴作用。
