生物结皮演替对高寒草原土壤微生物群落的影响
2019-09-25秦福雯康濒月姜风岩徐恒康周华坤位晓婷刘晓丽邵新庆
秦福雯, 康濒月, 姜风岩, 徐恒康, 周华坤, 位晓婷, 刘晓丽, 邵新庆*
(1. 中国农业大学动物科技学院, 北京 100193; 2. 中国科学院西北高原生物研究所,青海省寒区恢复生态学重点实验室, 青海 西宁 810008)
生物土壤结皮(简称生物结皮)是由生活在地表的特殊植物(藻类、地衣、苔藓)和土壤微生物(细菌、真菌等)以及其他菌丝体、假根等与土壤颗粒物通过胶结作用形成的复合生命体[1-2]。生物结皮是干旱和半干旱地区典型的生命存在形式,在一些地区,生物结皮的覆盖度甚至能达到70%以上[3-4]。它们对于干旱、半干旱区的土表稳定、养分和水分循环具有十分重要的作用[1,5]。
生物结皮发育演替有特定的规律,一般根据生物结皮中的优势生物组分将生物结皮划分为藻结皮、地衣结皮、苔藓结皮3种主要类型[6-7]。生物结皮的发育过程一般遵循“藻结皮-地衣结皮-苔藓结皮”的演替规律,不同的生物类群会影响生物结皮的生态功能,有研究表明,不同发育阶段的生物结皮在固氮、固碳效率[8]、抗压强度[9]和土壤质地[5]上具有显著差异。另外,微生物是生物结皮形成的参与者,又受到生物结皮发育程度的影响[10]。有研究表明,生物结皮通过调节土壤温度和湿度,能够显著影响土壤细菌、真菌和放线菌等微生物的生物量和分布[11-12],微生物的活性也随着生物结皮的发育而持续增加[13]。根据吴丽等[14]在腾格里沙漠的研究,细菌、真菌和放线菌生物量随着生物结皮的发育演替呈现先增加后减少再增加的趋势,其生物量在不同演替阶段中的关系为:藓结皮>藻结皮>地衣结皮。根据李靖宇等[15]的研究,土壤表层在由流沙向藻结皮再向藓结皮发育过程中,蓝细菌和放线菌的生物量变化明显,蓝细菌的丰度先增高后减小,这也说明这两类微生物在生物结皮演替过程中具有重要作用。
目前关于生物结皮演替与土壤微生物群落关系的研究多集中在荒漠地区,在草原生态系统,特别是在青藏高原高寒草原生态系统中关于生物结皮演替与土壤微生物群落的研究还相对较少。本研究以青藏高原地区高寒草原为研究区域,通过对土壤磷脂脂肪酸(Phospholipid fatty acid,PLFA)的分析,以期明确在高寒草原地区生物结皮的发育演替对土壤微生物群落产生的影响。
1 材料与方法
1.1 研究区域概况
研究区域位于青海省海南藏族自治州贵南县森多镇扎什给村天然草原(100°13′~101°33′ E,35°09′~36°08′ N),高原大陆性气候,年平均气温为2.3℃,年降水量为403.8 mm,年平均蒸发量为1 378.5 mm。植被类型为针茅化高寒草原,主要优势种有溚草(Koeleriacristata)、异针茅(StipaalienaKeng)、高山嵩草(Kobresiapygmaea)、矮嵩草(Kobresiahumilis)和矮火绒(Leontopodiumnanum)等。土壤类型以高山草甸土为主,在草地中镶嵌着不同类型的生物结皮,根据其主要优势组分的不同,可将其分为藻结皮、地衣结皮和苔藓结皮。
1.2 调查与取样
2018年8月7—10日期间在试验地开展调查和取样。试验地围栏为100 m×140 m,在围栏样地中设置3个20 m×100 m的样带,每个样带间隔20 m。在每个样带内按之字形随机设置12个25 cm×25 cm的小样方。对样方内的生物结皮的盖度、发育程度进行记录,将所有样方分为4种类型,分别为Ⅰ类型(无生物结皮覆盖),Ⅱ类型(藻结皮覆盖),Ⅲ类型(地衣结皮覆盖),Ⅳ类型(苔藓结皮覆盖),每个类型3个重复。使用取土器采集结皮覆盖下的0~10 cm土壤,每个样带取12个土样,分别进行编号,最后将从3个样带中取得的相同编号的样品混合成一个样品,共得到12份样品,土样用冰盒带回实验室。

表1 不同生物结皮覆盖下土壤化学计量变化Table 1 Soil stoichiometric changes under different biological crusts
注:同列不同行小写字母表示有显著性差异(P<0.05)
Note:Different lowercases within column indicate significant difference at the 0.05 level
1.3 室内分析
取部分鲜土,采用烘干法测定土壤含水量,另外的土样分成两份,一部分自然风干后去除草根等杂物过筛(孔径0.149 mm),采用常规分析法测定土壤的化学成分,全氮用凯氏定氮法测定,全磷用高氯酸-硫酸消解钼锑抗比色法测定,pH用Mettler Toledo酸度计测定,有机碳用Elementar快速碳硫分析仪测定[16];另一部分土壤暂放在—80℃冰箱中保存,并迅速用于土壤磷脂脂肪酸的测定。土壤磷脂脂肪酸的测定根据Bossio等[17]的方法测定,将土壤提取液(氯仿:甲醇:磷酸缓冲液=1∶2∶0.8)加入到土壤样品中,利用硅胶柱(BE-Si,1gm/6mL)进行分离纯化,纯化后的脂肪酸用KOH-甲醇溶液甲酯化,再加入十九烷酸甲酯(C19∶0)作为内标,用美国Agilent 689N型GC-MS分析结合Sherlock MIS 4.5系统(Sherlock Microbial Identification System)完成检测分析。特征脂肪酸的分类见表2。

图1 不同生物结皮覆盖下的地表(A为无结皮覆盖,B为藻结皮覆盖,C为地衣结皮覆盖,D为苔藓结皮覆盖)Fig.1 The surface covered by different biocrusts (A is the non-crust cover,B is the algal crust cover,C is the lichen crust cover,and D is the moss crust cover)
表2 不同微生物种群磷脂脂肪酸微生物标记Table 2 PLFA of different microbial communities

微生物Microorganism磷脂脂肪酸生物标记PLFA Biomarker常见细菌Common bacteria14∶0,15∶0,16∶0,17∶0真菌 Fungus18∶1 ω9с,18∶2 ω6с放线菌 Actinomycetes16∶0 10-methyl,17∶0 10-methyl,18∶0 10-methyl厌氧菌Anaerobic bacteria18∶1 ω7с革兰氏阳性菌G+Gram-positive bacteria13∶0 iso,15∶0 iso,15∶0 anteiso,16∶0 iso,17∶0 iso,17∶0 anteiso,18∶0 iso革兰氏阴性菌G-Gram-negative bacteria16∶1 ω9с,16∶1 ω7с,18∶1 ω5с,19∶0 cyclo ω7сAM真菌Arbuscular mycorrhizal fungi16∶1 ω5с
1.4 数据分析
使用Excel 2016和SigmaPlot 12.5进行数据整理及图表制作,采用IBM SPSS Statistics 25软件进行统计分析,利用单因素方差分析(One-way ANOVA)和Duncan法对不同类型土样的微生物结构进行分析。利用R 3.5.1 中的factoextra包对土壤磷脂脂肪酸进行聚类分析(K-means)和利用vegan、ggplot 2包进行冗余分析(Redundancy analysis,RDA)。所有数据结果使用算术平均值±标准误(M±SE)表示。
2 结果与分析
2.1 不同生物结皮覆盖下土壤PLFA生物标记数量和结构的总体变化
2.1.1PLFA生物标记种类数和标记量的变化 在不同类型土样中的PLFA种类和特征峰值如表3所示。在所有土样中共出现了22种PLFA,在Ⅰ,Ⅲ和Ⅳ类型中所有22种PLFA均有出现,在Ⅱ类型土壤中出现了21种PLFA,其中17:0 10-methyl没有在Ⅱ类型土壤中出现。
各特征PLFA含量的大小,因生物结皮的覆盖和类型有所不同(表3),如属于常见细菌的17∶0,其生物含量在Ⅳ阶段达到最高,各类型含量的大小顺序依次为:Ⅳ>Ⅱ>Ⅲ>Ⅰ;属于真菌的18∶2ω6c,其生物量在Ⅰ类型土壤中达到最高值,各类型含量的大小顺序依次为:Ⅰ>Ⅱ>Ⅳ>Ⅲ;属于放线菌的16∶0 10-methyl,其生物量在Ⅳ阶段达到最高值,各类型含量的大小顺序依次为Ⅳ>Ⅲ>Ⅱ>Ⅰ。
2.1.2PLFA生物标记分布结构变化 在所有的22种磷脂脂肪酸中,表征常见细菌的16∶0比例最高,在磷脂脂肪酸总量中占比达到15%;表征真菌的18∶1ω9с在磷脂脂肪酸总量中占比为14%;表征厌氧菌的18∶1ω7с在磷脂脂肪酸总量中占比为10%;表征革兰氏阴性菌的ω在磷脂脂肪酸总量中占比为8%。表征放线菌的16∶0 10-methyl在磷脂脂肪酸总量中占比为7%;表征革兰氏阳性菌的15∶0 iso在磷脂脂肪酸总量中占比为5%;表征AM真菌的16∶1 ω5с在磷脂脂肪酸总量中占比为5%(图2)。
在4种不同类型的土壤中,磷脂脂肪酸的种类和比例发生了变化(图2),在Ⅰ、Ⅲ和Ⅳ类型中有22种PLFA出现,在Ⅱ类型土壤中只出现了21种PLFA。另外,在4种不同土壤中比重变化较大的有18∶2ω6c,17∶0 10-methyl,13∶0 iso和16∶0 iso。

表3 土壤微生物PLFA反应值动态变化Table 3 Dynamic changes of soil microbial PLFA reaction values
2.2 土壤微生物结构分析
在对不同类型的土壤进行分析后发现,在不同土壤中微生物的组成和结构都有一定的差异(图3)。在Ⅰ类型土壤微生物中,革兰氏阳性菌生物量最高,常见细菌、真菌和革兰氏阳性菌(G+)生物量要显著高于放线菌、厌氧菌和AM真菌;在Ⅱ类型土壤中,革兰氏阳性菌(G+)生物量最高,常见细菌和革兰氏阳性菌生物量显著高于AM真菌;在Ⅲ类型中,革兰氏阳性菌生物量最高,常见细菌、真菌、革兰氏阳性菌生物量显著高于放线菌、厌氧菌和AM真菌;在Ⅳ类型土壤中,常见细菌生物量最高,常见细菌、真菌、革兰氏阳性菌生物量显著高于放线菌、厌氧菌和AM真菌。在四种不同类型的土壤中,常见细菌的生物量变化为Ⅱ(77757)>Ⅰ(75062)>Ⅳ(66949)>Ⅲ(63220)。真菌的生物量变化为Ⅰ(68703)>Ⅱ(63802)>Ⅳ(62830)>Ⅲ(62346)。放线菌的生物量变化为Ⅳ(39258)>Ⅲ(36654)>Ⅱ(34020)>Ⅰ(29780)。厌氧菌的生物量变化为Ⅰ(39118)>Ⅱ(38107)>Ⅲ(32032)>Ⅳ(31490)。革兰氏阳性菌(G+)的生物量变化为Ⅰ(84504)>Ⅱ(80415)>Ⅲ(67276)>Ⅳ(64809)。革兰氏阴性菌的生物量变化为Ⅱ(56330)>Ⅰ(56086)>Ⅲ(52295)>Ⅳ(46418)。AM真菌的生物量变化为Ⅱ(20391)>Ⅰ(19440)>Ⅳ(19142)>Ⅲ(16873)。


图2 土壤磷脂脂肪酸的结构变化Fig.2 Structure changes of soil phospholipid fatty acids

图3 土壤微生物群落变化Fig.3 Changes of soil microbial community注:不同小写字母表示有显著性差异(P<0.05)Note:Different lowercase letters indicate significant difference at the 0.05 level
2.3 土壤微生物PLFA生物标记聚类分析
以表4中的PLFA的出现频次、PLFA值总和、PLFA平均值和标准误作为指标,以各PLFA为样本,构建分析矩阵,以欧氏距离为尺度,用K-means法进行聚类分析,聚类的结果见图4。根据聚类的结果,可以将所有PLFA分为三大类。
第一类(16∶0,18∶1 w9c,16∶0 10-methyl,18∶1 w7c,16∶1 w7c)特点为:出现频次最高,PLFA值总和最高,PLFA的平均值和标准误最高。
第二类(14∶0,15∶0,18∶2 w6c,18∶0 10-methyl,13∶0 iso,15∶0 iso,15∶0 anteiso,16∶0 iso,17∶0 iso,17∶0 anteiso,18∶0 iso,16∶1 w9c,18∶1 w5c,19∶0 cyclo w7c,16∶1 w5c)特点为:出现频次较高,PLFA值总和较高,PLFA的平均值和标准误较高。
第三类(17∶0,17∶0 10-methyl)特点为:出现频次最低,PLFA值总和最低,PLFA的平均值和标准误也是最低。

表4 土壤磷脂脂肪酸聚类分析指标Table 4 Index of soil phospholipid fatty acid cluster analysis
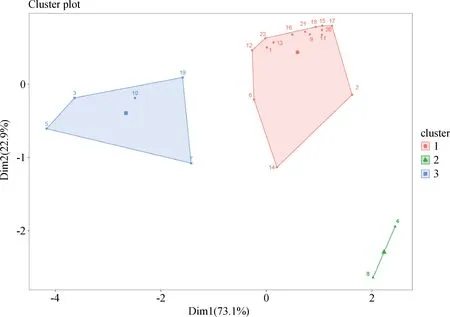
图4 土壤磷脂脂肪酸聚类分析Fig.4 Soil phospholipid fatty acid clustering analysis注:不同序号代表的磷脂脂肪酸种类见表4Note:The types of PLFA represent by different serial Numbers shown in table 4
2.4 土壤微生物和化学计量的相关性分析
将土壤因子和微生物生物量之间进行冗余分析,结果显示土壤因子与微生物生物量极显著相关(P<0.01)。由图5可见,土壤含水率、pH与土壤真菌、厌氧菌生物量呈显著正相关,与常见细菌、革兰氏阳性菌、革兰氏阴性菌、AM真菌生物量呈显著负相关,与放线菌生物量无关。土壤全氮与厌氧菌、真菌生物量呈显正相关,与放线菌、革兰氏阳性菌生物量呈显著负相关,与常见细菌、革兰氏阴性菌、AM真菌无关。土壤全磷与放线菌、革兰氏阳性菌呈显著正相关,与常见细菌、真菌、革兰氏阴性菌、AM真菌生物量呈显著负相关,与厌氧菌无关。土壤有机碳与厌氧菌、真菌、放线菌生物量呈显著正相关,与常见细菌、革兰氏阳性菌、革兰氏阴性菌、AM真菌生物量呈显著负相关。整体上看,真菌、厌氧菌和放线菌与土壤化学计量呈正相关,常见细菌、革兰氏阳性菌、革兰氏阴性菌、常见细菌、AM真菌与土壤化学计量呈负相关。放线菌较多分布在Ⅳ(苔藓结皮覆盖下土壤)类型土壤中,真菌主要分布在Ⅰ(无结皮覆盖土壤)和Ⅲ(地衣结皮覆盖土壤)中,常见细菌、革兰氏阴性菌和AM真菌分布较为均匀,在Ⅱ(藻结皮覆盖土壤)、Ⅲ(地衣结皮覆盖土壤)、Ⅳ(苔藓结皮覆盖土壤)中都有分布。

图5 土壤微生物群落结构与土壤因子冗余分析Fig.5 Analysis of soil microbial community structure and soil factor redundancy
3 讨论
3.1 生物结皮与土壤理化性质
生物结皮中包含多种固氮菌和蓝藻,能将大气中的N2还原、固定为可被生物利用的铵态氮[18]。Elbert等[4]研究得出,全世界生物结皮的每年固氮量可达到4500万吨,约占全球生物固氮总量的40%。同时,作为具有生命活性的有机复合层,生物结皮可以从多个方面改变土壤的理化性质。张元明等[19]发现在古尔班通古特沙漠生物结皮可显著增加表层土壤的有机质含量;赵允格等[20]发现在黄土丘陵区生物结皮的形成显著增加了结皮层土壤有机质和氮含量。王蕊等[21]的研究也表明随着生物结皮的发育土壤有机质和全磷含量会显著提升。另外,张继贤等[22]发现在荒漠沙丘固定和生物结皮形成过程中,土壤pH值呈升高趋势。而崔燕等[23]的研究表明,在生物结皮的形成过程中,土壤pH是呈下降趋势的。本研究发现,随着生物结皮的产生和发育,土壤pH、全磷和有机碳含量并没有发生显著变化,而全氮含量随着生物结皮的产生和发育呈现下降趋势,这与其他学者在沙漠地区的研究结果存在差异,这些差异可能与研究区域环境有关,本研究区域所处草原地区相对于荒漠地区养分含量较高,生物结皮的养分富集作用可能并没有产生明显作用,也可能是由于生物结皮的养分积累过程十分复杂,与外界环境的反馈、结皮层中微生物的矿化、大气降尘对土壤环境的养分输入和地表的侵蚀、堆积等过程有关。
3.2 生物结皮与土壤微生物群落
土壤微生物群落结构作为土壤生态系统中比较敏感的指标,对周围环境的变化会有迅速的反应[24]。土壤微生物群落结构受到土地使用历史、植被覆盖类型和其他多种环境因素的影响[25-26]。在生物结皮的生长过程中,其覆盖下的土壤微生物群落结构也会受到其周围植被、土地利用方式以及气候条件变化的影响[27]。本试验测定结果表明,在所有供测样品中共发现22种磷脂脂肪酸,这些脂肪酸在不同类型结皮覆盖下的土壤中的出现频次、相对生物量和离散程度都存在着差异,这与张秋芳等[28]对于土壤PLFA测定结果的描述一致。
本研究发现,在高寒草原地区生物结皮的发育与土壤微生物群落间无显著的相关性,该结果与其他研究者在沙漠地区的研究结果存在一些差异。另外,根据RDA分析的结果,各土壤因子对微生物类群的影响不同,其中厌氧菌和真菌受土壤因子的影响较大,几乎受到所有土壤因子的影响,这说明影响它们生物量的因素较复杂。真菌的生物量主要受全氮的影响,放线菌的生物量主要受全磷的影响,这与陈法霖等研究[29]的结果相同,也说明土壤微生物群落的变化是多个土壤因子共同作用的结果[30]。
4 结论
青藏高原地区典型高寒草原不同生物结皮覆盖下的微生物群落结构存在差异。在所有供试土壤中共发现22种PLFA,表征7种微生物类群,其中常见细菌和真菌是主导微生物。各类群微生物生物量与生物结皮的发育演替无显著的相关性(P>0.05)。土壤因子与微生物生物量极显著相关(P<0.01),土壤真菌生物量与全氮含量显著正相关(P<0.05),放线菌生物量与全磷含量显著正相关(P<0.05)。可见,在高寒草原生态系统中,生物结皮、土壤养分和微生物群落之间存在着较为复杂的相关性,仍需要进一步地探索。
