太湖和洪泽湖天然有机质与重金属结合特性研究
2019-09-25王沛芳包天力张楠楠
施 玥,王沛芳,胡 斌,王 超,包天力,张楠楠
(1.河海大学浅水湖泊综合治理与资源开发教育部重点实验室,江苏 南京 210098;2.河海大学环境学院,江苏 南京 210098; 3.江苏环保产业技术研究院股份公司,江苏 南京 210036)
天然有机质(natural organic matter, NOM)是指天然水体和其他生态系统中除了生物和人造化合物以外所有的有机物,通常将总有机碳(TOC)和溶解性有机碳(DOC)作为定量分析NOM的主要参数[1]。NOM主要来源于动植物和微生物的代谢产物和残体分解,可分为非腐殖质和腐殖质两大类[2-3]。重金属不能被生物降解,长期存在于环境中并在食物链中不断富集,会对人体健康造成威胁[4-7]。Cu和Cd是湖泊水体中常见的重金属[8-10],过量摄入Cu会影响正常生长发育导致中毒;Cd对人体有致癌、致畸以及诱发突变等危害。NOM结构中含有官能团使其与水环境中的重金属离子有很强的结合能力,可以改变重金属的毒性和生物有效性。不同来源的NOM在组成和结构上存在很大差别[11-12],往往能够影响NOM与重金属离子的结合能力。Richards等[13]的研究发现,由于不同来源的NOM与重金属结合能力的差异,导致其对鱼类存活率的影响程度不同;王峰等[14]的研究表明,不同来源的NOM与重金属作用的活性组分和结合能力均不相同。还有研究发现不同重金属与NOM不同荧光组分的结合行为也存在显著差异[15]。然而,目前针对NOM各组分内部各结合点位与重金属相互作用的研究还比较少,二者之间结合特性的研究对重金属离子的转化迁移和环境风险有重要意义[16-18]。

表1 太湖和洪泽湖采样点位置及表层水体理化性质
应用荧光技术分析NOM具有快速、灵敏度高、选择性高、不需要预处理和所需样品少等优点,能快速掌握重金属与有机质的结合能力和结合点位等信息。其中同步荧光光谱结合二维相关光谱(2D-COS)可以应用于分析浓度和pH值的变化及外加猝灭剂等外部扰动所引起的荧光强度的变化[19]。以往研究表明,同步荧光光谱的二维相关光谱分析可以清楚地解析重金属与有机质的结合点位以及重金属在结合点位上的非均匀分布[20-22]。因此,可以将同步荧光光谱结合二维相关光谱分析应用于NOM与重金属结合的研究中。
太湖和洪泽湖分别是中国第三和第四大淡水湖。太湖水体富营养化严重,藻类频繁暴发,大部分湖区NOM来源以内源为主,主要是藻类死亡后残体降解成的蛋白质类物质[23],另外冬季太湖NOM受入湖河流等其他外源输入影响较大[24]。洪泽湖是淮河流域最大的湖泊,对苏北农业灌溉、渔业、城乡供水以及对淮河流域防洪和南水北调东线工程调蓄都起着重要作用, NOM来源以陆源腐殖质为主[25]。本文采用同步荧光光谱结合二维相关光谱分析方法研究太湖和洪泽湖天然有机质组成以及天然有机质与重金属离子Cu2+和Cd2+的结合特性,以期为研究湖泊水体中重金属的毒性和生物有效性提供参考。
1 材料和方法
1.1 研究区域和样品采集
于2016年11月分别在太湖贡湖湾、梅梁湾和洪泽湖湖心、南部湖湾区进行了野外样品采集,采样点位置及表层水体理化性质如表1所示。使用Rutter分层水样采集器采集水面以下25 cm水样,现场使用美国HACH多参数水质测定仪测定水样的pH值、溶解氧(DO)和浊度等理化指标。采集的水样放置于有冰袋的保温箱中避光保存并在12 h内运回实验室。用0.22 μm聚醚砜树脂(PES)滤膜过滤水样(舍弃初始10 mL),滤液中可以通过滤膜的有机质即为溶解性有机质(dissolved organie matter,DOM)。将滤后水样装于棕色聚乙烯瓶中在4 ℃环境下恒温避光保存以待样品测定(只考虑NOM中已经溶解的部分)。
1.2 试验方法
1.2.1 荧光猝灭滴定试验
分别配制浓度为0.025 mol/L的Cu2+和Cd2+储备液。将4个采样点的滤后水样分别加入10 mL离心管中,再分别加入不同体积(<0.5 mL)的Cu2+和Cd2+储备液,使得水样中Cu2+和Cd2+的浓度分别为0、5、10、15、20、30、40、50、75、100、150、200、250 μmol/L。将离心管置于间歇式恒温振荡仪振荡,设置温度为25 ℃,保持避光状态振荡24 h,使其充分反应。
1.2.2 同步荧光光谱测定及分析
a. 同步荧光光谱测定。 采用荧光分光光度计(HitachiF-7000)测定水样,测样选用同步模式,发射波长为260 nm,激发波长范围为200~540 nm,发射波长与激发波长为恒定间隔60 nm,扫描速度为1 200 nm/min。使用Milli-Q纯水作为空白对照,每个样品测得的数据均减去纯水的同步荧光光谱值[26]。
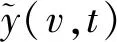
(1)
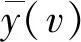
(2)
光波变量在v1~v2范围的同步相关光谱φ(v1,v2)由下式得出:
(3)
(4)
2 结果与讨论
2.1 太湖和洪泽湖NOM性质
太湖和洪泽湖表层水体NOM的同步荧光光谱如图1所示。以往研究表明,波长在200~250 nm和250~300 nm范围内的特征峰分别归因于类蛋白质酪氨酸和色氨酸,波长大于300 nm的特征峰归因于类腐殖质[27]。由图1可知,洪泽湖(湖湾及湖心)表层水样在波长350 nm处存在一个明显的特征峰,波长275 nm处有一个微弱的特征峰,表明洪泽湖表层水体NOM主要以类腐殖质为主,与Hu等[25]研究结果相符。太湖(贡湖湾和梅梁湾)表层水样在275 nm和340 nm均有一个明显的特征峰,说明太湖水体NOM主要以类蛋白质和类腐殖质为主,这可能是由于藻类生长代谢过程中分泌的类蛋白质造成的[28]。
2.2 NOM与重金属结合
2.2.1 NOM与重金属结合同步荧光光谱的变化
太湖和洪泽湖表层水体NOM性质存在显著差异,因此进一步开展了太湖和洪泽湖NOM与重金属结合特性的研究。图2和图3中不同颜色的线条分别代表添加不同浓度(0~250 μmol/L)的Cu2+和Cd2+后,太湖和洪泽湖NOM荧光强度变化情况。由图2可以看出,加入Cu2+后,NOM的荧光强度均有不同程度的减弱,这表明Cu2+与4种来源NOM都发生了结合作用且NOM中类腐殖质或者类蛋白质均能较好地与Cu2+离子结合[29]。由图3可见,Cd2+对NOM的荧光猝灭作用程度明显小于Cu2+。太湖和洪泽湖湖湾NOM的荧光强度随Cd2+浓度的增大呈现微弱的下降趋势,而洪泽湖湖心NOM只有类蛋白质部分的荧光强度随Cd2+浓度增大呈下降趋势,类腐殖质部分荧光强度的变化趋势则相反。这是由于分子量、电荷和分子结构等性质的差别使得不同来源的NOM对同种金属有不同的结合行为。
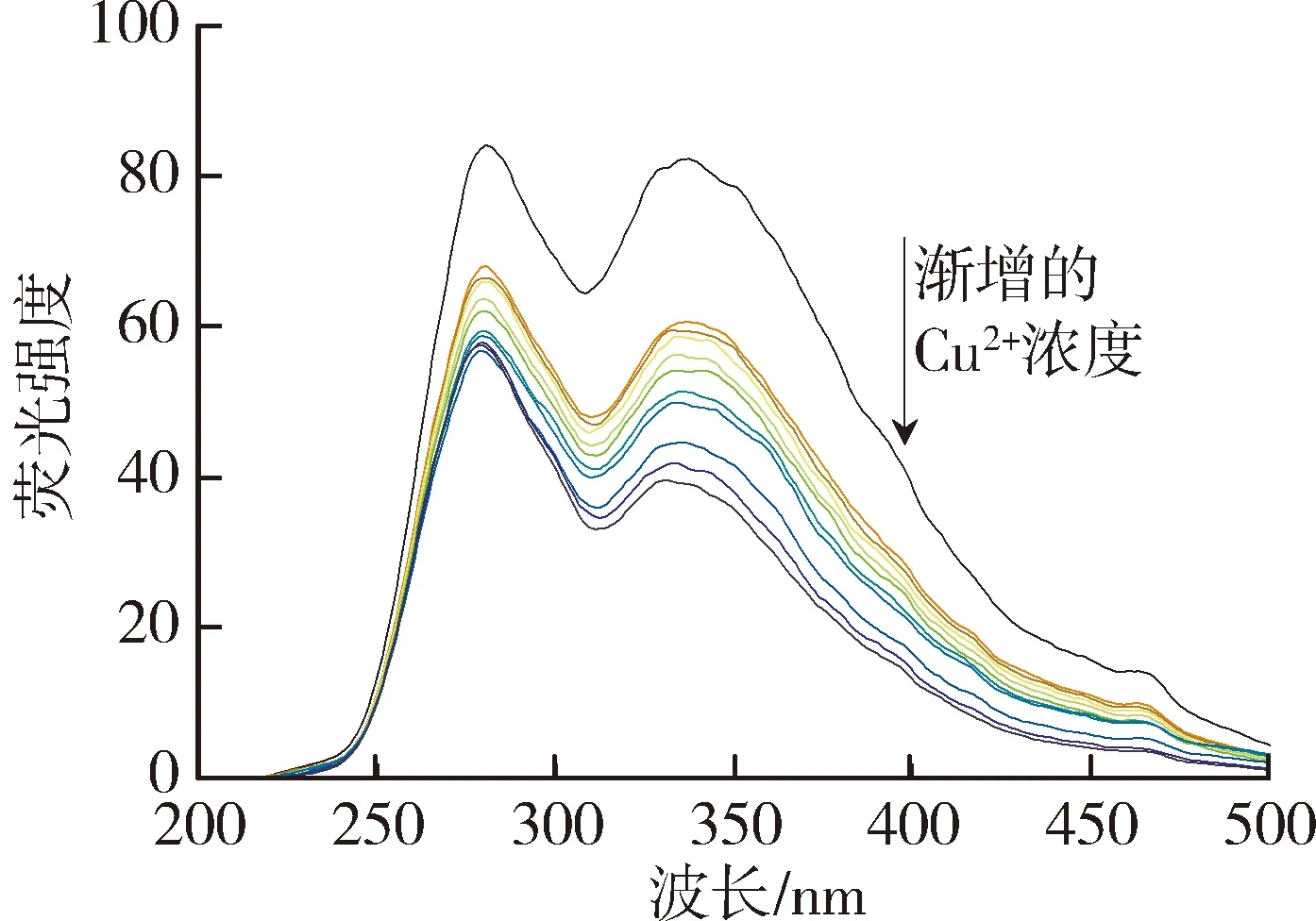
(a)太湖贡湖湾
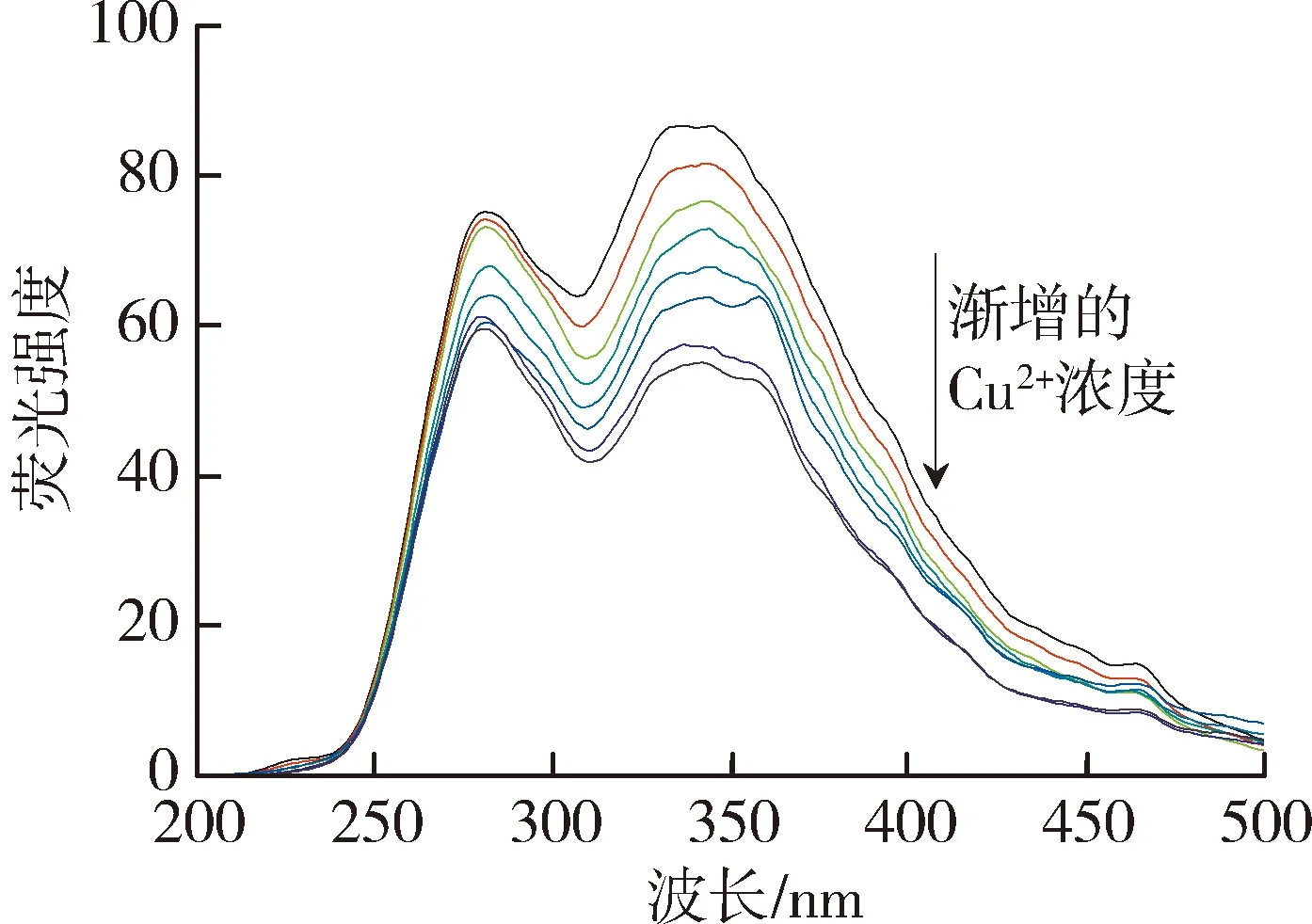
(b)太湖梅梁湾
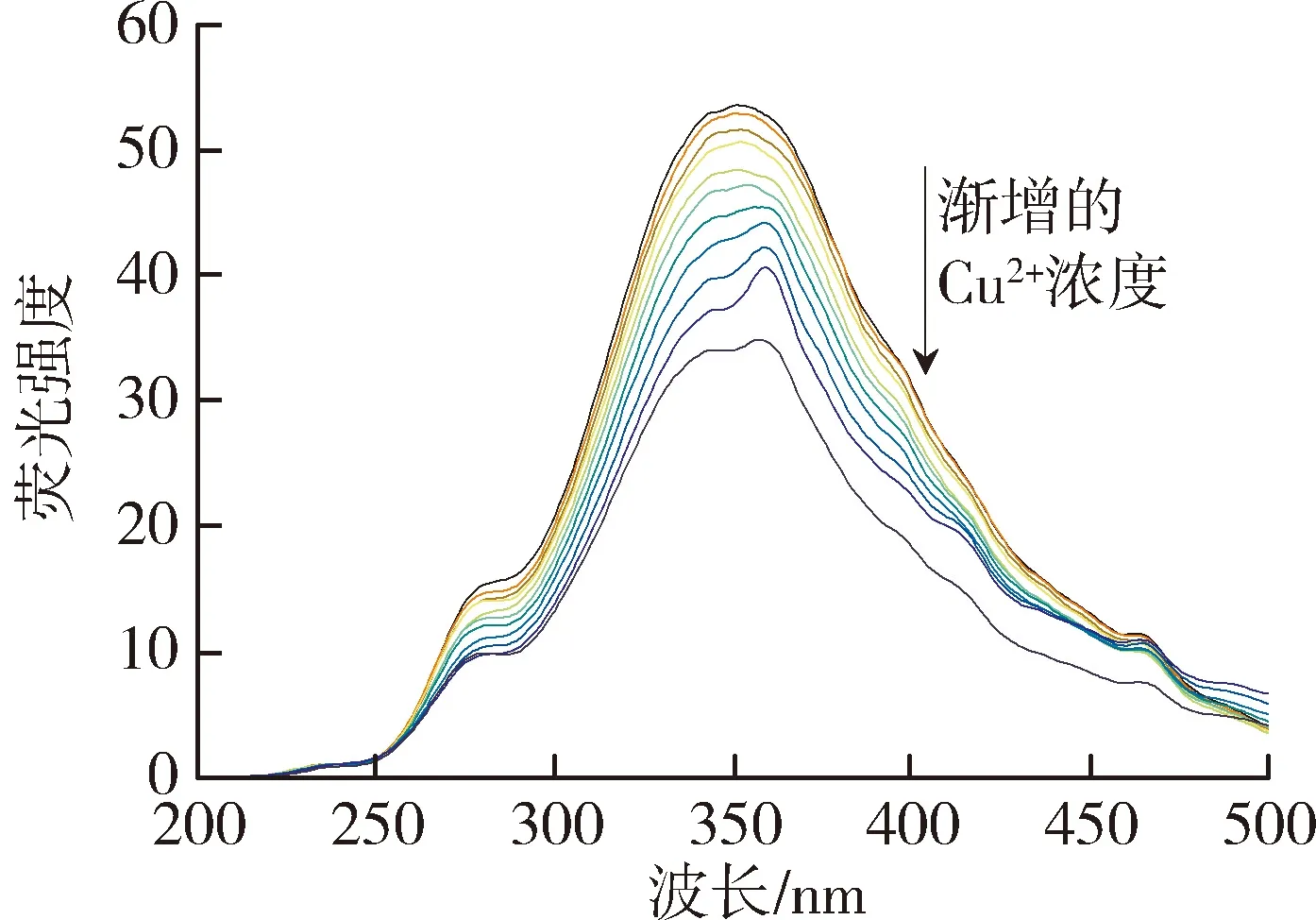
(c)洪泽湖湖心
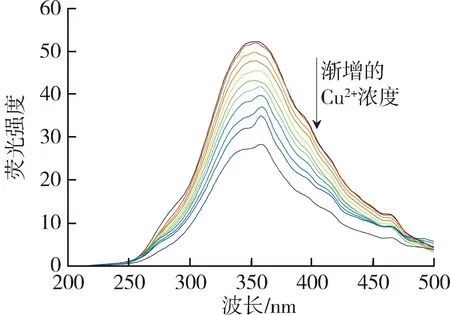
(d)洪泽湖湖湾
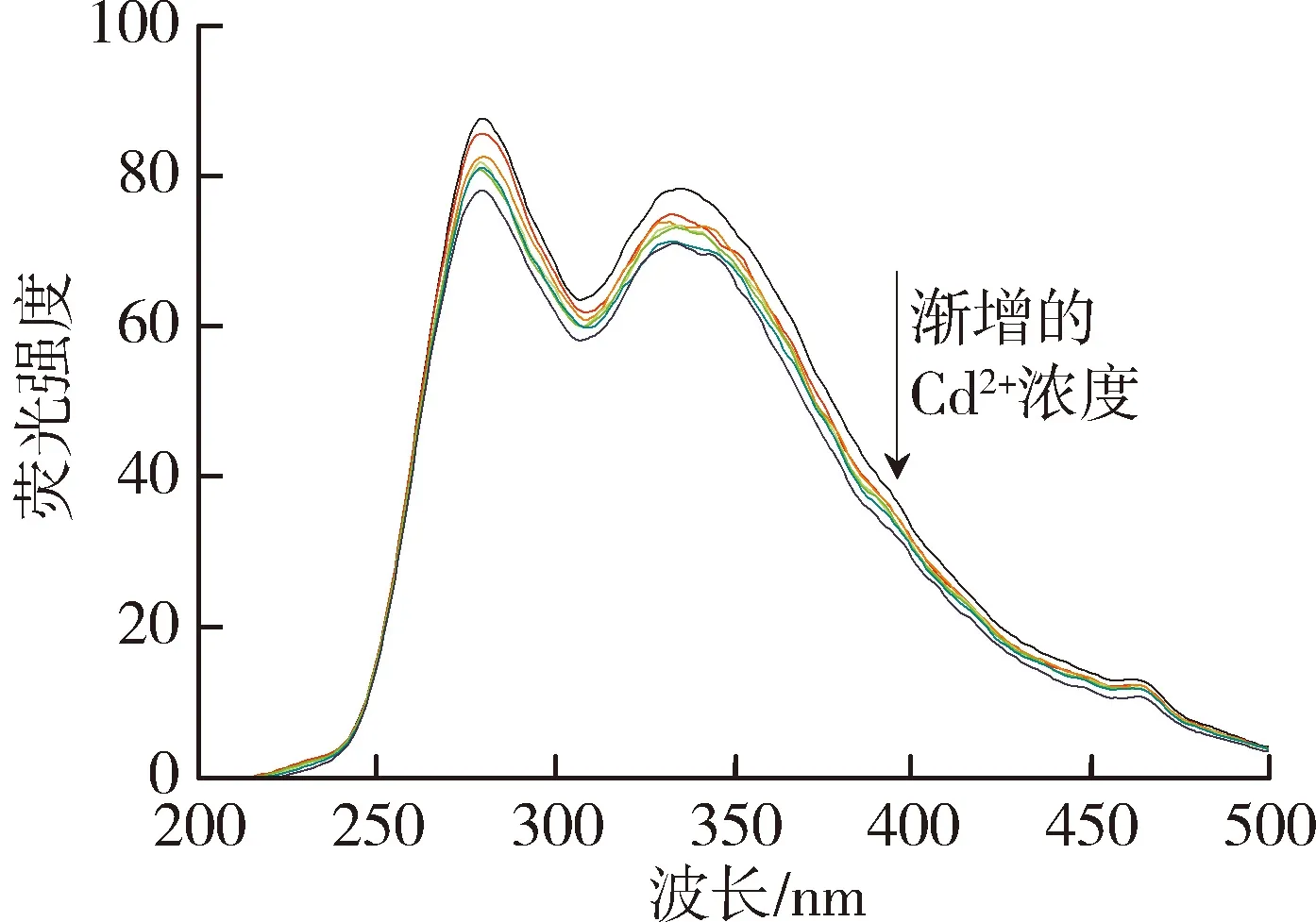
(a)太湖贡湖湾
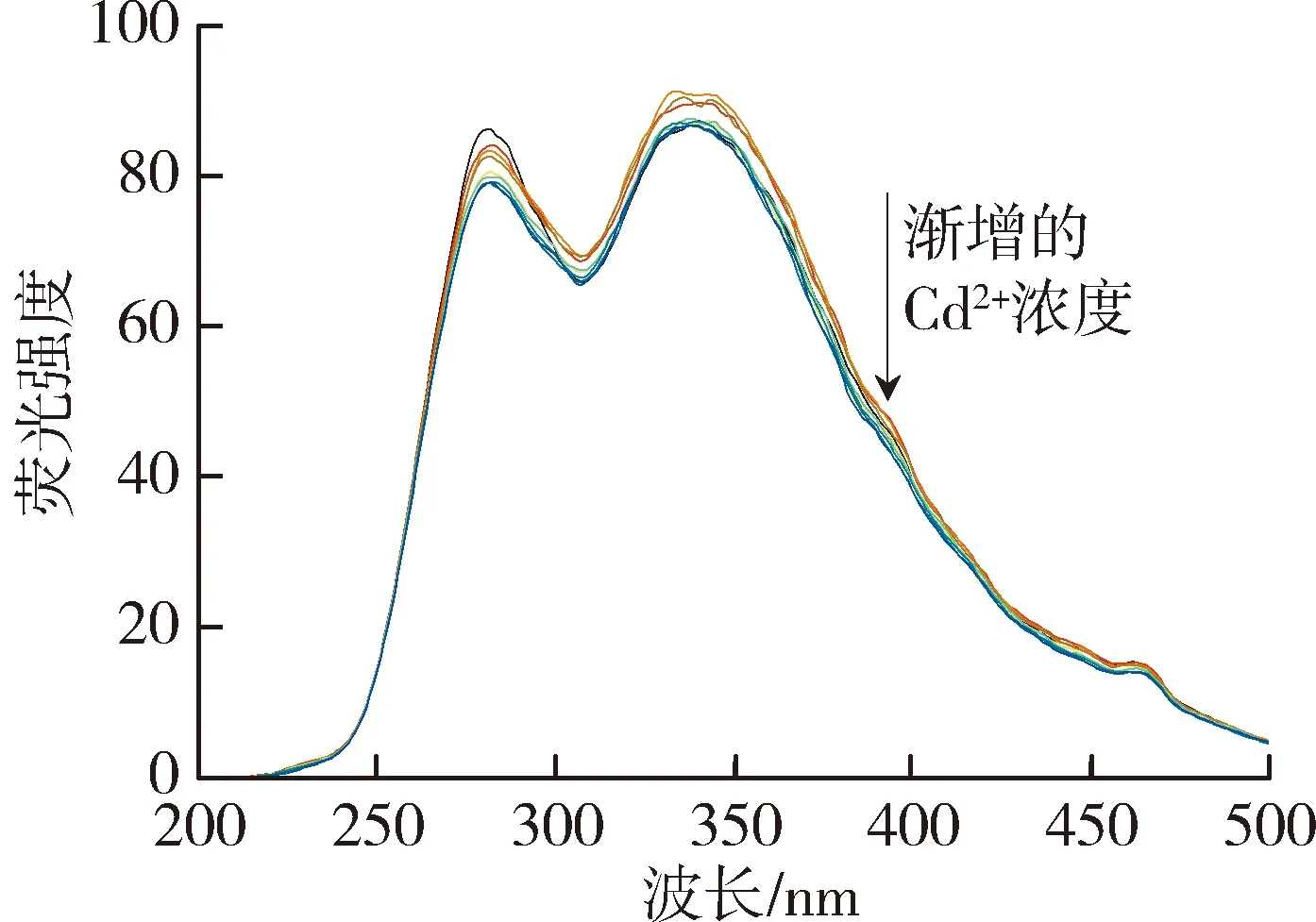
(b)太湖梅梁湾
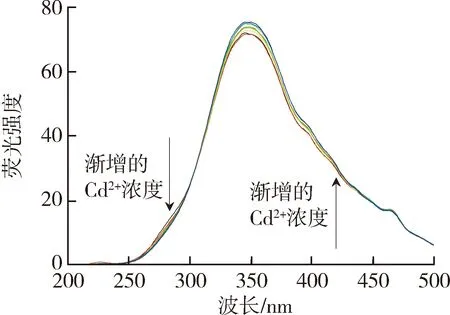
(c)洪泽湖湖心
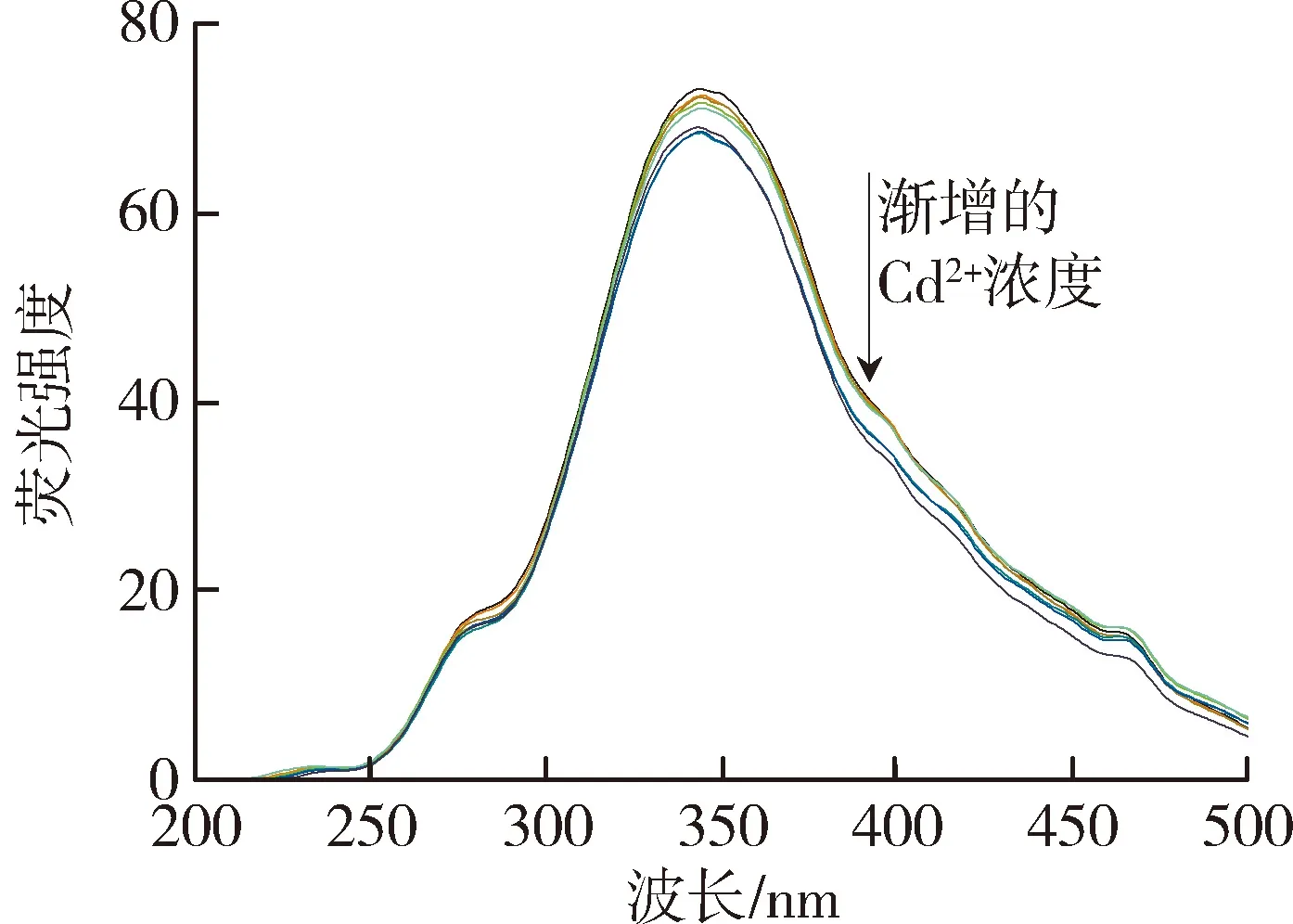
(d)洪泽湖湖湾
2.2.2 NOM与重金属结合的二维相关光谱图
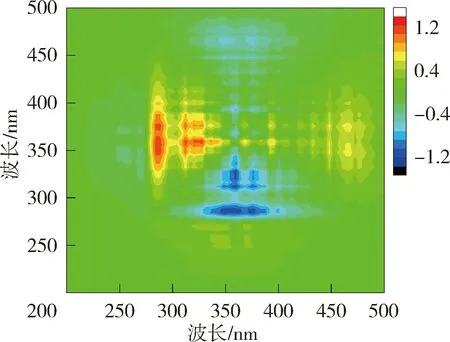
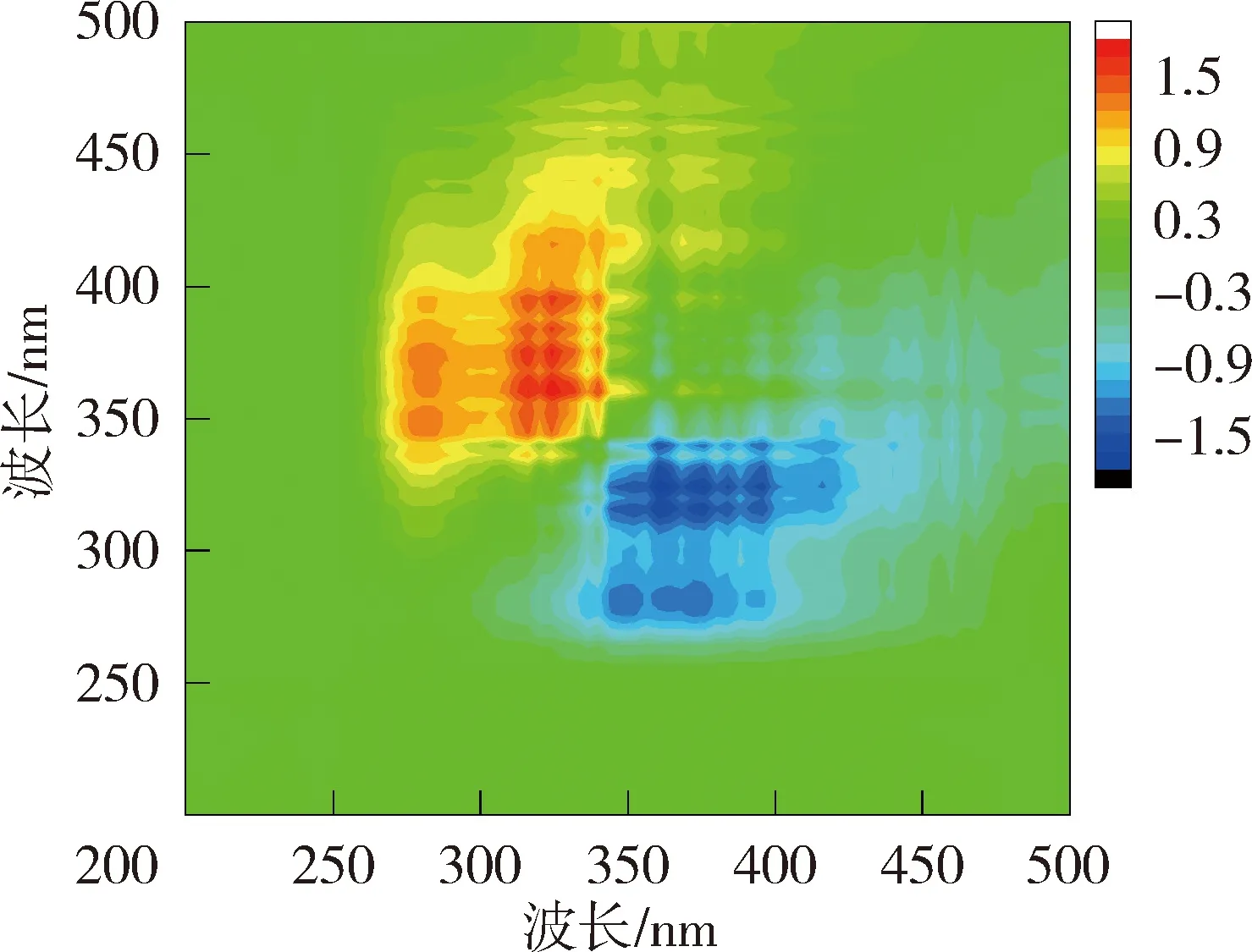
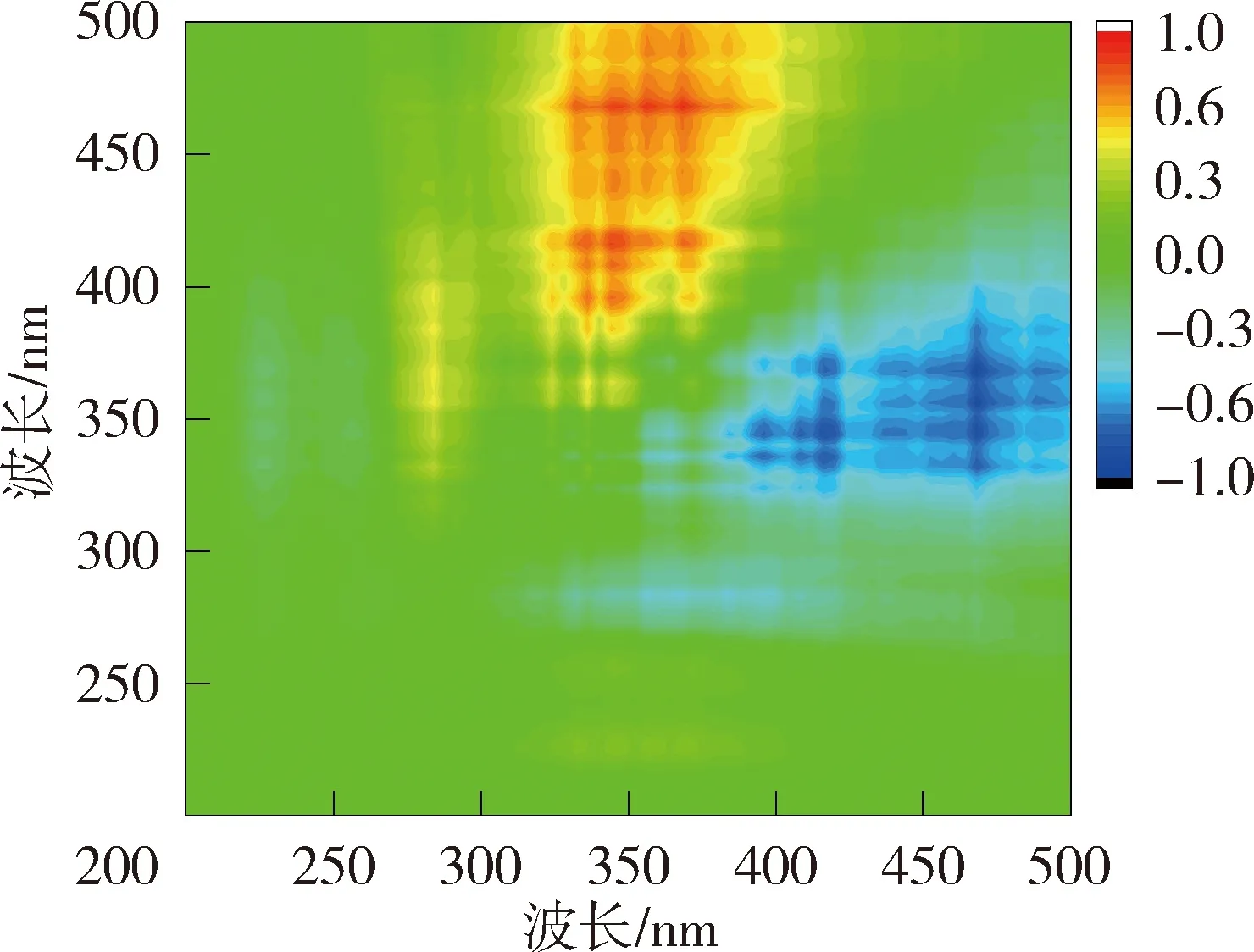
为进一步掌握NOM与重金属的结合特性,利用二维相关光谱解析同步荧光光谱图以确定金属离子与NOM的结合点位以及结合顺序。图4和图5为太湖和洪泽湖NOM与Cu2+结合的二维相关光谱。同步二维相关光谱中自峰的强度表示NOM对重金属浓度变化的敏感程度,太湖贡湖湾和梅梁湾NOM均在对角线上335~370 nm波长范围内存在1个自峰,洪泽湖湖心和湖湾NOM都分别在对角线上350 nm和369 nm位置处有2个自峰。相应波长处的相关峰为正值,说明NOM的荧光强度随着Cu2+浓度增加变化趋势一致。对比太湖及洪泽湖NOM的两个同步光谱,发现太湖NOM自峰的强度高于洪泽湖,说明太湖NOM更易与Cu2+结合。
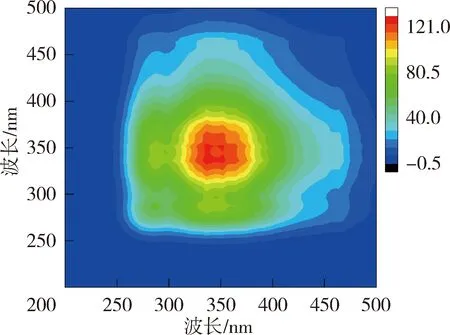
(a)太湖贡湖湾
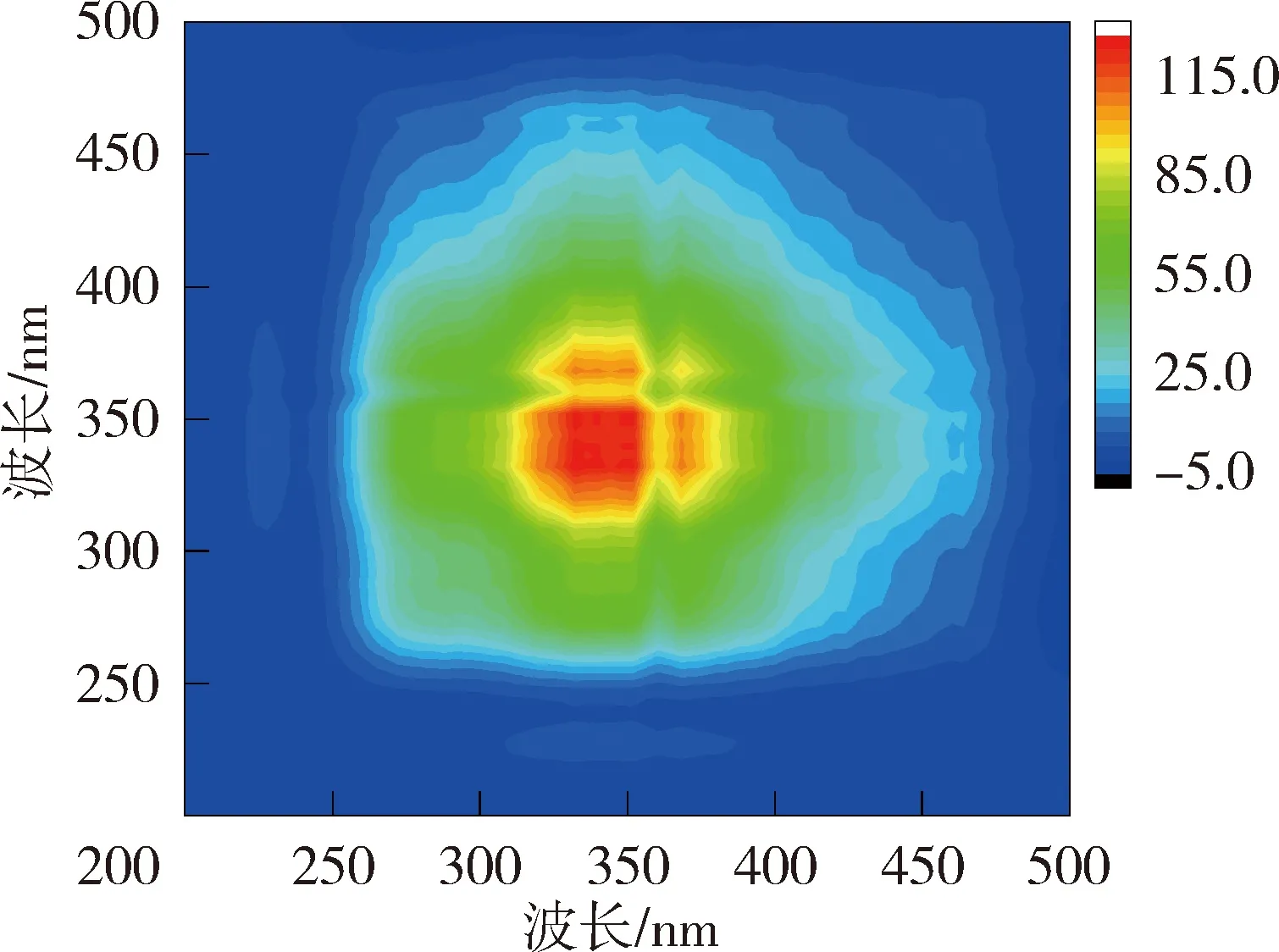
(b)太湖梅梁湾
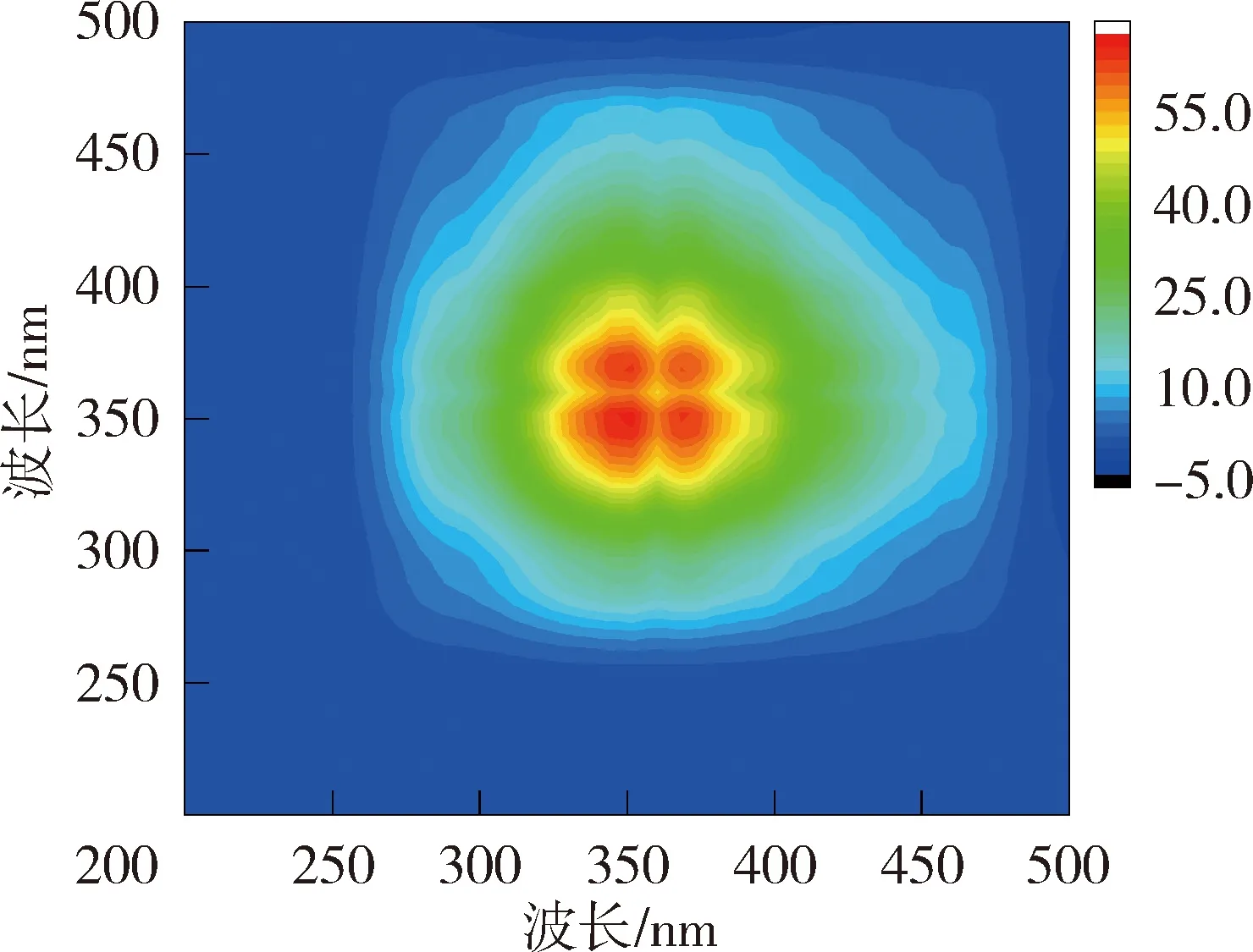
(c)洪泽湖湖心
(d)洪泽湖湖湾
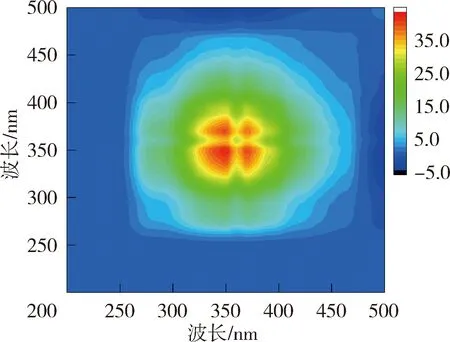
(a)太湖贡湖湾
(b)太湖梅梁湾
(c)洪泽湖湖心
(d)洪泽湖湖湾
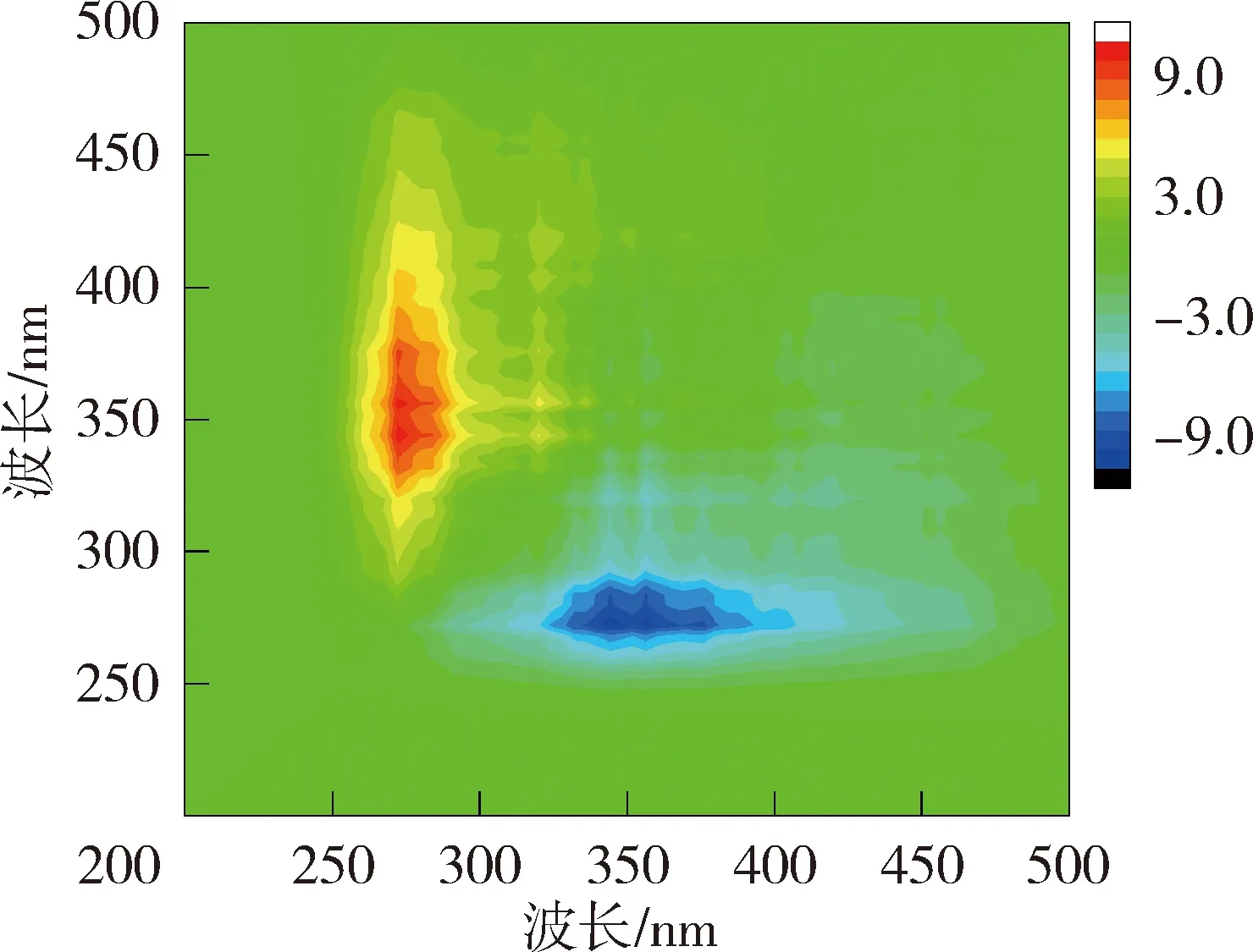
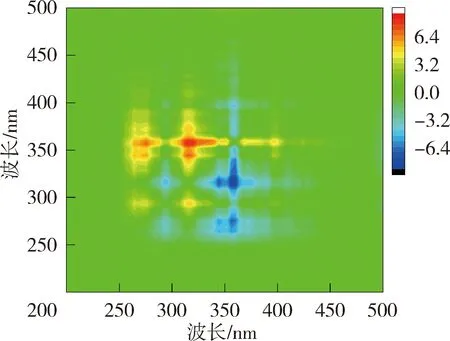
异步二维相关光谱能够反映出添加重金属离子后不同波长处荧光强度的变化情况,揭示重金属离子的结合点位与结合顺序[21]。太湖贡湖湾NOM与Cu2+结合的异步二维相关光谱在对角线右下方(345nm,275 nm)、(355nm,275 nm)和(375nm,275 nm)位置存在3个负的交叉峰,根据Noda规则贡湖湾NOM与Cu2+的结合顺序为275 nm→375 nm→345 nm;梅梁湾异步二维相关光谱在对角线右下方分别存在2组正峰和2组负峰,因此梅梁湾NOM与Cu2+的结合顺序为275 nm→344 nm→358 nm。洪泽湖湖心NOM与Cu2+结合的异步二维相关光谱在对角线下方存在3组负峰和一些微弱的正峰,因此洪泽湖湖心NOM与Cu2+的结合顺序为285 nm→394 nm→377 nm→359 nm;洪泽湖湖湾的异步二维相关光谱在对角线右下方存在1组负峰,因此洪泽湖湖湾NOM与Cu2+的结合顺序为281 nm→317 nm→324 nm→340 nm→360 nm、375 nm、396nm。异步二维相关光谱的结果表明浅水湖泊NOM中类蛋白质对Cu2+的亲和力强于类腐殖质。
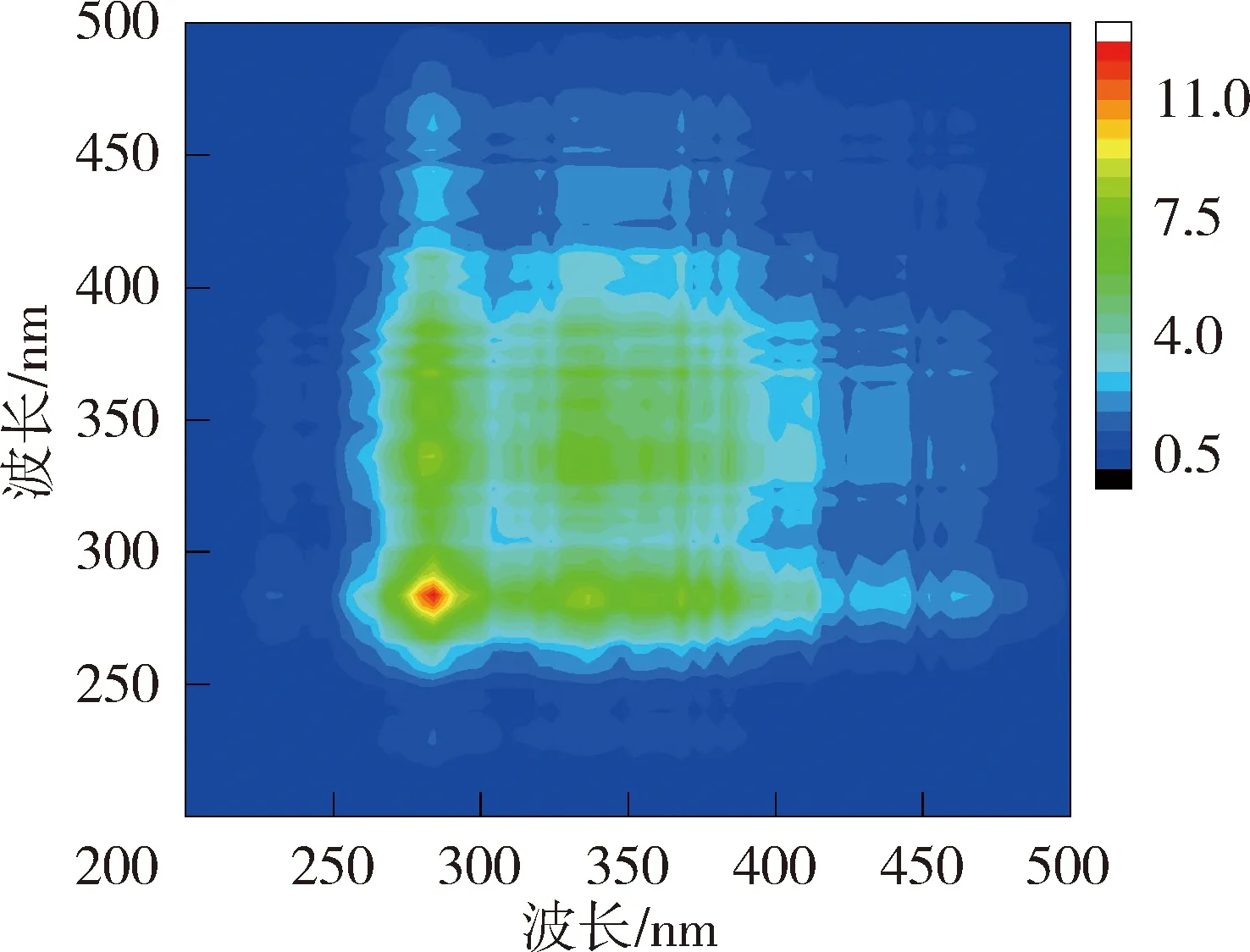
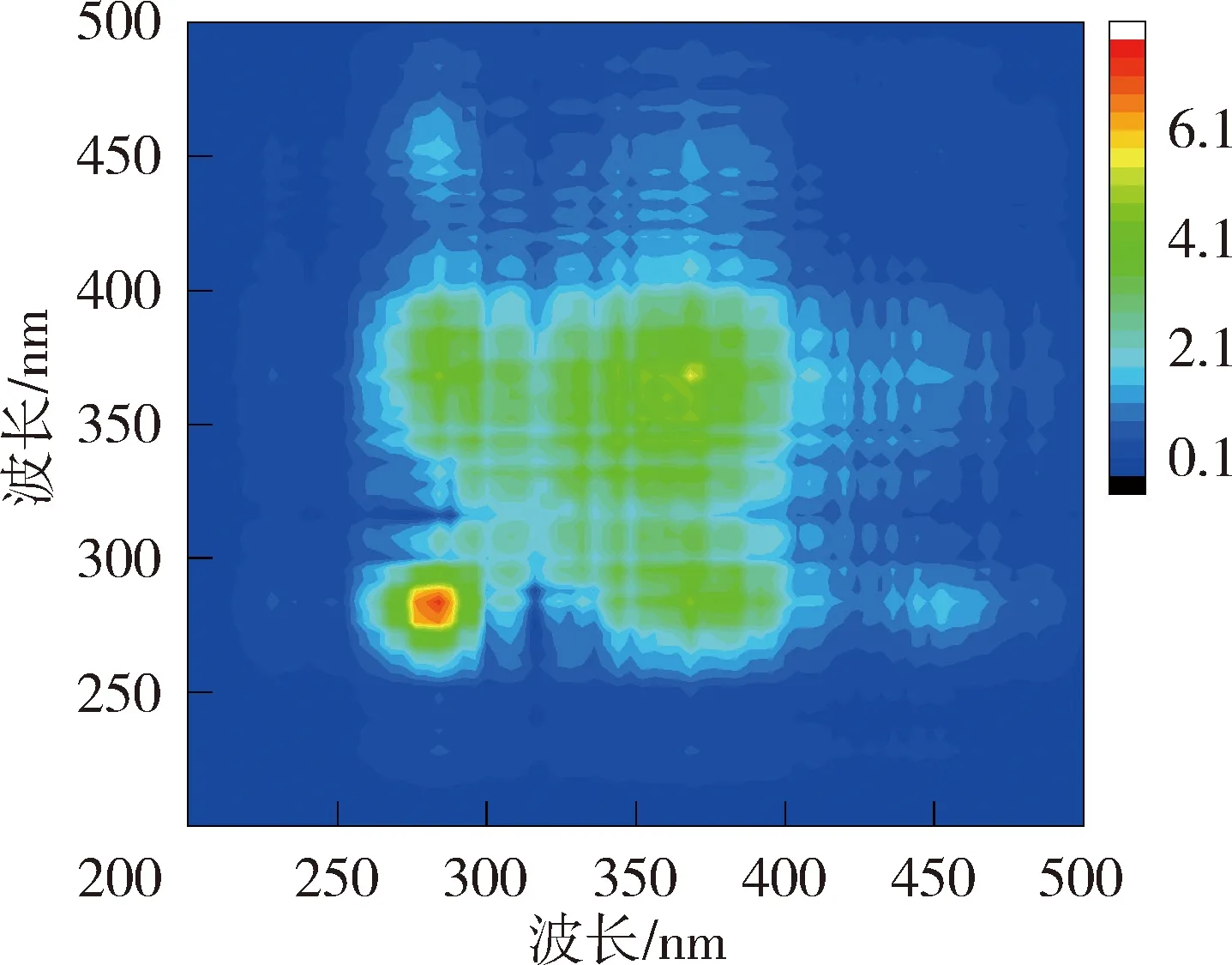
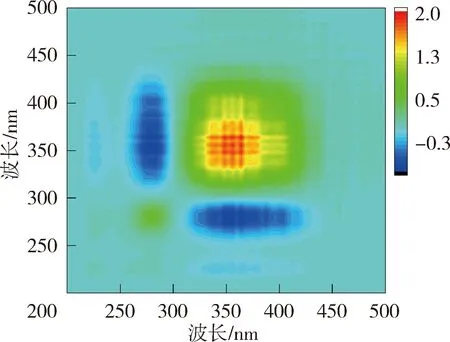
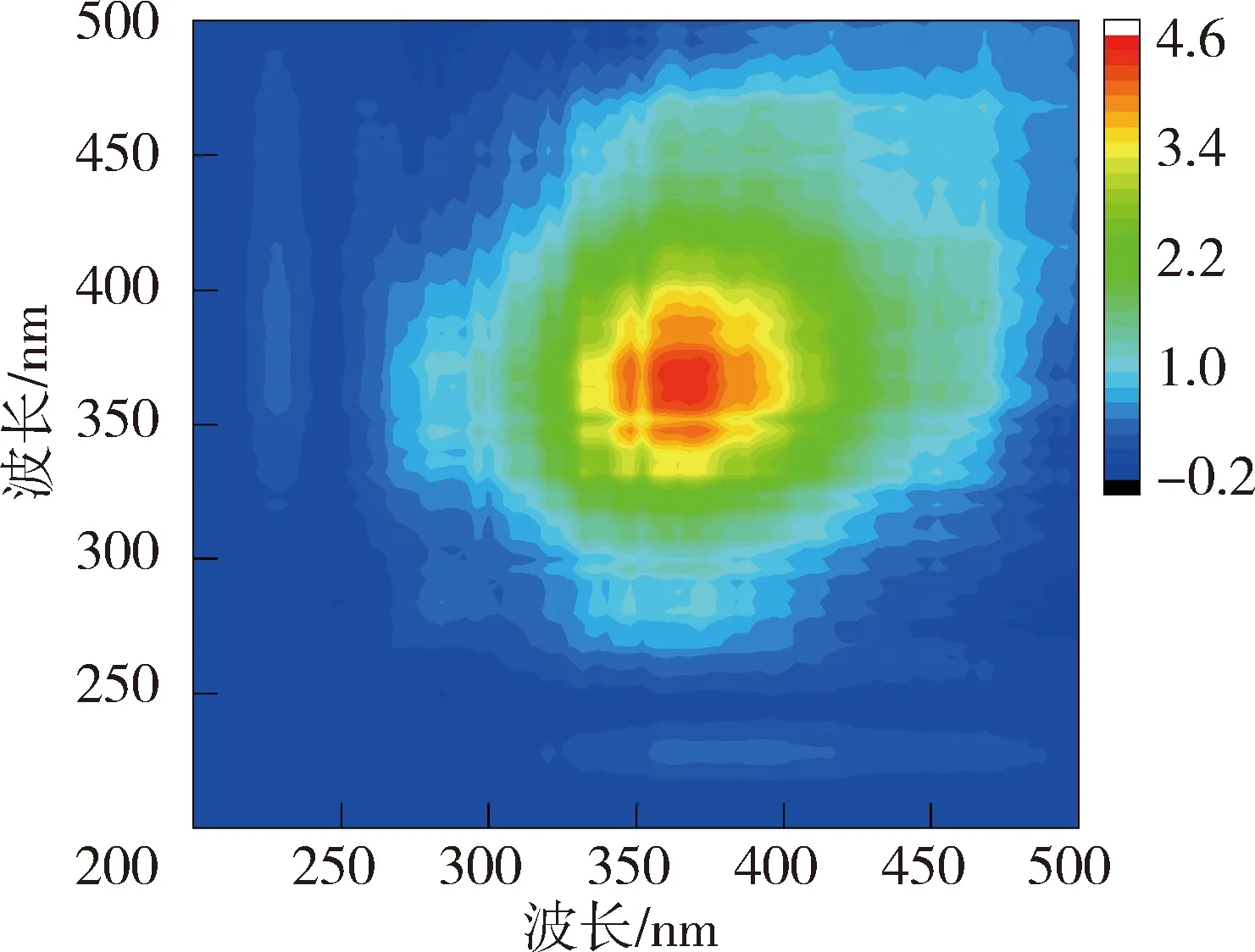
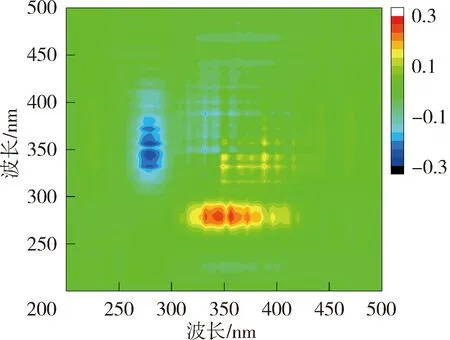
图6和图7为太湖和洪泽湖NOM与Cd2+结合的二维相关光谱图。太湖贡湖湾和梅梁湾NOM的同步二维相关光谱均在对角线上285 nm存在1个明显的自锋。洪泽湖湖心的同步二维相关光谱在对角线上279 nm处有1个较弱自峰,在310~425 nm内有1组明显的自峰,(310~425 nm,279 nm)处的交叉峰为负值,说明湖心NOM在2个光谱坐标处随着Cd2+浓度的增加荧光强度变化趋势相反,与前文荧光强度在类蛋白质区域随Cd2+浓度的增加下降,而腐殖质区域上升的结果一致;洪泽湖湖湾则在对角线上348~370 nm处有1个自峰。太湖NOM中类蛋白质自峰峰强高于类腐殖质,而洪泽湖NOM的自峰主要出现在类腐殖质,这可能是由于两个湖泊NOM组成上的差异导致的与Cd2+结合行为的差异。太湖NOM自峰峰强高于洪泽湖,说明太湖NOM更易与Cd2+的结合。
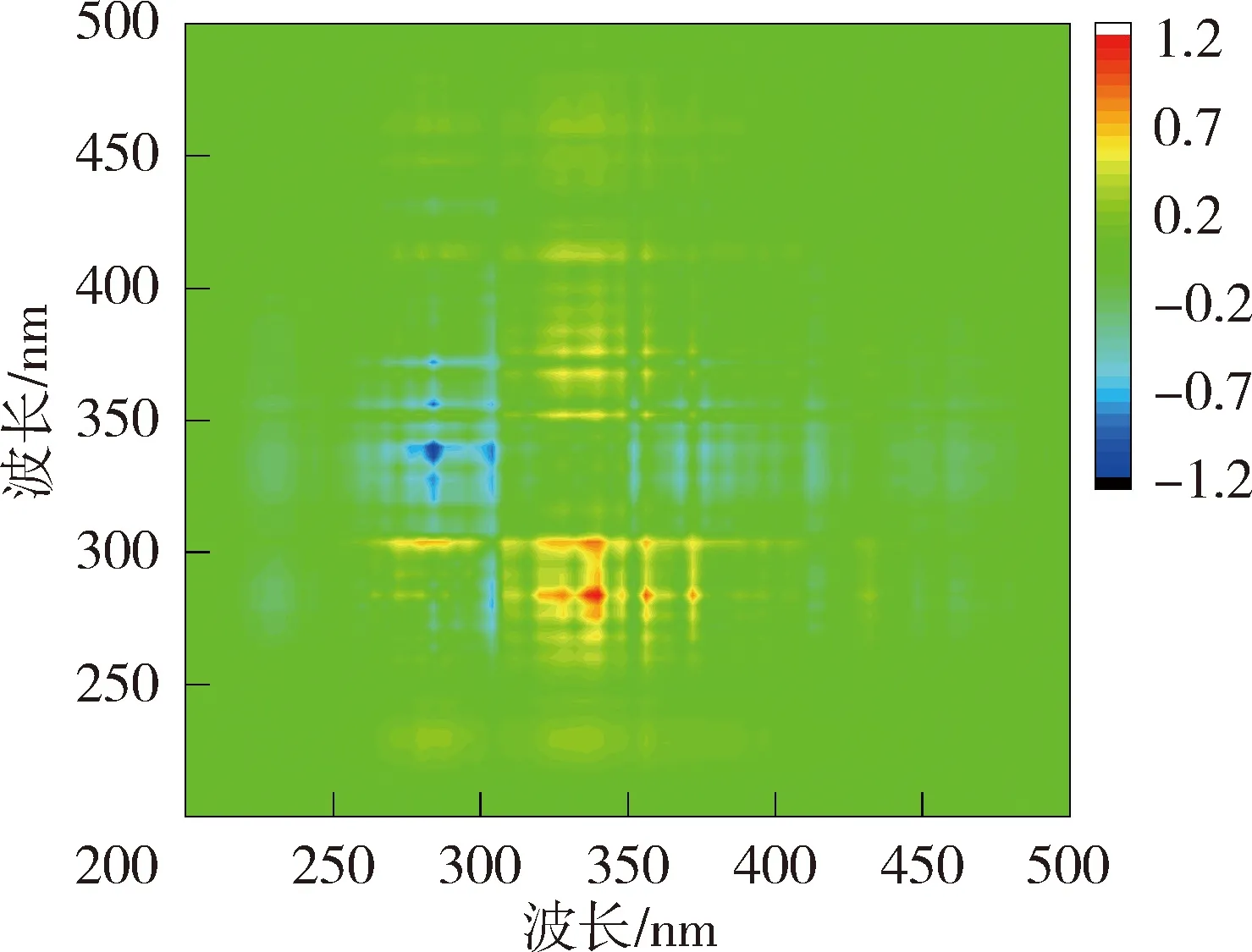
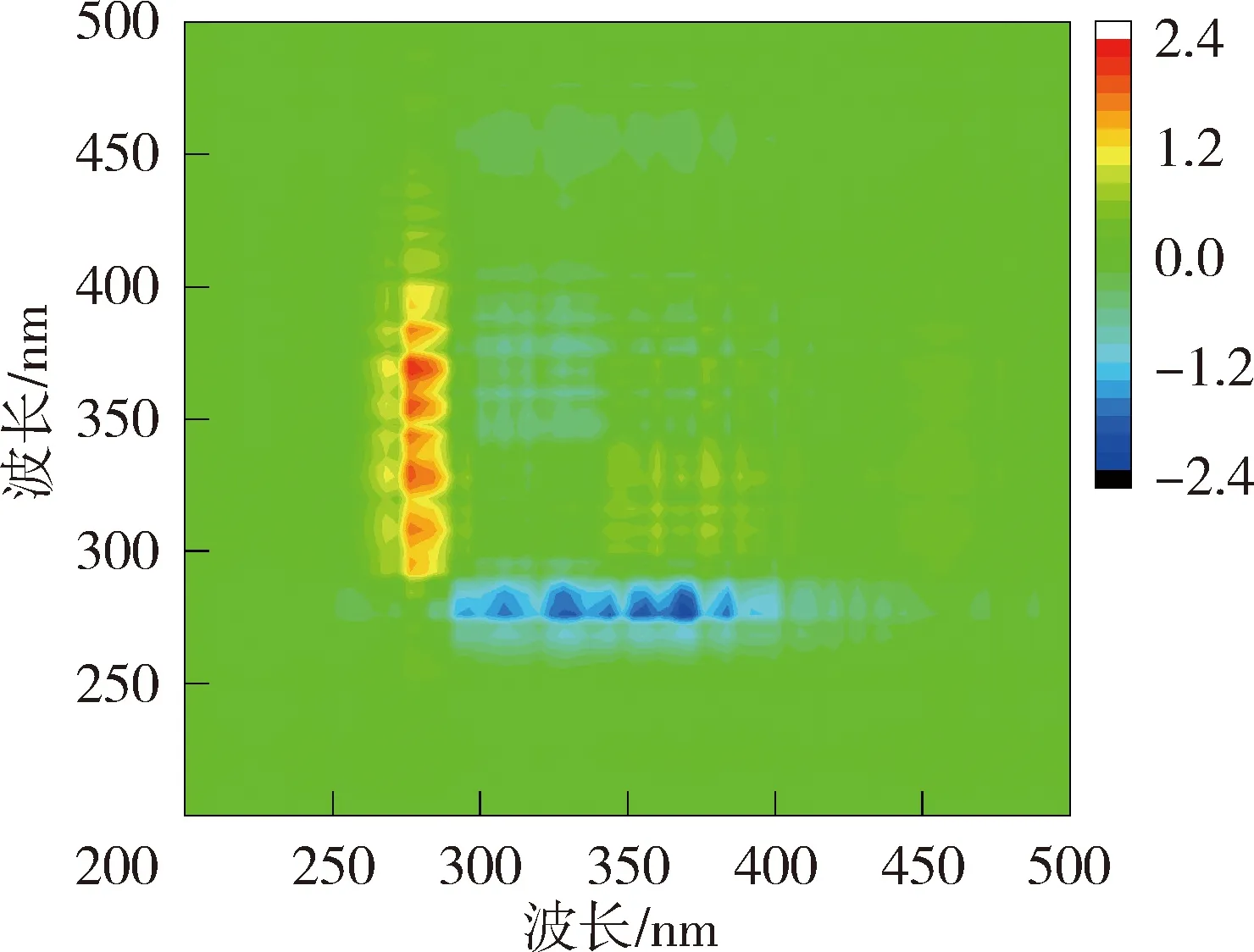
太湖NOM与Cd2+结合的异步二维相关光谱中,贡湖湾在对角线下方在(328 nm,285 nm)、(340 nm,285 nm)、(356 nm,285 nm)、(372 nm,285 nm)和(328 nm,304 nm)、(340 nm,304 nm)、(356 nm,304 nm)处有7个正峰,(304 nm,285 nm)处存在1个负峰,根据Noda规则贡湖湾NOM与Cd2+的结合顺序为328 nm→372 nm→285 nm→304 nm;梅梁湾在对角线右下方存在1组负峰,因此梅梁湾NOM与Cd2+的结合顺序为278 nm →296~385 nm。洪泽湖湖心NOM的异步二维相关光谱在对角线下方有1组明显的正峰,因此湖心NOM与Cd2+的结合顺序为279 nm →325~385 nm(同步光谱中对应区域为负值);湖湾NOM异步二维相关光谱在对角线右下方存在1组明显的负峰,另外在(281 nm,350~400 nm)位置处还有1个微弱的负值交叉峰,在湖湾NOM与Cd2+的结合顺序为281 nm→320~400 nm。
(a)太湖贡湖湾
(b)太湖梅梁湾
(c)洪泽湖湖心
(d)洪泽湖湖湾
图6 太湖和洪泽湖NOM与Cd2+结合的同步二维相关光谱
(a)太湖贡湖湾
(b)太湖梅梁湾
(c)洪泽湖湖心
(d)洪泽湖湖湾
图7 太湖和洪泽湖NOM与Cd2+结合的异步二维相关光谱
2.3 NOM与重金属结合系数
为进一步证实二维相关光谱分析得到的结果,利用Ryan-Weber模型对Cu2+和Cd2+作用下异步二维相关光谱中主要结合点位荧光强度的变化情况进行非线性拟合,得到相对应波长处NOM与Cu2+和Cd2+的结合稳定常数lgKM如表2所示。由于NOM部分结合点位与Cd2+结合时荧光强度出现增强的情况,无法拟合二者的lgKM。由表2可知,太湖贡湖湾和梅梁湾NOM与Cu2+结合的lgKM值分别在4.95~5.21和3.90~4.20范围内,洪泽湖湖心和湖湾分别在4.42~4.88和4.09~4.37范围内,太湖贡湖湾NOM的结合点位与Cu2+的结合能力最强。两个湖泊NOM与Cu2+结合的lgKM最大值均出现在波长275~285 nm范围内,表明4种来源的NOM中类蛋白质与Cu2+结合能力均大于类腐殖质,这可能与类蛋白质中的大量含氮基团有关。太湖贡湖湾和梅梁湾NOM各波长处与Cu2+结合的lgKM值由大到小的顺序分别为275 nm→375 nm→355 nm→345 nm和275 nm→344 nm→358 nm,与二维相关光谱异步光谱的结果一致。洪泽湖湖心和湖湾NOM与Cu2+结合的lgKM值由大到小的顺序分别为285 nm→359 nm→394 nm和281 nm→317 nm→324 nm→340 nm,其中洪泽湖湖心的结合顺序与前文二维相关光谱分析得到的285 nm→394 nm →359 nm在类腐殖质部分不完全一致,之前也有研究中出现过这样的情况[22],这可能是由于异步光谱中正峰不明显导致的,二者之间的具体关系还需要进一步探讨。
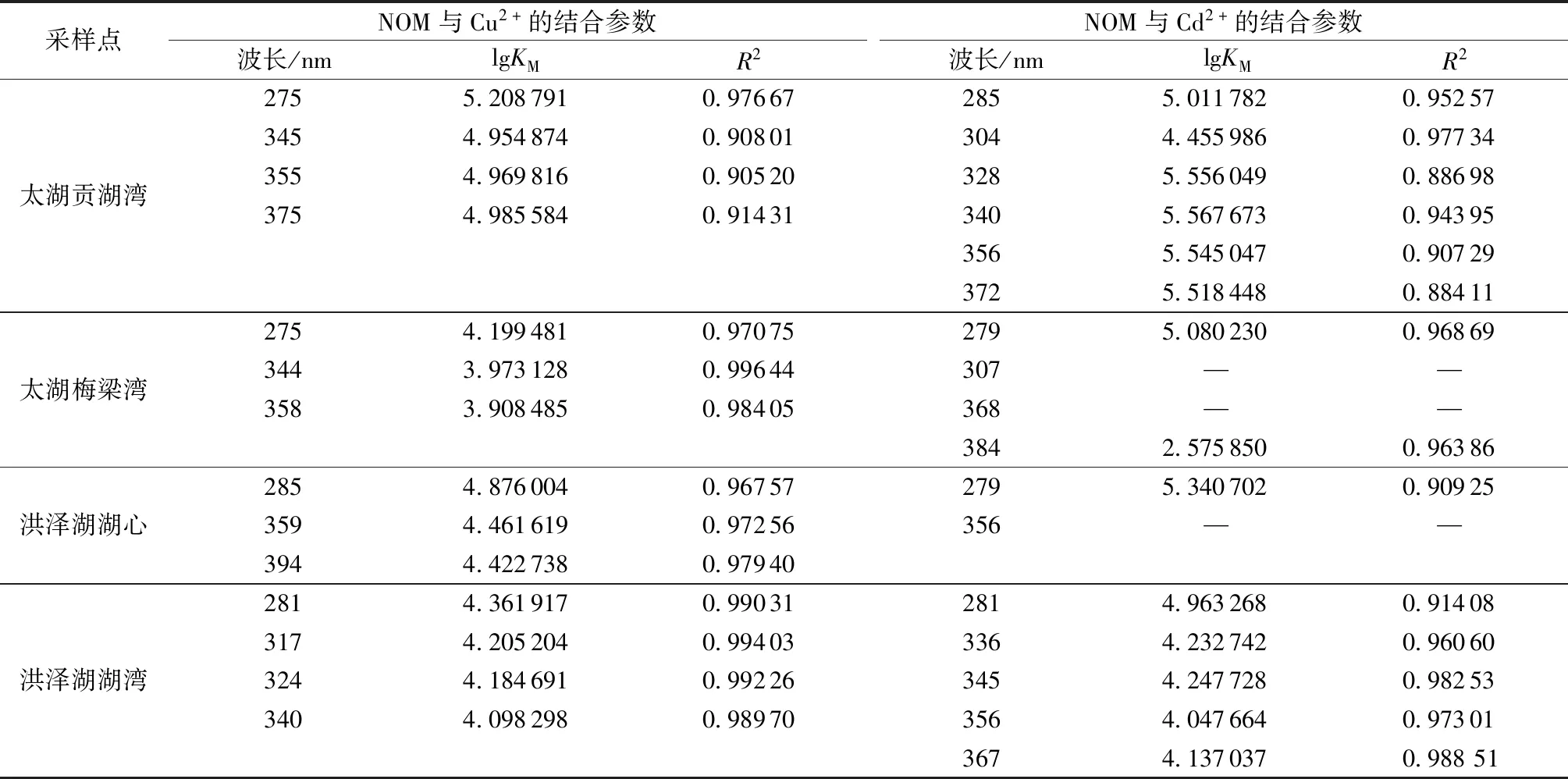
表2 Ryan-Weber模型确定的结合点位与重金属的结合参数平均值
太湖贡湖湾NOM在285 nm波长处与Cd2+结合的lgKM值为5.011 782,在304 nm处为最低值4.455 986,328~372 nm波长范围内的lgKM值在5.51~5.57范围内,各点位与Cd2+结合的lgKM值由大到小的顺序为328 nm→372 nm→285 nm→304 nm,总体上各部分对Cd2+的都有较强的亲和力,之前有研究表明类腐殖质结构中的羧基和酚羟基等基团以及类蛋白结构中的酰胺基对Cd2+都有很强的结合能力[28]。梅梁湾NOM在279 nm波长处与Cd2+结合的lgKM值为5.080 230,说明类蛋白质组分对Cd2+有较强的亲和力,类腐殖质部分在384 nm处的lgKM值为2.575 850,其他点位均无法计算。太湖NOM与Cd2+结合的lgKM值从大到小的顺序均与二维相关光谱异步光谱结果一致。洪泽湖湖湾与Cd2+结合的lgKM值在4.04~4.97范围内,其中最大值出现在波长281 nm位置,与二维相关光谱异步光谱得到的281 nm→320~400 nm顺序一致。虽然无法计算洪泽湖湖心NOM类腐殖质的lgKM值,但在279 nm处与Cd2+结合的lgKM值为5.340 702,说明洪泽湖类蛋白色氨酸物质对Cd2+有着较强的结合能力,符合二维相关光谱异步光谱的分析结果。
3 结 论
a. 两个湖泊NOM组成存在显著差异,太湖主要由类蛋白质和类腐殖质两部分组成,而洪泽湖NOM以类腐殖质为主。太湖NOM与重金属Cu2+和Cd2+的结合能力强于洪泽湖NOM。
b. Cu2+及Cd2+均能与两个湖泊NOM结合引起荧光淬灭,且与Cu2+结合能力要显著强于Cd2+。
c. 太湖贡湖湾和梅梁湾NOM中各结合点位与Cu2+的结合顺序分别为275 nm→375 nm→345nm和275 nm→344 nm→358 nm,洪泽湖湖心和湖湾分别为285 nm→394 nm→377 nm→359 nm和281 nm→317 nm→324 nm→340 nm→360nm、375 nm、396nm;与Cd2+的结合顺序分别为328 nm→372 nm→285nm→304 nm(太湖贡湖湾)、278 nm →296~385 nm(太湖梅梁湾)、279 nm→325~385 nm(洪泽湖湖心)和281 nm→320~400 nm(洪泽湖湖湾)。NOM类腐殖质中与重金属的结合点位要多于类蛋白质。
d. 太湖贡湖湾和梅梁湾NOM中类蛋白质与Cu2+的结合能力以及梅梁湾NOM中类蛋白质与Cd2+的结合能力强于类腐殖质,但贡湖湾NOM中类蛋白质与Cd2+的结合能力则弱于类腐殖质,而洪泽湖NOM中类蛋白质与Cu2+和Cd2+的结合能力均强于类腐殖质。这表明浅水湖泊NOM与重金属的结合能力不仅受NOM组成的影响,也受NOM组分特性的影响。
