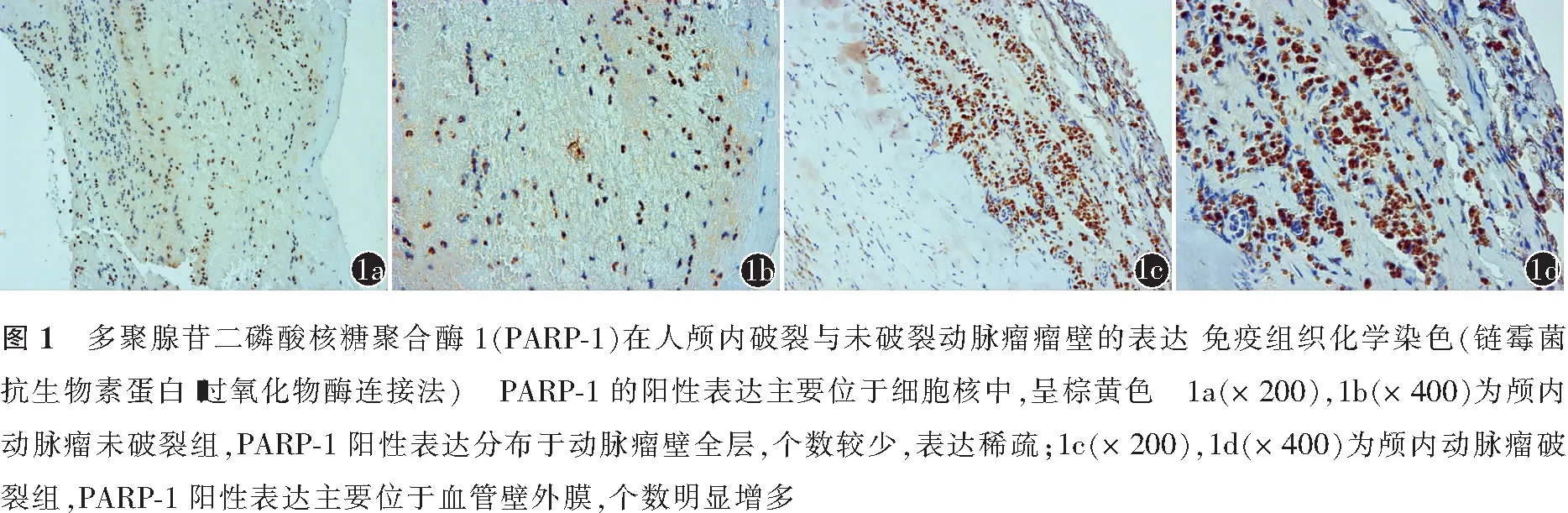
多聚腺苷二磷酸核糖聚合酶1在人颅内破裂与未破裂动脉瘤瘤壁中表达的差异
2019-09-25张顶顶余波李劲松韦永祥刘翔宇杭春华
张顶顶 余波 李劲松 韦永祥 刘翔宇 杭春华
因颅内动脉瘤破裂导致的蛛网膜下腔出血具有较高的发生率、致残率和致死率[1],但对于颅内动脉瘤形成和破裂的机制尚不清楚,临床上也缺乏有效的治疗药物以防止动脉瘤的形成和破裂[2]。越来越多的研究表明,炎性反应在颅内动脉瘤的形成和破裂中发挥了重要作用[3-4],其中多聚腺苷二磷酸核糖聚合酶1(poly adenosine diphosphate ribose polymerase 1,PARP-1)是调节炎性反应的重要核转录因子[5]。因此,笔者拟通过分析PARP-1在人体颅内破裂与未破裂动脉瘤瘤壁中的表达,以期探讨颅内动脉瘤形成和破裂的组织病理学机制。
1 对象与方法
1.1 对象
回顾性连续纳入2014年1月至2018年9月南京大学医学院附属鼓楼医院(1例)和东部战区总医院(12例)接受开颅夹闭手术治疗的颅内动脉瘤患者,其中男4例,女9例;年龄42~71岁,平均(55±8)岁。根据是否破裂,将13例患者分为破裂组(7例)和未破裂组(6例)。破裂组患者女4例,男3例;年龄47~71岁,平均(56±8)岁;大脑中动脉瘤5例,大脑前动脉和小脑上动脉瘤各1例;瘤体直径6~41 mm;合并高血压病1例。未破裂组患者女5例,男1例;年龄42~63岁,平均(53±9)岁;大脑中动脉瘤2例,前交通动脉瘤2例,右侧颈内动脉床突上段动脉瘤1例,右侧眼动脉段动脉瘤1例;瘤体直径6~35 mm;合并高血压病2例。两组患者性别、年龄的差异均无统计学意义(均P>0.05),具有可比性。本研究方案经南京大学医学院附属鼓楼医院和东部战区总医院伦理委员会审核批准,患者或其家属于术前均签署了知情同意书。
1.2 纳入与排除标准
纳入标准:(1)术前均经过CT血管成像和(或)DSA检查证实为颅内动脉瘤;(2)术中切除组织于术后均经苏木素-伊红染色证实为颅内动脉瘤瘤壁。排除标准:(1)合并烟雾病或动静脉血管畸形;(2)既往有颅内动脉瘤介入栓塞史;(3)因头部外伤发现颅内动脉瘤的患者,既往有开颅手术史;(4)有免疫系统疾病和(或)长期服用免疫抑制剂;(5)颅内多发动脉瘤;(6)长期服用阿司匹林药物。
1.3 主要试剂与仪器
PARP-1抗体(sc-74470,美国santa cruz公司);一抗稀释液(P0103,上海碧云天生物技术有限公司);免疫组织化学染色试剂盒(SPN-9001,北京中杉金桥生物有限公司),包含生物素标记的羊抗鼠IgG二抗、磷酸盐缓冲溶液(C0221A)和脱色摇床(E0016)。
1.4 标本处理
将术中切除的颅内动脉瘤瘤壁标本经4%多聚甲醛固定,4 ℃冰箱过夜后,常规石蜡包埋,制成厚度为4 μm的切片,60 ℃烤片8 h备用。
1.5 免疫组织化学染色
采用链霉菌抗生物素蛋白-过氧化物酶(streptavidin-perosidase,SP)法。将石蜡切片脱蜡和水化后,用磷酸盐缓冲溶液在摇床上冲洗3次,3 min/次。蒸馏水浸泡后用乙二胺四乙酸二钠缓冲液100 ℃下修复20 min,自然冷却至室温。蒸馏水冲洗2次,磷酸盐缓冲溶液冲洗2次,3 min/次。滴加过氧化酶阻断溶液,室温条件下孵育10 min,以阻断内源性过氧化物酶的活性。磷酸盐缓冲溶液冲洗3次,5 min/次。滴加山羊非免疫血清,室温孵育20 min,倾去。PARP-1与一抗稀释液按1∶50稀释,室温条件下孵育60 min,阴性对照用磷酸盐缓冲溶液代替。磷酸盐缓冲溶液冲洗3次,3 min/次。滴加生物素标记的二抗(羊抗鼠IgG),室温孵育10 min。磷酸盐缓冲溶液冲洗3次,3 min/次。滴加SP溶液,室温孵育10 min。磷酸盐缓冲溶液冲洗3次,3 min/次。二氨基联苯胺显色剂显色。自来水冲洗后,苏木素复染,自来水冲洗返蓝,用梯度酒精脱水干燥,二甲苯透明,中性树胶封片。晾干后,显微镜下拍片。
1.6 免疫组织化学染色结果判定
由两名工作年限≥5年的病理科医师采用双盲法判读。PARP-1免疫组织化学染色阳性结果为细胞核中出现棕黄色颗粒,每张切片均在高倍镜下(×400)计数10个视野,以10个视野下PARP-1阳性细胞个数的平均值计为每例患者最终的PARP-1阳性细胞个数[6]。
1.7 统计学分析

2 结果
两组患者的性别、年龄及动脉瘤直径的差异均无统计学意义(均P>0.05)。见表1。免疫组织化学染色结果显示,PARP-1的阳性表达主要位于细胞核中,呈棕黄色;在未破裂动脉瘤瘤壁中,PARP-1阳性细胞个数较少,分布稀疏,且在动脉瘤壁全层均有表达(图1a,1b);在破裂动脉瘤瘤壁中,PARP-1阳性细胞密集分布于血管壁外膜,与未破裂动脉瘤相比,破裂动脉瘤瘤壁中PARP-1阳性细胞个数增多(图1c,1d)。破裂组PARP-1的阳性表达高于未破裂组,组间差异有统计学意义(P<0.01)。见表1。

表1 两组接受开颅夹闭手术治疗的颅内动脉瘤患者临床资料及PARP-1阳性细胞数比较
注:PARP-1为多聚腺苷二磷酸核糖聚合酶1;a为Fisher确切概率法,b为t值,c为Z值;“-”表示无数据
3 讨论
PARP-1是一种多功能的细胞核内蛋白,可被断裂的DNA激活并参与DNA的损伤修复。研究表明,PARP-1在核转录因子κB(nuclear transcriptionfactor kappa B,NF-κB)的活性调节中具有重要作用[5]。PARP-1被激活后,与DNA结合可调节肿瘤坏死因子α(TNF-α)、白细胞介素(IL)1β和环氧化酶2等炎性因子的表达[7]。与未破裂动脉瘤相比,NF-κB及炎性因子(TNF-α、IL-1β和环氧化酶2)在人体颅内破裂动脉瘤瘤壁中的表达明显升高[8-9]。在颅内动脉瘤动物模型中,应用基因敲除或药物下调TNF-α、IL-1β和环氧化酶2的表达,可明显减少颅内动脉瘤的形成和破裂[10-11];通过抑制NF-κB的活性可抑制TNF-α、IL-1β和环氧化酶2的表达,从而减少动脉瘤的破裂[12]。此外,在腹主动脉瘤动物模型中,PARP-1可通过激活NF-κB及其介导的炎性反应促进动脉瘤的形成[13]。本研究结果显示,PARP-1在颅内破裂动脉瘤瘤壁中的表达高于未破裂动脉,其可能也通过调控NF-κB的活性及其介导的炎性反应参与了动脉瘤的形成和破裂。
本研究免疫组织化学结果显示,PARP1在破裂动脉瘤瘤壁中的表达主要位于血管壁外膜。传统观点认为,血管病变起源于内膜,并向中膜发展,血管壁外膜仅发挥营养血管中膜和血管支撑的作用。然而,越来越多的研究结果表明,血管壁外膜不仅是血管壁的一层支持结构,其在血管炎性反应的发生发展阶段及血管重构中均发挥重要作用[14-15]。在胸、腹主动脉瘤中,外膜中炎性细胞浸润(巨噬细胞和T淋巴细胞等)和炎性因子的高表达是动脉瘤形成的重要原因[15]。在多种炎性疾病模型中,PARP-1的高表达常伴炎性细胞的浸润和炎性因子的产生[5-16]。因此,PARP-1可能通过上调血管壁外膜的炎性反应,参与颅内动脉瘤的发生、发展及破裂。
综上所述,笔者对接受开颅夹闭手术治疗的颅内破裂及未破裂动脉瘤患者进行观察,其瘤壁的组织病理学结果及PARP-1阳性表达计数均表明PARP-1在颅内破裂动脉瘤瘤壁中的表达较未破裂动脉瘤瘤壁明显升高,提示PARP-1有可能在颅内动脉瘤的破裂中发挥作用。但本研究纳入的样本量较少,且动脉瘤破裂的血液刺激是否对PARP-1的表达产生影响,尚需进一步探讨。未来可进一步制作颅内动脉瘤的动物模型,用基因敲除或特异性抑制剂抑制PARP-1的表达,以进一步明确PARP-1在颅内动脉瘤破裂中的作用及机制。