LC-MS/MS法测定火锅食品中5种罂粟壳生物碱的不确定度评定
2019-09-24卫星华李小红董曼曼张荻悦张亚锋
卫星华 李小红 董曼曼 孙 晓 张荻悦 张亚锋
(西安市食品药品检验所,陕西 西安 710054)
罂粟壳是植物罂粟的干燥成熟果壳,其含有多种生物碱类物质,加入食品中会使人觉得更加美味,然而长期食用添加了罂粟壳的食品,会使人成瘾,给身体造成一定的损害,甚至导致死亡[1]。目前罂粟壳已被卫生部列入食品中可能违法添加的非食用物质名单中,禁止添加于火锅底料及小吃类食品中,并针对其含有的5种主要生物碱成分制定了相关的检验标准[2]。
在测量及评定过程中往往存在各种各样的影响因素[3-5],不但影响测评结果,也影响与之相关的司法裁决、行政决定、仲裁结果等评判的正确性[6]。研究参照相关标准[7-9],通过建立数学模型,对火锅食品中5种罂粟壳生物碱含量的不确定度来源进行讨论,以期为该检测方法及结果的准确度提供数据支持,并为实验室质量控制及其他非法添加的检测提供不确定度评定的参考。
1 材料与方法
1.1 材料与试剂
火锅底料:市售抽检样品;
乙腈:色谱纯,德国Merck公司;
甲酸、甲酸铵、无水硫酸镁、无水醋酸钠:分析纯,国药集团化学试剂有限公司;
试验用水为超纯水;
吗啡标准品:99.8%,中国药品生物制品检定所;
盐酸罂粟碱标准品:99.9%,德国Sigma-Aldrich公司;
蒂巴因标准品:100%,中国药品生物制品检定所;
可待因标准品(液标):99.88%,德国Sigma-Aldrich公司;
那可丁标准品:100%,中国药品生物制品检定所;
吗啡-D3标准品、可待因-D3标准品(液标):100%,上海安谱实验科技股份有限公司。
1.2 仪器与设备
液相色谱—质谱联用仪:Agilent 1200型液相色谱仪,Agilent 6410B Triple Quad LC/MS型三重串联四极杆质谱仪,配ESI离子源及MassHunter数据处理软件,美国Agilent公司;
电子分析天平:ME204E及MS105型,美国Mettler Toledo集团公司;
纯化水机:Milli-Q型,密理博中国有限公司;
超声波清洗器:KQ-700VDB型,昆山市超声仪器有限公司。
1.3 方法
1.3.1 标准溶液配制 分别准确称取标准品适量,用含0.5%甲酸的甲醇溶液配成罂粟碱、那可丁、蒂巴因和吗啡含量均为1 mg/mL的标准储备溶液。吗啡-D3、可待因-D3 和可待因均为液标,直接作为标准储备液使用。分别准确吸取粟碱、那可丁、蒂巴因标准储备液各1 mL,吗啡、可待因标准储备液各5 mL于25 mL容量瓶中,用乙腈稀释至刻度,混匀,即得含罂粟碱、那可丁、蒂巴因浓度为40 μg/mL和吗啡、可待因浓度为200 μg/mL的混合标准品溶液。
吸取上述混合标准品溶液5,2,1 mL,内标标准储备液0.2 mL,用乙腈分别定容至10 mL容量瓶中。另吸取上述混合标准品溶液1 mL,用乙腈定容至10 mL容量瓶中,作为中间标准品溶液,吸取中间标准品溶液0.1,0.2,0.3,0.5 mL,内标标准储备液0.2 mL,用乙腈分别定容至10 mL容量瓶中。得到罂粟碱、那可丁、蒂巴因浓度为0.4,0.8,1.2,2,4,8,20 ng/mL,吗啡、可待因浓度为2,4,6,10,20,40,100 ng/mL的系列标准工作溶液,内标溶液浓度均为40 ng/mL。
1.3.2 样品处理方法 称取2 g样品于50 mL离心管中,加入0.3 mL内标标准储备液,加入5 mL水。涡旋30 s,准确加入15 mL乙腈,涡旋1 min,超声30 min,加入6 g无水硫酸镁和1.5 g无水醋酸钠,立即涡旋2 min,以6 000 r/min离心5 min,取上清液,过0.22 μm滤膜作为待测样品。
1.3.3 色谱条件 流动相:A相为乙腈,B相为含0.1%甲酸的10 mmol/L甲酸铵溶液,按0.0~0.3 min,90% A;0.3~1.0 min,90%~75% A;1.0~3.5 min,75% A;3.5~4.0 min,75%~90% A;4.0~7.0 min,90% A进行梯度洗脱。色谱柱:Shiseido Capcell Pak C18MGⅢ,2.0 mm×150 mm,5 μm;柱温:35 ℃;流速:0.3 mL/min;进样体积:5 μL;离子化方式:电喷雾电离; 扫描方式:正离子扫描;检测方式:多反应监测(MRM);5种目标化合物的质谱条件详见表1。
1.4 数据处理
将系列标准工作溶液及经处理后的样品进样,罂粟碱、那可丁和蒂巴因采用外标法定量,吗啡和可待因为内标法定量,绘制标准工作曲线,将所得样品数据带入曲线,计算得到样品中5种物质的含量。

表1 5种目标化合物及2种内标的质谱条件†Table 1 Mass spectrometry conditions of 5 target compounds and 2 internal standards
† *为定量离子。
2 结果与分析
2.1 建立数学模型
根据模型建立原理及检测过程,计算火锅食品中5种罂粟壳生物碱的含量,罂粟碱、那可丁、蒂巴因采用外标法定量,可待因和吗啡采用内标法定量,样品含量按式(1) 计算。
式中:
X——试样中5种生物碱的含量,μg/kg;
c——试样溶液中5种生物碱的浓度,μg/L;
V——定容体积,mL;
m——样品质量,g;
r——回收率,%。
2.2 来源分析
由2.1中模型可知,测定不确定度主要来自以下几个方面:① 标准系列溶液配制过程所引入的不确定度,主要为标准物质称量urel(m标)及量具使用urel(V标)引入的不确定度;② 绘制标准工作曲线引入的不确定度urel(C标曲);③ 样品前处理过程引入的不确定度,主要为样品称量urel(m样)及样品提取urel(V样)引入的不确定度;④ 样品的重复性引入的不确定度urel(f);⑤ 由液质联用仪使用引入的不确定度urel(f液质);⑥ 回收率引入的不确定度urel(r)。其中各不确定度分量相互独立,被测样品的相对标准不确定度合成公式为:

(2)
2.3 各不确定度分量的分析与计算
2.3.1 标准系列溶液配制过程所引入的不确定度
(1) 标准物质称量引入的不确定度:采用十万分之一天平,根据检定证书,影响其不确定度的主因素及相关分量的标准不确定度计算结果如表2所示。由于标准物质证书未给出其误差范围,故在计算中可忽略。

表2 天平(d=0.01 mg)称量引入的不确定度Table 2 Standard uncertainty of balance (d=0.01 mg) measurement
其合成标准不确定度为:
u(m天平)=
6.78×10-5g。
采用减重法分两步称取标准品,以吗啡为例,2次称取数值分别为42.43,31.80 mg,以均匀分布计算,则吗啡的相对不确定度为:
urel(m吗啡)=[(6.78×10-5)/(42.43×10-3)]2+[(6.78×10-5)/(31.80×10-3)]2=2.66×10-3。
标准物质称量引入的相对不确定度计算结果见表3,可待因为液标无称量过程,故无标准物质称量引入的相对不确定度。

表3 标准物质称量引入的相对不确定度计算结果Table 3 Standard uncertainty of material weighing
(2) 量具使用引入的不确定度:量具的使用及温度是影响其不确定度分量的主要因素,由3部分组成:容量允差u(V1)、估读误差u(V2)及使用与配制时的温度u(V3)影响。
实验室温度为20 ℃(在±5 ℃之间变动),按照均匀分布,查得20 ℃的膨胀系数(α),甲醇为1.2×10-3,甲酸为1.03×10-3,乙腈为1.37×10-3,玻璃为2.5×10-4。由于含0.5%甲酸的甲醇溶液中甲酸含量较小,可忽略不计。玻璃量具的体膨胀系数明显小于液体的膨胀系数,可忽略不计。根据JJG196—2006《常用玻璃量器检定规程》规定内容,所用量具均为A级,欧洲分析化学中心(EURACHEM)认为其服从三角分布,计算各分量的标准不确定度,以A类1 mL单标线吸量管为例进行计算:
吗啡、可待因配置过程中1 mL单标线吸量管使用次数为4次(一根吸量管多次使用),其相对标准不确定度分别为:
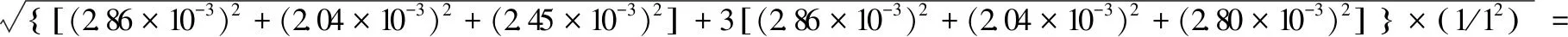
8.88×10-3。
罂粟碱、蒂巴因、那可丁使用次数为5次,其相对标准不确定度分别为:
9.96×10-3。
根据表4中不同量具的相对标准不确定度及1.3.1中标准溶液配制过程,计算配置标准系列溶液引入的相对合成标准不确定度见表5。
2.3.2 拟合标准工作曲线产生的不确定度 对标曲7个不同浓度的点分别测定1次,得到相应的色谱峰面积A,拟合线性回归方程为A=aC+b(a,b分别为斜率和截距),测定数据及计算结果如表6所示。吗啡、可待因采用内标法,吗啡-D3浓度为76.68 ng/mL,峰面积为2 283,2 308,1 949,2 288,2 186,2 048,2 286;可待因-D3浓度为79.92 ng/mL,峰面积为1 416,1 538,1 329,1 519,1 501,1 453,1 445。取一阳性样品进行6次重复测量,样品中5种生物碱的平均浓度分别为罂粟碱4.331 1 ng/mL、那可丁3.899 1 ng/mL、蒂巴因3.023 3 ng/mL、吗啡26.022 1 ng/mL、可待因23.020 1 ng/mL,由最小二乘法拟合校准曲线引入的标准不确定度如式(3)所示。

表4 量具使用引入的不确定度†Table 4 Standard uncertainty of measuring tool usage
† a为吗啡;b为罂粟碱、蒂巴因、那可丁;c为可待因。

表5 配置标准系列溶液引入的相对合成标准不确定度Table 5 Standard uncertainty of standard series solution configured
(3)
式中:
a——曲线的斜率;
b——曲线的截距;
x——样品的平均浓度,ng/mL;
C——标准工作溶液浓度的平均值,ng/mL;
n——标曲的测定次数,n=7;
P——样品的测定次数,P=6;
i——不同浓度标准工作溶液的下角标。
拟合标准工作曲线进行样品测量所产生的相对标准不确定度见表7。
2.3.3 样品前处理及测量引入的不确定度
(1) 样品称量引入的不确定度:采用万分之一天平,其影响因素及计算与“2.3.1(1)”中有关过程相同。根据检定证书,各分量的标准不确定度如表8所示。
平行称取2份样品,称样量分别为2.027 2,2.003 8 g,则样品称量引入的相对不确定度为:


表6 标准曲线相关数据Table 6 Standard curve data

表7 配置标准系列溶液引入的相对合成标准不确定度Table 7 Standard uncertainty of standard series solution configured
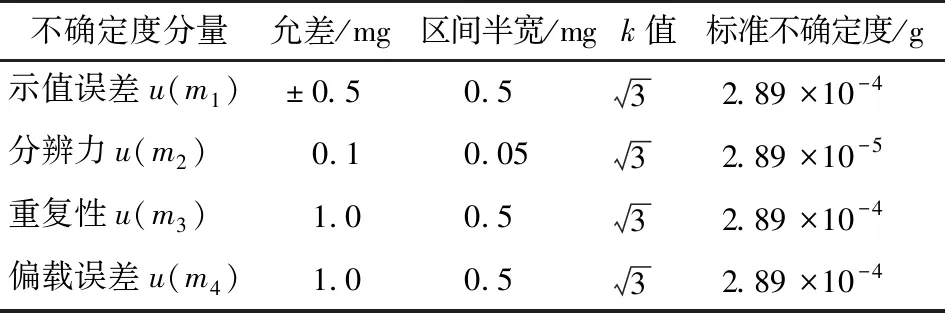
表8 天平(d=0.1 mg)称量引入的不确定度Table 8 Standard uncertainty for balance (d=0.1 mg) measurement

使用量具定容过程引入的相对标准不确定度为:
urel(V样)=
2.003 8=2.64×10-2。
2.3.4 样品重复性引入的不确定度 样品重复性引入的不确定度包含了c、V和m测量时的重复性不确定度的分量,属A类评定。对样品进行6次测定的值及其平均值及应用贝塞尔公式计算单次测量结果的试验标准偏差(n=6)结果见表9。
样品重复性引入的相对不确定度为:
urel(f罂粟碱)=6.22×10-2/4.340 2=1.43×10-2;
urel(f那可丁)=8.26×10-2/3.906 2=2.11×10-2;
urel(f蒂巴因)=6.75×10-2/3.023 6=2.23×10-2;
urel(f吗啡)=1.88/26.023 2=7.22×10-2;
urel(f可待因)=1.77/23.015 7=7.69×10-2。
2.3.5 由液质联用仪使用引入的不确定度 由校准证书上可知,Agilent 1200-6410液质联用仪的峰面积重复性为0.7%,则其相对扩展不确定度为0.7%,按均匀分布计算,其相对标准不确定度为:
2.3.6 样品回收率引入的不确定度 对上述样品进行6次加标回收试验,将混合标准品溶液加入空白样品中,照1.3.2方法处理,即得加标回收样品,并对加标样品进行测定,样品添加水平及所得回收率如表10所示。
用贝塞尔公式计算回收率的标准偏差,样品回收率引入的相对标准不确定度为:

表9 样品数据Table 9 Analytical results of sample
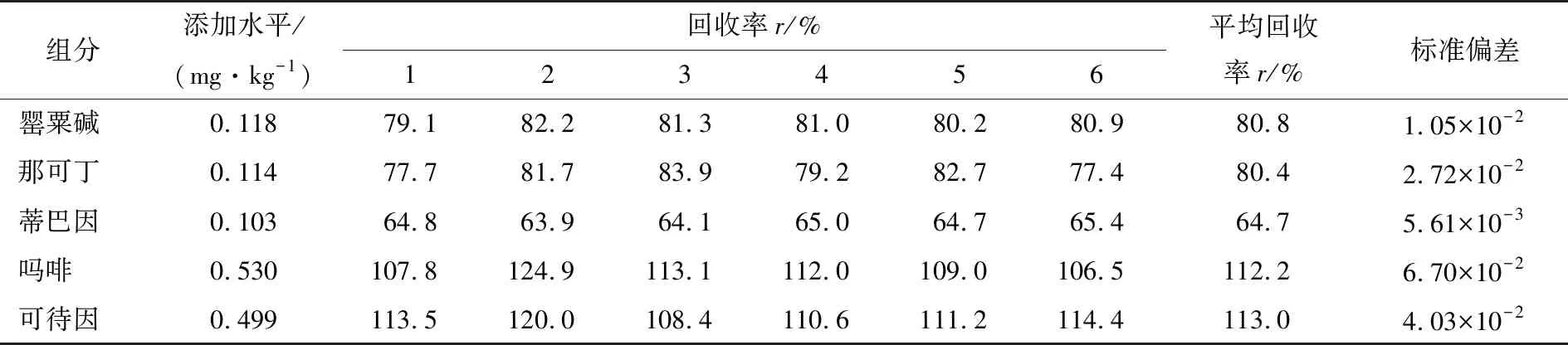
表10 样品回收率Table 10 The recovery rate of sample (n=6)
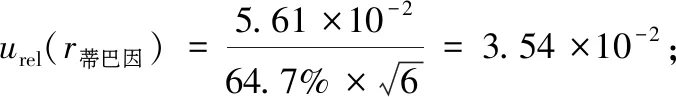

采用t检验对平均回收率进行显著性检验。
5种成分的t值与95%置信度,n—1自由度的双边临界值比较,结果均大于2.571,说明r与100%有非常显著差异,必须在计算公式中采用回收率校正因子r修正结果。
2.3.7 罂粟壳中5种生物碱的合成标准不确定度及扩展不确定度 各不确定分量相互独立,按式(2)计算可得相对合成标准不确定度如表11所示。
由模型和2次独立样品的试验结果,计算得到2份火锅食品中5种物质的含量分别为罂粟碱31.1 μg/kg、吗啡179.0 μg/kg、那可丁28.5 μg/kg、蒂巴因22.2 μg/kg、可待因171.0 μg/kg,合成标准不确定度为:

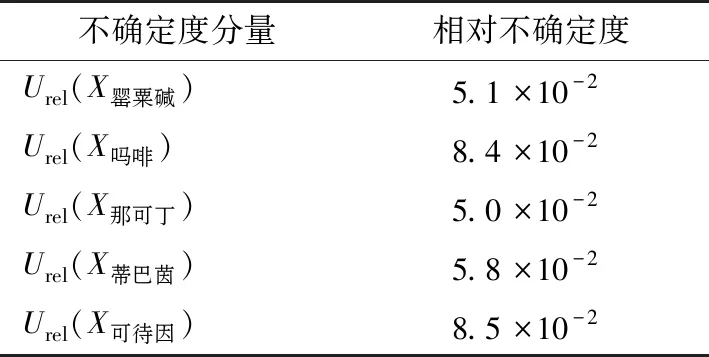
表11 5种生物碱的相对合成标准不确定度Table 11 Standard uncertainty of 5 alkaloids


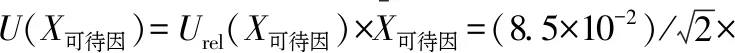
取包含因子k=2,包含概率95%,计算扩展不确定度可得:
U罂粟碱=k×U罂粟碱(X)=2×1.2=2.4 μg/kg。
同法可得:
U吗啡=22 μg/kg,U那可丁=2.0 μg/kg,U蒂巴因=1.9 μg/kg,U可待因=22 μg/kg。
因此,液质联用法测定火锅食品中5种生物碱测量结果可表示为:罂粟碱(31.1±2.4) μg/kg,k=2;吗啡(179±22) μg/kg,k=2;那可丁(28.5±2.0) μg/kg,k=2;蒂巴因(22.2±1.9) μg/kg,k=2;可待因(171±22) μg/kg,k=2。
3 结论
试验评定了液质联用法测定火锅食品中5种罂粟壳生物碱含量的不确定度,根据各分量不确定度的计算结果可以得出,影响检测结果不确定度的主要因素有样品回收率,样品平行试验重复性,样品提取,校准曲线拟合,标准工作溶液的配制。从校准曲线拟合这一不确定度分量可以看出,采用内标法进行测定的吗啡和可待因相对标准不确定度明显小于其他3种物质。在试验中,建议通过以下几个方面来降低检测结果的不确定度:① 减少量具使用次数并规范估读量具读数至最小分度值的1/5~1/10,可以降低量具引入的测量不确定度;② 对需检测成分加入内标定量,可以降低不同样品基质所引入的不确定度;③ 被测样品浓度均值应接近所配制的罂粟碱等5种物质工作曲线的中间位置,以降低标准曲线变动引入的测量不确定度;④ 提高人员操作熟练程度,可以适当降低样品重复性所引入的不确定度;⑤ 试验前提前稳定仪器状态并定期对所涉仪器进行检定,使仪器保持较高的灵敏度及稳定性,可以降低仪器引入的不确定度。
