山楂叶总黄酮对胶质瘤U87细胞的抑制作用
2019-09-24刁婷婷张雨晨
刁婷婷,张雨晨,吕 伟,闵 清
(1. 湖北科技学院药学院,湖北 咸宁 437100; 2. 湖北省咸宁市中心医院药学部,湖北 咸宁 437100)
人胶质母细胞瘤是一种Ⅳ级星形细胞瘤,是最常见、最具侵袭性的脑肿瘤[1]。胶质母细胞瘤在40~70岁之间发生率较高,中位生存期为诊断后的12~16个月。胶质母细胞瘤是脑肿瘤死亡率最高的肿瘤,虽然有手术、放疗、化疗、基因治疗等多种治疗方法, 但因其侵袭性强、复发率高、位置特殊、预后差, 具有很高的病死率和致残率, 严重威胁着人类健康[2]。肿瘤细胞从原发肿瘤逃逸到转移部位是一个多步骤的过程,需要细胞黏附的丧失,并获得细胞的迁移和侵袭能力[3]。目前,治疗恶性胶质瘤成为肿瘤领域的重大挑战之一[4],因此,寻找有效的生物靶点,研发理想的治疗药物尤为迫切。
山楂叶总黄酮(hawthorn leaves flavonoids,HLF)是一种存在山楂叶中的黄酮类化合物,山楂叶为蔷薇科山楂属植物山里红或山楂的干燥叶[5],由于其资源丰富、价格低廉,具有广泛的药理作用,且低毒安全的特性,近年来倍受医药研究者的关注。目前,从山楂叶中分离出的黄酮类化合物已有60余种,黄酮类化合物具有抗炎、抗氧化、抗衰老、抗癌防癌等功效[6],具有重要的药用价值,成为近年来研究热点之一。现已明确HLF在降压降脂、抗动脉粥样硬化方面具有明显疗效,已应用于冠心病、心绞痛、高血压等心血管疾病的治疗[7],但HLF对恶性胶质瘤治疗作用的相关研究报道较少。因此,本实验以胶质瘤U87细胞为研究对象,探讨HLF对U87细胞增殖、黏附、迁移和侵袭的影响,期望可以更好地利用山楂叶这一丰富低廉的药用资源,为今后HLF的抗肿瘤临床应用及进一步合理开发其药用价值提供依据。
1 材料与方法
1.1 药物与试剂HLF(含量93.5%),购于山东临沂爱康药业。DMEM高糖培养基、Transwell小室,购自HyClone公司;胎牛血清(fetal bovine serum,FBS)、0.25%胰蛋白酶,购自Gibco公司;Matrigel胶,购自Corning公司;二甲基亚砜(dimethyl-sulfoxid,DMSO),购自Sigma公司;CCK-8试剂盒,购自大连美仑生物技术有限公司。
1.2 仪器CO2培养箱(ESCO公司);超净工作台、高温灭菌锅(Biobase公司);酶标仪(基因有限公司);倒置显微镜(Olympus公司);Western电泳仪(Bio-Rad公司);水平摇床(海门市其林贝尔仪器制造有限公司);低温高速离心机(湘仪离心机仪器有限公司)。
1.3 细胞培养U87细胞购自中科院细胞库。将U87细胞复苏后,接种于T25细胞培养瓶中,使用DMEM高糖培养基培养,置37 ℃、5% CO2的培养箱中,待细胞长至90%以上,使用0.25%胰酶消化后传代培养,取对数生长期细胞进行实验。
1.4 药物配制及分组称取HLF 100 mg,溶于1 mL DMSO溶液中,配成浓度为100 g·L-1的母液备用,采用DMEM培养基将药物母液稀释成相应浓度。
1.5 CCK-8法检测细胞增殖能力将已消化的细胞计数,并调整细胞浓度为5×107个·L-1,然后将细胞悬液加入相对应的96孔板内,每孔100 μL细胞悬液,每个浓度设5个复孔。将96孔板在培养箱培养过夜,弃去原培养基,加入含有相对应药物浓度的培养基100 μL于96孔板内,放置培养箱内培养24 h。每孔分别加入10 μL CCK-8溶液,置于培养箱内2 h后,使用酶标仪在450 nm处测定吸光度。细胞存活率/%=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.6 划痕实验检测细胞迁移能力将U87细胞消化后均匀铺在6孔板内,待细胞长至95%左右时,用黄枪头沿每孔的顶端和底部画一条直线,将原培养基更换为含不同HLF浓度的培养基,并放置培养箱内8 h。之后弃去培养基,PBS洗3次,4%多聚甲醛固定7 min,PBS洗3次,洗去除残留固定液,使用光学显微镜拍照。细胞迁移率=(初始细胞间隙-实验组细胞间隙)/(初始细胞间隙-对照组细胞间隙)×100%,设定对照组迁移率为1。
1.7 Transwell法检测细胞侵袭能力细胞饥饿24 h,将Matrigel胶与培养基按照1∶2的比例混合,每个小室加入30 μL,铺平且无气泡,放置培养箱内40 min,使其凝固。使用无血清培养基调整U87细胞密度为6×108个·L-1,并取100 μL加入上室,继续加入100 μL含不同浓度HLF的无血清培养基,下室加入600 μL相应浓度HLF的含血清培养基。放置培养箱内培养24 h后取出,使用PBS清洗后,加入4%多聚甲醛使其固定10 min,使用棉签擦去未穿过小室的细胞,加入0.5%结晶紫溶液染色10 min,使用PBS洗去多余培养基,待干燥后拍照。细胞侵袭率=实验组细胞数/对照组细胞数×100%,设定对照组侵袭率为1。
1.8 黏附实验检测细胞黏附能力使用培养基按2∶1稀释Matrigel,并以40 μL每孔加入96孔板内,放置培养箱内1 h,吸取未凝固的基质胶。将不同浓度的HLF预处理24 h的U87细胞消化,并调整密度为108个·L-1,以100 μL每孔加至96孔板内,放入培养箱90 min。弃去培养基,PBS洗3次,4%多聚甲醛固定7 min,0.1%结晶紫染色10 min,PBS洗3次洗去残留结晶紫,使用光学显微镜拍照。每组拍照结果进行细胞计数,细胞黏附率=实验组细胞数/对照组细胞数×100%,设定对照组黏附率为1。
1.9 克隆形成实验检测细胞克隆形成能力细胞消化后,调整细胞密度为1.8×107个·L-1,将U87细胞按100 μL每孔加至6孔板内,放入培养箱内过夜。将原培养基更换为含不同浓度HLF的培养基,放置培养箱内7 d。弃去培养基,PBS洗3次,4%多聚甲醛固定7 min,0.1%结晶紫染色10 min,PBS洗3次去除残留结晶紫,使用光学显微镜拍照。
2 结果
2.1 HLF对U87细胞的增殖抑制作用Fig 1结果显示,U87细胞在不同浓度的HLF作用24 h后,细胞增殖能力明显下降,与对照组相比,HLF(25、50、100 mg·L-1)组的细胞存活率分别为75.3%、63.9%(P<0.01)、50.5%(P<0.01),并随着药物浓度的增加,细胞活力明显降低。
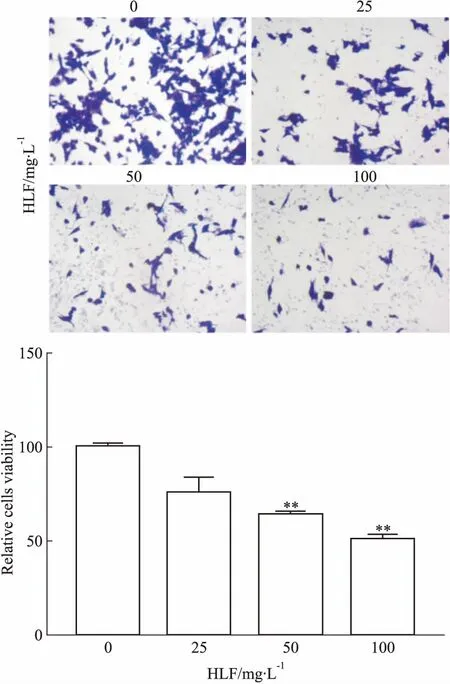
Fig 1 Effects of different concentrations of HLF on proliferation of U87 cells vs control(0 mg·L-1)
2.2 HLF对U87细胞迁移能力的影响Fig 2的划痕实验结果显示,HLF处理8 h后,U87细胞的迁移能力明显减弱,与对照组相比,HLF(25、50、100 mg·L-1)组的迁移细胞比率分别为73.3%、62.0%、52.7%(P<0.05,P<0.01)。提示HLF能明显降低U87细胞的迁移能力,且HLF对其迁移能力的抑制具有一定的浓度依赖性。

Fig 2 Effect of HLF on migration ability of U87 cells vs control(0 mg·L-1)
2.3 HLF对U87细胞侵袭能力的影响Fig 3结果显示,HLF处理24 h后,U87细胞侵袭能力明显减弱,与对照组相比,HLF(25、50 mg·L-1)组的侵袭细胞比率分别为72.4%、48.9%(P<0.01)。提示HLF能明显降低U87细胞的侵袭能力。

Fig 3 Effect of HLF on invasion ability of U87
2.4 HLF对U87细胞黏附能力的影响Fig 4结果显示,HLF处理24 h后,U87细胞黏附能力明显减弱,与对照组相比,HLF(25、50、100 mg·L-1)组均明显抑制了U87细胞与基质黏附的能力,抑制率分别为19.5%、40.9%、63.6%(P<0.05,P<0.01)。
2.5 HLF对U87细胞克隆形成的影响Fig 5的克隆形成实验结果显示,HLF处理7 d后,细胞克隆能力明显减弱,与对照组比较,随着HLF浓度的升高,U87细胞的克隆形成率逐渐降低,呈浓度依赖性。
3 讨论
山楂叶在我国资源丰富,具有易得、低毒性的特点。HLF是山楂叶提取物中一系列黄酮类化合物的总称,如芦丁、槲皮素、金丝桃苷、葡荆牡黄酮等[8-9],其具有抗动脉粥样硬化、降血压、降血脂、抗氧化应激、抗炎、抗心肌缺血缺氧、抗血管性痴呆、抗细胞凋亡、抗肿瘤等药理作用[10]。胶质瘤细胞U87细胞是人类最常见、最具侵袭性的脑肿瘤,如何有效抑制恶性脑胶质瘤的复发、黏附、侵袭及迁移已成为目前研究的热点,HLF抑制肿瘤细胞的研究,将为中药抗肿瘤研究及进一步开发提供新的思路。

Fig 4 Effect of HLF on adhesion ability of U87
本研究CCK-8法检测HLF作用后U87细胞存活率的结果显示,HLF(25、50、100 mg·L-1)组细胞存活率均降低,当HLF浓度>50 mg·L-1时具有统计学意义,且这种作用随着其浓度的增加而增强。倒置显微镜观察结果显示,正常对照组细胞大而饱满,轮廓清楚,细胞间接触紧密。药物作用U87细胞24 h时,随着HLF浓度增加,细胞数量明显减少,细胞的体积变小,细胞间距变大,细胞出现皱缩、脱落,贴壁细胞轮廓模糊。CCK-8实验结果证明,HLF可以抑制U87细胞的增殖。迁移是肿瘤细胞转移过程中必不可少的环节之一,划痕实验结果显示,HLF作用U87细胞后,随着HLF浓度的增加,与对照组相比,U87细胞迁移比率明显下降,提示HLF可以抑制U87细胞的迁移能力,具有一定的浓度依赖性。肿瘤细胞与母体瘤分离,穿越血管壁,侵袭周边正常组织时,需要一定的侵袭能力,高侵袭的肿瘤细胞通常具有较强的运动性。Transwell体外侵袭迁移模型模拟在体外U87细胞的侵袭状况,结果显示,随着HLF浓度的增加,与对照组相比,U87细胞侵袭数目均明显下降,提示HLF能够有效抑制U87细胞的侵袭。细胞的黏附性在维持细胞外形、调节细胞分裂、运动等功能中起十分重要的作用,黏附是肿瘤细胞侵袭的始动步骤。黏附实验结果显示,HLF作用U87细胞24 h后,随着HLF浓度的增加,与对照组相比,U87细胞黏附能力明显减弱,提示HLF可以抑制U87细胞与基质黏附的能力。
综上所述,HLF对胶质瘤U87细胞的生长增殖、迁移、侵袭及黏附能力有一定的抑制作用,但其作用机制尚不清楚。现已公认,可以通过ERK和Akt信号通路抑制肿瘤细胞的增殖、迁移、侵袭等功能[11-12],但HLF是否通过该信号通路对U87细胞产生抑制作用,还有待我们进一步探讨和研究。

Fig 5 Effect of HLF on cell clonality of U87 cells