蚕蛹多肽螯合钙的制备工艺优化及结构表征
2019-09-23赵梓月王思远廖森泰穆利霞邹宇晓
赵梓月 王思远 廖森泰 穆利霞 邹宇晓
(1. 广东省农业科学院蚕业与农产品加工研究所,广东 广州 510610;2. 广东省农产品加工重点实验室,广东 广州 510610;3. 农业农村部功能食品重点实验室,广东 广州 510610)
目前市场上的补钙产品大多为碳酸钙、葡萄糖酸钙和乳酸钙等离子钙,这些离子钙溶解性较差,吸收时需消耗大量胃酸,吸收率和生物利用率低,在肠道中易形成钙沉淀[1]。氨基酸及多肽能与钙离子形成可溶性螯合物,完整地被转运吸收,螯合钙作为第三代补钙制剂,具有稳定性好、生物利用率高、抗干扰性强的优点,如酪蛋白磷酸肽,是目前为止发现的最具促钙吸收作用的短肽,作为钙强化剂被广泛应用于婴幼儿食品及其他补钙类功能食品当中,此外市场上还有卵黄高磷蛋白磷酸肽螯合钙和复方氨基酸螯合钙等,但产品种类还较单一,价格较高。近年来,国内外学者已从多种食品蛋白中制备出金属螯合肽,如大豆[2]、南极磷虾[3]、太平洋鳕鱼[4]等,并发现这些肽类在改善钙等二价矿物元素生物利用度方面具有极大的潜力,同时有研究[2]表明肽钙结合能力与多肽中羧基含量呈线性相关,其结合位点可能是Glu、Asp上的羧基。因此,寻找高效、低成本的多肽材料来开发多肽螯合钙制剂具有十分重要的意义。同时,目前关于肽钙结合机制的研究主要集中在磷酸基团—钙、羧基—钙两种模式[5],也有研究[6]发现还有其他多种基团在肽钙反应中发生了变化,但上述研究均未涉及多肽中活性基团与钙结合的先后顺序,还有待进一步深入探讨。
中国种桑养蚕历史悠久,传统养蚕业以茧丝为主产品,蚕蛹作为副产物产量很大。据统计,中国每年可产鲜茧60余万t,蚕蛹产量可达40余万t[7],缫丝后的蚕蛹大多废弃或加工为饲料,利用率和经济效益较低。蚕蛹中蛋白质含量约为12%~16%,具有良好的氨基酸配比,且Asp和Glu含量最高,分别可达总氨基酸的10%和14%左右[8],可提供丰富的肽—钙结合位点,是制备肽螯合钙的优质原料,但目前尚无蚕蛹多肽螯合钙的相关研究报道。笔者[9]前期建立了蚕蛹多肽制备工艺,并发现其具有良好的与钙结合能力。试验以蚕蛹为原料制备肽螯合钙,利用响应面优化法确定其最佳工艺条件,并跟踪螯合反应中多肽随钙源添加的结构变化规律,探索钙与多肽的结合机理,以期挖掘出一种高含钙量的多肽螯合钙原料,为新型高效的补钙制剂研制和蚕桑资源综合开发提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
新鲜削丝蚕蛹:两广2号,韶关翁源县真诚意蚕桑专业合作社;
Alcalase酶(4.3×106U/mg)、胃蛋白酶(3.0×105U/mg)、胰蛋白酶(4.3×106U/mg)、复合蛋白酶(2.3×106U/mg):诺维信(中国)生物技术有限公司;
石油醚、硫化钠、柠檬酸钠、氢氧化钾、氯化钙、无水乙醇、盐酸:分析纯,天津市大茂化学试剂厂;
氢氧化钠、乙二胺四乙酸二钠(EDTA):分析纯,福晨(天津)化学试剂有限公司;
络黑T:分析纯,天津市天新精细化工开发中心。
1.1.2 主要仪器设备
集热式恒温加热磁力搅拌器:DF-101S型,巩义市予华仪器有限责任公司;
高速冷冻离心机:CR22G Ⅲ型,广东广州日立工机有限公司;
电热恒温鼓风干燥箱:DHG-9245A型,上海一恒科学仪器有限公司;
真空冷冻干燥机:ST85Best型,美国Millrock公司;
紫外分光光度计:UV-1800型,日本岛津公司;
傅立叶红外光谱测定仪:VERTEX 70型,德国Bruker公司。
1.2 试验方法
1.2.1 蚕蛹多肽螯合钙的制备
蚕蛹→漂烫(2 min)→烘干(60 ℃)→粉碎、过筛(40目)→石油醚脱脂(3倍体积的石油醚浸泡蚕蛹粉,于常温振荡4 h,抽滤除去溶剂,重复3次)→酶解(调配质量分数20%的蚕蛹粉溶液,加入质量分数0.2%的Alcalase酶,55 ℃酶解4 h)→灭酶(沸水浴5 min)→离心(4 000 r/min离心15 min)取上清液→钙螯合→醇沉(加入4倍体积95%乙醇进行沉淀)→离心(4 000 r/min离心15 min)取沉淀→冷冻干燥→蚕蛹多肽螯合钙
1.2.2 蚕蛹多肽螯合钙含量、得率及螯合率的测定
(1) 钙含量测定:参照GB/T 5009.92—2016中的EDTA滴定法。
(2) 蚕蛹多肽螯合钙得率:按式(1)计算。
(1)
式中:
Y——得率,%;
m1——蚕蛹多肽螯合钙质量,g;
m2——蚕蛹多肽质量,g;
m3——氯化钙质量,g。
(3) 蚕蛹多肽螯合钙螯合率:按式(2)计算。
(2)
式中:
C——螯合率,%;
m1——螯合态钙元素含量,g;
m2——反应体系中钙元素含量,g。
1.2.3 单因素试验设计
(1) 蛋白酶的影响:选取4种蛋白酶(Alcalase酶、胰蛋白酶、复合蛋白酶、胃蛋白酶)对蚕蛹蛋白进行酶解,酶解后的蚕蛹多肽在pH 8、反应温度60 ℃、反应时间60 min、肽钙质量比1∶1的条件下进行反应,以钙含量为主要指标确定出最佳蛋白酶。
(2) pH的影响:选取Alcalase酶酶解蚕蛹蛋白,在反应温度60 ℃、反应时间60 min、肽钙质量比1∶1条件下,分别选取pH 4,6,8,10,12进行反应,以钙含量为主要指标确定出最佳pH。
(3) 反应温度的影响:选取Alcalase酶酶解蚕蛹蛋白,在pH 10、反应时间60 min、肽钙质量比1∶1条件下,分别选取反应温度30,45,60,75,90 ℃进行反应,以钙含量为主要指标确定出最佳反应温度。
(4) 反应时间的影响:选取Alcalase酶酶解蚕蛹蛋白,在pH 10、反应温度75 ℃、肽钙质量比1∶1条件下,分别选取反应时间20,40,60,80,100 min进行反应,以钙含量为主要指标确定出最佳反应时间。
(5) 肽钙质量比的影响:选取Alcalase酶酶解蚕蛹蛋白,在pH 10、反应温度75 ℃、反应时间80 min条件下,分别选取肽钙质量比10∶1,4∶1,2∶1,1∶1,1∶2进行反应,以钙含量为主要指标确定出最佳肽钙质量比。
1.2.4 响应面试验分析 在单因素试验确定的适宜反应条件基础上,按照 Box-Behnken 中心组合设计原理进一步优化反应条件。
1.2.5 蚕蛹多肽螯合钙紫外光谱分析 配制浓度为 2 mg/mL的蚕蛹多肽和蚕蛹多肽螯合钙样品,在200~400 nm的波长范围内进行紫外扫描。
1.2.6 蚕蛹多肽螯合钙红外光谱分析 分别取蚕蛹多肽和肽钙质量比为30∶1,20∶1,10∶1,5∶1的蚕蛹多肽螯合钙1 mg与100 mg干燥的 KBr 混合、研磨、压片,在 4 000~400 cm-1的范围内利用傅里叶红外光谱仪扫描出红外光谱图。
1.2.7 蚕蛹多肽螯合钙扫描电镜分析 取一定量蚕蛹多肽短肽、蚕蛹多肽螯合钙冻干粉样品抖落至样盘双面胶上,经喷金镀膜处理后放入扫描电镜抽真空,施加一定电压后,在1 000倍数下获取扫描图像。电镜扫描条件设定为高压5.00 kV;束流6.9×10-2mA;工作距离8.5 mm。
1.2.8 数据分析 试验应用 Design-expert V8.0.6 软件进行响应面设计,应用Origin 9.0软件进行紫外光谱图和红外光谱图绘制,采用 Excel 软件绘制图表,采用 SPSS 19.0 软件进行单因素方差分析,所有试验重复 3 次及以上,结果用(平均值±标准误差)表示。
2 结果与分析
2.1 单因素试验
2.1.1 蛋白酶对蚕蛹多肽螯合钙相关指标的影响 利用不同蛋白酶对蚕蛹蛋白进行酶解制备蚕蛹多肽,发现经Alcalase酶酶解的蚕蛹多肽与钙结合后制备出的多肽螯合钙中钙含量最高。这可能是由于不同蛋白酶的酶切位点不同导致,Adamson等[10]曾研究出Alcalase酶的酶切位点为Glu、Met、Leu、Tyr、Lys和Gln羧基侧的肽键,使得多肽上的羧基暴露出来,提供较多的与钙结合位点。
2.1.2 pH对蚕蛹多肽螯合钙相关指标的影响 由图2可得,蚕蛹多肽螯合钙钙含量受pH影响较大。当pH较低时,溶液中的H+含量较高,H+与Ca2+争夺供电子基团-COO-,使多肽螯合钙的量较少;当pH达到10时,OH-较多,使得-COOH的H+电离出来,有利于与钙离子的结合;若pH继续增大,过量的OH-会与Ca2+结合生成氢氧化钙沉淀,从而使蚕蛹多肽螯合钙量下降。因此,在响应面设计时,将pH因素的中心试验点选在pH 10。
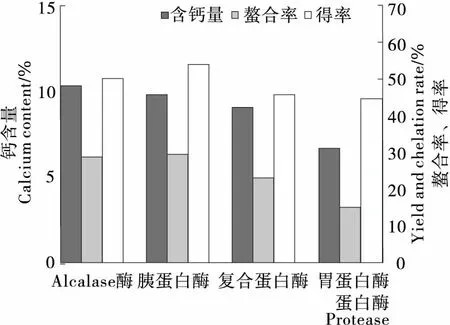
图1 蛋白酶对钙含量、螯合率、得率的影响Figure 1 Effect of protease on calcium content, yield and chelation rate

图2 pH值对钙含量、螯合率、得率的影响Figure 2 Effect of pH on calcium content, yield and chelation rate
2.1.3 反应温度对蚕蛹多肽螯合钙相关指标的影响 由图3可以看出,反应温度从30 ℃升高至90 ℃过程中,蚕蛹多肽螯合钙的钙含量呈现先上升后平稳的趋势,在75 ℃ 达到最大值。反应温度越高,分子间运动越剧烈,使得分子间碰撞的几率增大,有利于发生结合反应,当碰撞几率达到一定程度,蚕蛹多肽与钙结合反应达到最大。温度继续升高时,结合率反而下降,可能是高温破坏了多肽分子的结构,其构象发生变化影响了与钙的结合。因此,在响应面设计时将温度因素的中心试验点选在75 ℃。
2.1.4 反应时间对蚕蛹多肽螯合钙相关指标的影响 由图4可知,从反应20 min延长至反应100 min,蚕蛹肽螯合钙中钙含量变化较小,但在80 min时,螯合率和得率均达到最大值,因此选择80 min作为蚕蛹肽螯合钙的反应时间,响应面试验中不再研究反应时间对蚕蛹多肽与钙离子结合反应的影响。
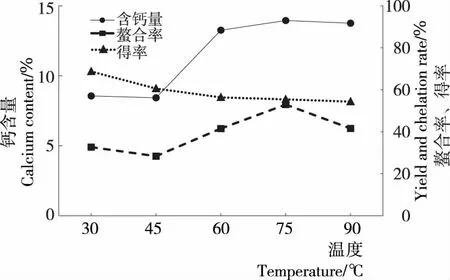
图3 温度对钙含量、螯合率、得率的影响Figure 3 Effect of temperature on calcium content,yield and chelation rate

图4 反应时间对钙含量、螯合率、得率的影响Figure 4 Effect of time on calcium content,yield and chelation rate
2.1.5 肽钙质量比对蚕蛹多肽螯合钙相关指标的影响
由图5可见,肽钙质量比对蚕蛹多肽螯合钙中的钙含量有较大影响,随着肽钙质量比的增加,钙含量呈先上升后下降的趋势,在肽钙质量比为4∶1时钙含量、得率达到最大值。若肽钙质量比过大,则氯化钙添加不足,结合反应不完全,造成效率较低;若肽钙质量比过小,则氯化钙添加过量,多肽上的钙结合位点已饱和,造成钙浪费。因此,在响应面设计时将肽钙质量比因素的中心试验点选在4∶1。

图5 肽钙质量比对钙含量、螯合率、得率的影响Figure 5 Effect of peptide calcium ratio on calcium content, yield and chelation rate
2.2 响应面试验设计结果及分析
根据单因素试验结果,按照Box-Behnken中心组合设计原理对蚕蛹多肽螯合钙制备条件进一步优化,以pH 10、温度75 ℃、肽钙质量比4∶1为零点进行响应面设计。响应面编码设计见表 1。
2.2.1 响应面试验方案及结果 根据响应面设计确定响应面试验方案如表2所示。选用 Box-Behnken 模型对pH、温度、肽钙质量比3个因素结果进行多元线性回归拟合,得到3个因素关于钙含量的二次多项回归方程模型为:
R=14.48+0.13A-1.14B-0.80C-1.33AB-1.36AC+1.15BC-3.67A2-3.36B2-2.12C2。
(3)

表1 中心组合实验因素水平编码表Table 1 Center combination of experimental factors level coding table
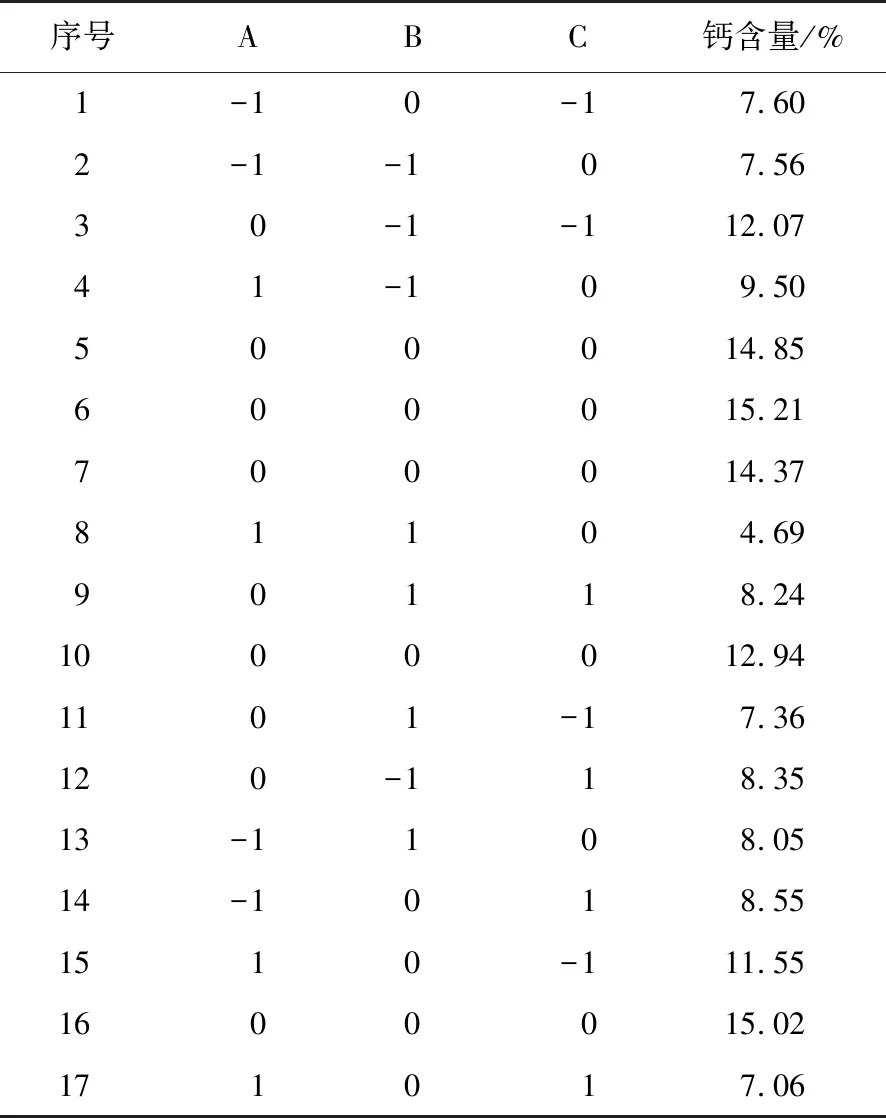
表2 响应面分析方案及试验结果Table 2 Response surface analysis scheme and test results

在设定的因素水平内对回归方程进行数学运算,得出的反应最佳条件为pH 10.12、温度72.57 ℃、肽钙质量比为3.41∶1,钙含量最高理论值为14.740 5%。为方便试验进行,调整反应条件为pH 10、温度73 ℃、肽钙质量比3.4∶1,在此条件下进行3次实验验证,得到的蚕蛹多肽螯合钙中平均钙含量为14.51%,与预测值接近。

表3 响应面回归模型方差分析Table 3 Responsesurface regression model variance analysis

图6 响应面优化图Figure 6 Response surface optimization map
蚕蛹是蚕茧抽丝后剩下的主要副产物,本研究开发的蚕蛹多肽螯合钙中钙含量为14.51%,与已报道的多种肽螯合钙如羊骨胶原多肽螯合钙[11]、大豆肽螯合钙[12]、豆粕多肽螯合钙相比[13],钙含量显著提高,具有较高的研究和生产价值。
2.3 紫外光谱分析
如图7所示,通过蚕蛹多肽以及蚕蛹多肽螯合钙进行紫外光谱扫描对比,发现蚕蛹多肽与钙结合后,在280~300 nm的最大吸收峰值发生红移,由288 nm移动至290 nm,且吸光度发生变化,表明有金属螯合物生成,与多肽螯合物的相关报道[14-15]一致。
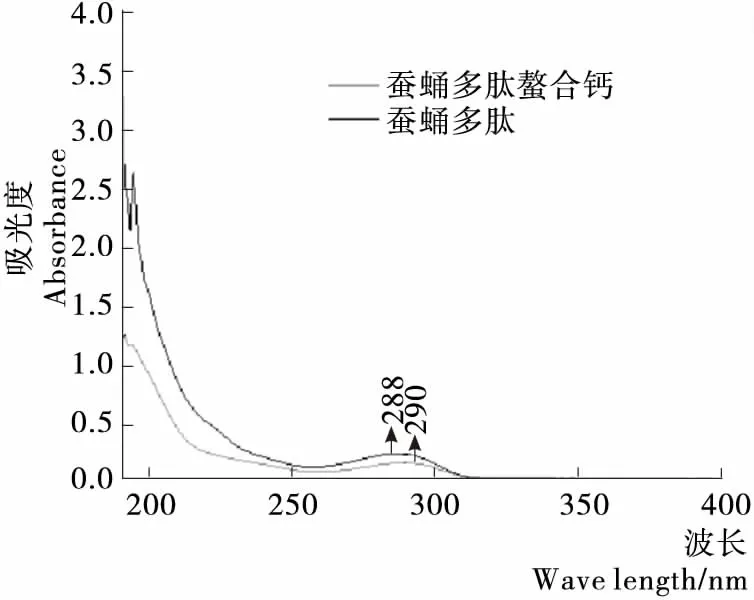
图7 紫外光谱图Figure 7 Ultraviolet spectrum
2.4 红外光谱分析
蚕蛹多肽分子中含有羧基、羟基、氨基等基团,为进一步确定参与钙结合的基团和先后顺序,试验研究了不同肽钙比制备出的蚕蛹多肽螯合钙的红外光谱特征,如图8所示,随着钙源的增加,蚕蛹肽螯合钙红外结构有显著差异。蚕蛹多肽与钙反应后,在3 278.55,2 102.46,1 450.55,1 398.83,923.24 cm-15个吸收峰发生了明显的变化。其中3 278.55 cm-1附近为N—H伸缩振动特征区,多肽螯合钙变为3 379.73 cm-1,可能是由于NH2与Ca2+配位引起NH拉伸和氢键被取代,随着钙含量的提高,该峰强度不断增强,说明氨基在不断与Ca2+配位。2 102.46 cm-1是亚磷酸基团缔结氢键形成的吸收峰,此峰在添加钙量很小的情况下便消失,是由于蚕蛹多肽与钙结合后亚磷酸基团缔结的氢键被Ca2+取代[16],推测亚磷酸基团优先参与肽钙反应。添加Ca2+后,对应于C═O 的波数从1 655.00 cm-1发生了蓝移,随着Ca2+的增加,当肽钙质量比达到5∶1时,在这附近生成一个新的吸收峰即1 598.80 cm-1处,主要是由于钙含量增大使得羧酸与钙反应生成羧酸盐。在1 398.83 cm-1处观察到的吸收峰发生了红移,归因于—COO—羧酸酯基团的延伸与Ca2+结合形成COOCa[17]。羧基中—OH的面内振动吸收峰1 450.55 cm-1及面外振动吸收峰923.24 cm-1与钙结合后消失,说明羧基中—OH参与肽钙结合[18]。因此,氨基、羧基、磷酸基团参与了蚕蛹多肽与钙的结合,其结合模式推测如图9所示。
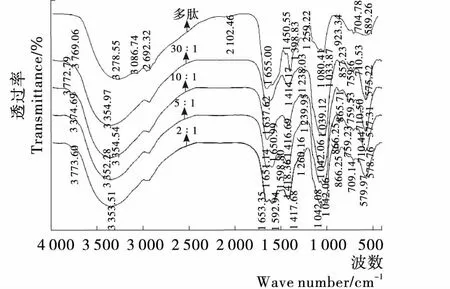
图8 不同肽钙比制备的蚕蛹多肽螯合钙红外光谱图
Figure 8 Infrared spectrum of chelated calcium of silkworm pupapolypeptide prepared by different peptide to calcium ratio

图9 肽钙结合模式Figure 9 Peptide calcium binding mode
2.5 扫描电镜分析
由图10可看出,蚕蛹多肽表面光滑,结构紧实;反应后,蚕蛹多肽螯合钙表面变为疏松多孔结构,有利于溶解吸收。

图10 蚕蛹多肽与蚕蛹多肽螯合钙扫描电镜图片
Figure 10 Silkworm pupa protein peptides and silkworm pupa protein peptides binding calcium SEM pictures
3 结论
以蚕蛹为原料制备了蚕蛹多肽螯合钙,通过响应面优化法确定了制备的最优条件为pH 10、反应温度73 ℃、肽钙质量比3.4∶1、反应时间80 min,在此条件下,得到的蚕蛹肽螯合钙中钙含量可达到14.51%,具有较高的研究和生产价值。通过紫外光谱、红外光谱、扫描电镜分析可知,蚕蛹多肽与钙结合后结构发生了变化,多肽中氨基、羧基、磷酸基团参与肽钙结合反应。同时探究了多肽随钙源添加的结构变化规律,发现磷酸基团极易参与肽钙螯合反应。虽然蚕蛹本身具有产量大、氨基酸配比良好等优势,开发出的蚕蛹多肽螯合钙钙含量高,成本较低,但其生物利用率及安全性还有待通过细胞试验和动物试验进一步研究。
