原花青素减轻TCP磨损颗粒诱导的骨细胞氧化损伤*
2019-09-23金晶晶楼佳琪陈晓斌杨子键黄君瑶
金晶晶, 楼佳琪, 王 脉, 陈晓斌, 杨子键, 黄君瑶, 张 云
(绍兴文理学院医学院, 浙江 绍兴 312000)
新近假体翻修术回顾性研究发现,关节假体植入体内后,经过长期磨损、碰撞产生大量的聚乙烯(polyethylene,PE)、金属钛(titanium,Ti)和陶瓷磷酸三钙(tricalcium phosphate,TCP)等磨损颗粒,这些颗粒可激活假体周围巨噬细胞、成纤维细胞和成骨细胞等组织细胞释放炎症因子,后者诱导破骨细胞分化和存活,导致假体周围骨溶解及关节假体松动[1-2]。假体周围除了含有上述组织细胞外,还存在着丰富的骨细胞,其数量占骨组织细胞的90%~95%。以往研究和我们前期实验结果表明磨损颗粒可诱导骨细胞氧化损伤[3-5],释放白细胞介素(interleukin,IL)-1β和IL-18等促炎症因子,促进假体周围骨溶解,且抗氧化剂N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC)可明显阻止TCP磨损颗粒诱导的骨细胞死亡[6],表明氧化应激在磨损颗粒诱导的骨细胞损伤中发挥重要作用。因此,抑制氧化应激可减少磨损颗粒诱导的骨细胞损伤及假体周围骨溶解。
原花青素(procyanidins,PC)是从葡萄皮、葡萄籽和绿茶等植物中提取分离出的一种天然多酚类化合物,具有极强的抗氧化活性,可清除活性氧和自由基,抑制体内氧自由基的生成及脂质过氧化反应[7-9]。邵玲巧等[10]报道原花青素可清除H2O2诱导的活性氧簇(reactive oxygen species,ROS)产生,抑制成骨细胞氧化损伤而发挥抗骨质疏松作用。但是,对于原花青素对磨损颗粒诱导的骨细胞氧化损伤的影响如何,目前尚不明确。本研究在TCP磨损颗粒诱导骨细胞MLO-Y4的氧化损伤基础上,研究原花青素对TCP磨损颗粒诱导的骨细胞氧化损伤的影响,并阐明其可能作用机制,为原花青素用于防治假体周围骨溶解和关节松动提供实验依据。
材 料 和 方 法
1 主要试剂
TCP磨损颗粒由浙江大学化学系馈赠;鲎试剂购自上海吴昊经贸有限公司;原花青素购自上海源叶生物科技有限公司;α-MEM培养基、胎牛血清(fetal bovine serum,FBS)和小牛血清(calf serum,CS)购自Gibco;Annexin-V/PI凋亡检测试剂盒、IL-1β ELISA试剂盒及超敏ECL化学发光检测试剂盒购自杭州联科生物技术有限公司;Calcein-AM活体分子探针、MTT、RIPA裂解液、超氧化物歧化酶 (super-oxide dismutase,SOD)活性检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒和乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒购自上海碧云天生物试剂有限公司;兔抗NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)抗体、抗含CARD的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)抗体、抗IL-1β抗体、抗cleaved caspase-1抗体和小鼠抗β-actin抗体购自Cell Signaling Technology;PVDF膜购自Millipore。
2 细胞株
小鼠长骨骨细胞MLO-Y4由美国密苏里大学口腔学院Bonewald教授馈赠。MLO-Y4细胞置于含2.5% FBS和 2.5% CS的高α-MEM培养基中,37 ℃、5% CO2及饱和湿度下进行常规培养。
3 主要方法
3.1骨细胞MLO-Y4的培养 MLO-Y4加入含2.5%FBS和2.5%CS的α-MEM培养基中进行常规培养,取对数生长期细胞进行消化传代用于以下实验。
3.2Calcein-AM染色 骨细胞(每孔5×103)接种于打孔皿中常规培养24 h,采用原花青素(10 μmol/L和50 μmol/L)预孵育4 h后,加入TCP颗粒(0.1 g/L)分别继续孵育48 h。去除上清液后与活体分子探针Calcein-AM(5 μmol/L)孵育30 min,清洗后加入PBS置于激光共聚焦下观察骨细胞形态的变化。
3.3MTT法检测细胞活力 骨细胞(每孔5×103)接种于96孔培养板中常规培养24 h,采用原花青素(10 μmol/L和50 μmol/L)预孵育4 h后,加入TCP颗粒(0.1 g/L)分别继续孵育48 h。然后加入MTT(5 g/L)温室避光孵育4 h;弃上清液后,加入二甲基亚砜(DMSO,200 μL)溶解甲臜;充分振摇后,置于酶标仪测定A490和A690,计算骨细胞活力的变化。
3.4流式细胞术检测细胞凋亡 骨细胞(每孔3×104)接种于24孔培养板常规培养24 h,采用原花青素(10 μmol/L和50 μmol/L)预孵育4 h后,加入TCP颗粒(0.1 g/L)分别继续孵育48 h。通过消化获取骨细胞,经1 000 r/min离心10 min去除培养基,PBS清洗2次。 然后加入5 μL annexin V-FITC,10 μL PI,轻轻混匀,黑暗中室温37 ℃温育15 min。最后加入200 μL PBS并混匀,上流式细胞仪检测细胞凋亡。FITC的激发波长为488 nm, 检测发射波长575 nm(Ex: 488 nm,Em: 575 nm)。
3.5ELISA法检测细胞培养上清中牙本质基质蛋白1(dentin matrix protein 1,DMP-1)、骨硬化蛋白(sclerostin,SOST)和IL-1β的水平 骨细胞(每孔3×104)接种于24孔培养板中常规培养24 h,采用原花青素(10 μmol/L和50 μmol/L)预孵育4 h后,加入TCP颗粒(0.1 g/L)分别继续孵育48 h。取上清液利用DMP-1、SOST和IL-1β等ELISA试剂盒检测细胞培养上清液中DMP-1、SOST和IL-1β水平。
3.6化学比色法检测细胞中MDA含量和SOD活性及上清液中LDH的水平 骨细胞(每孔1.5×105)接种于6孔培养板中常规培养24 h,采用原花青素(10 μmol/L和50 μmol/L)预孵育4 h后,加入TCP颗粒(0.1 g/L)分别继续孵育48 h,收集细胞和上清液。利用MDA、SOD和LDH试剂盒检测骨细胞中MDA含量和SOD活性以及上清液中LDH水平的变化。
3.7Western blot检测蛋白表达[11]骨细胞蛋白提取液加入上样缓冲液后煮沸10 min,冷却后每孔上样30 μg蛋白,行12%SDS-PAGE分离蛋白,电泳完成后将蛋白转移到PVDF膜上,经5%脱脂牛奶常温封闭2 h后,分别加入兔抗NLRP3抗体(1∶1 000)、兔抗ASC抗体(1∶1 000)、兔抗IL-1β抗体(1∶1 000)、兔抗cleaved caspase-1抗体(1∶1 000)和小鼠抗β-actin抗体(1∶1 000)4 ℃孵育过夜。次日用TBST洗涤3次后加入HRP标记的 II 抗室温孵育2 h,TBST清洗3次加入ECL显色液;通过凝胶成像系统扫描分析各蛋白变化。
4 统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q法分析。以P<0.05为差异有统计学意义。
结 果
1 PC对TCP磨损颗粒诱导的MLO-Y4细胞损伤的影响
Calcein-AM染色、MTT分析和ELISA结果显示,与control组比较,TCP组MLO-Y4细胞受损显著,表现为细胞的活力显著降低(P<0.05),细胞培养上清液中骨细胞特征蛋白DMP-1水平减少,SOST水平增加,造成DMP-1/SOST显著降低(P<0.05);与TCP组比较,PC(10 μmol/L 和 50 μmol/L)组骨细胞活力明显升高,上清液中DMP-1水平明显增加,SOST水平减少,DMP-1/SOST明显升高(P<0.05),见图1、2。
Figure 1.The effect of PC on the decreased MLO-Y4 cell viability caused by TCP wear particles. A: calcein-AM staining (scale bars=20 μm); B: MTT assay. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsTCP group.
图1 PC对TCP磨损颗粒诱导的MLO-Y4细胞活力降低的影响
2 PC对TCP磨损颗粒诱导的MLO-Y4细胞凋亡的影响
Annexin-V/PI染色经流式细胞术定量检测结果显示,与control组比较,TCP组MLO-Y4细胞发生明显凋亡,凋亡率为control组的7.60倍(P<0.05);与TCP组比较,PC组骨细胞凋亡显著减少,其凋亡率分别减少为TCP组的74.15%(10 μmol/L)和24.08%(50 μmol/L)(P<0.05),见图3。
3 PC对TCP磨损颗粒诱导的MLO-Y4细胞氧化应激的影响
与control组比较,TCP组骨细胞发生氧化应激,表现为骨细胞中MDA含量明显增加,SOD活性显著降低(P<0.05);与TCP组比较,PC组骨细胞中MDA显著降低,SOD活性明显增加(P<0.05),见图4。
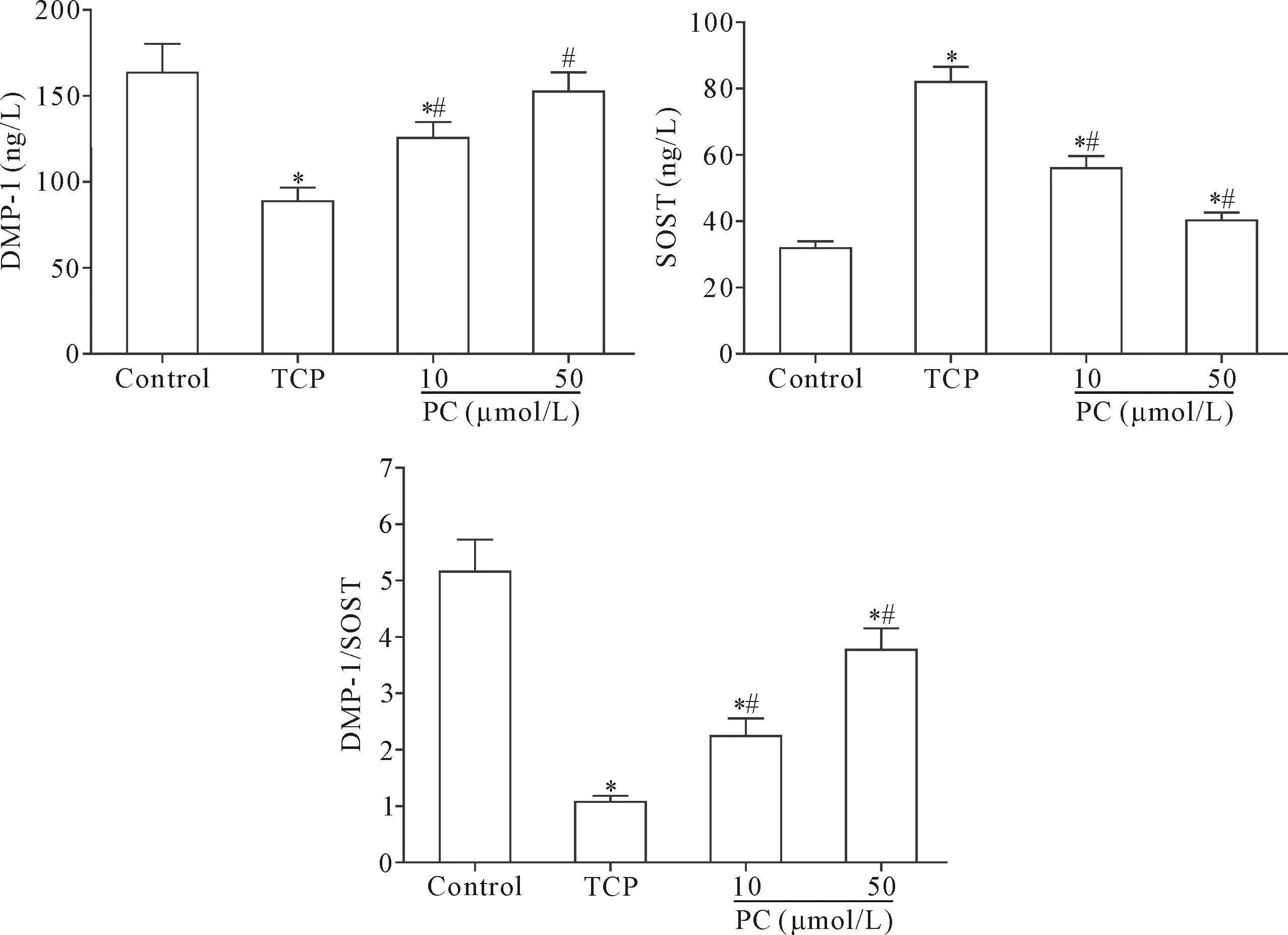
Figure 2.The effect of PC on dysfunction of the MLO-Y4 cells induced by TCP wear particles. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTCP group.
图2 PC对TCP磨损颗粒诱导的MLO-Y4细胞功能损伤影响
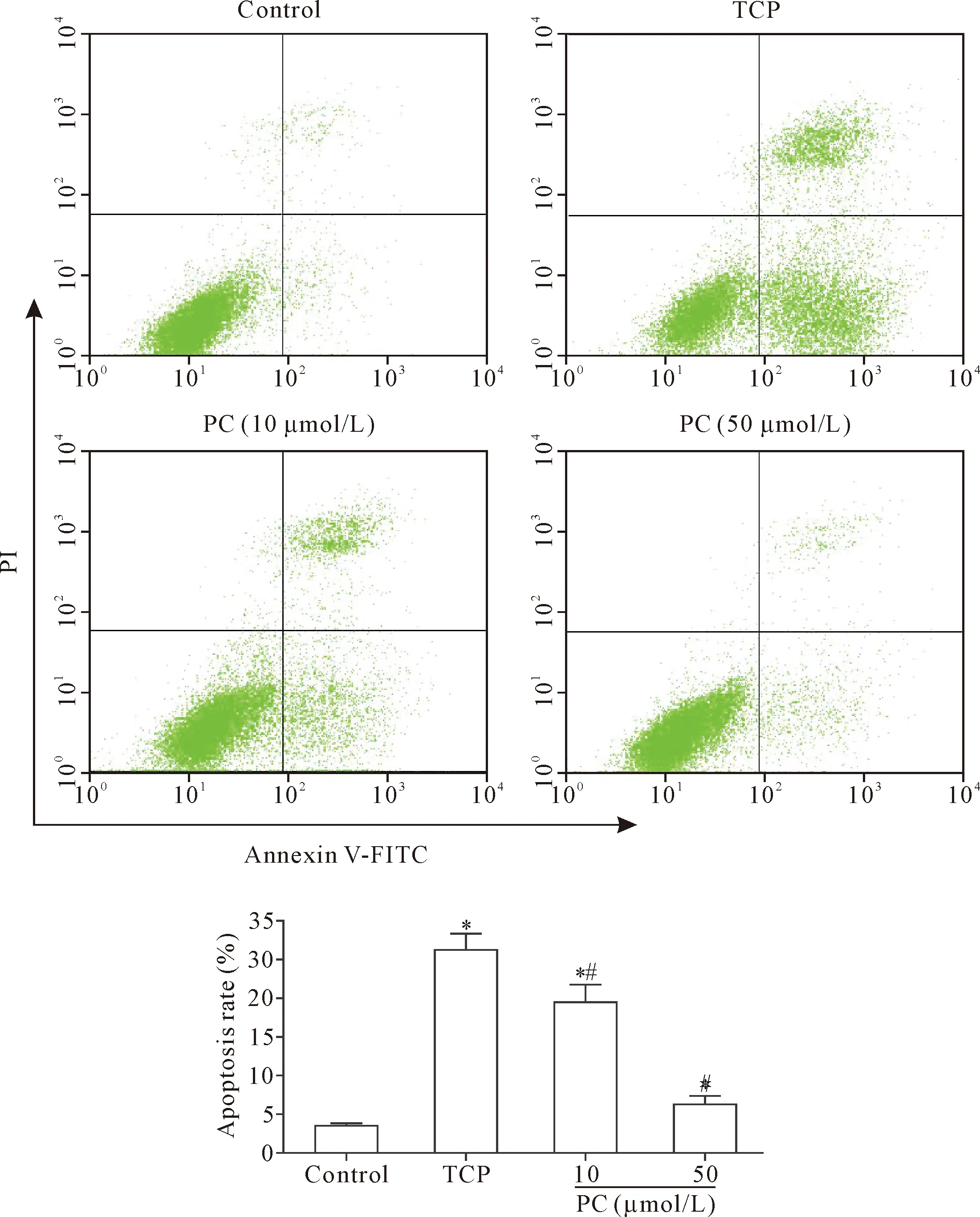
Figure 3.The effect of PC on the apoptosis of MLO-Y4 cells induced by TCP wear particles. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsTCP group.
图3 PC对TCP磨损颗粒诱导的MLO-Y4细胞凋亡的影响
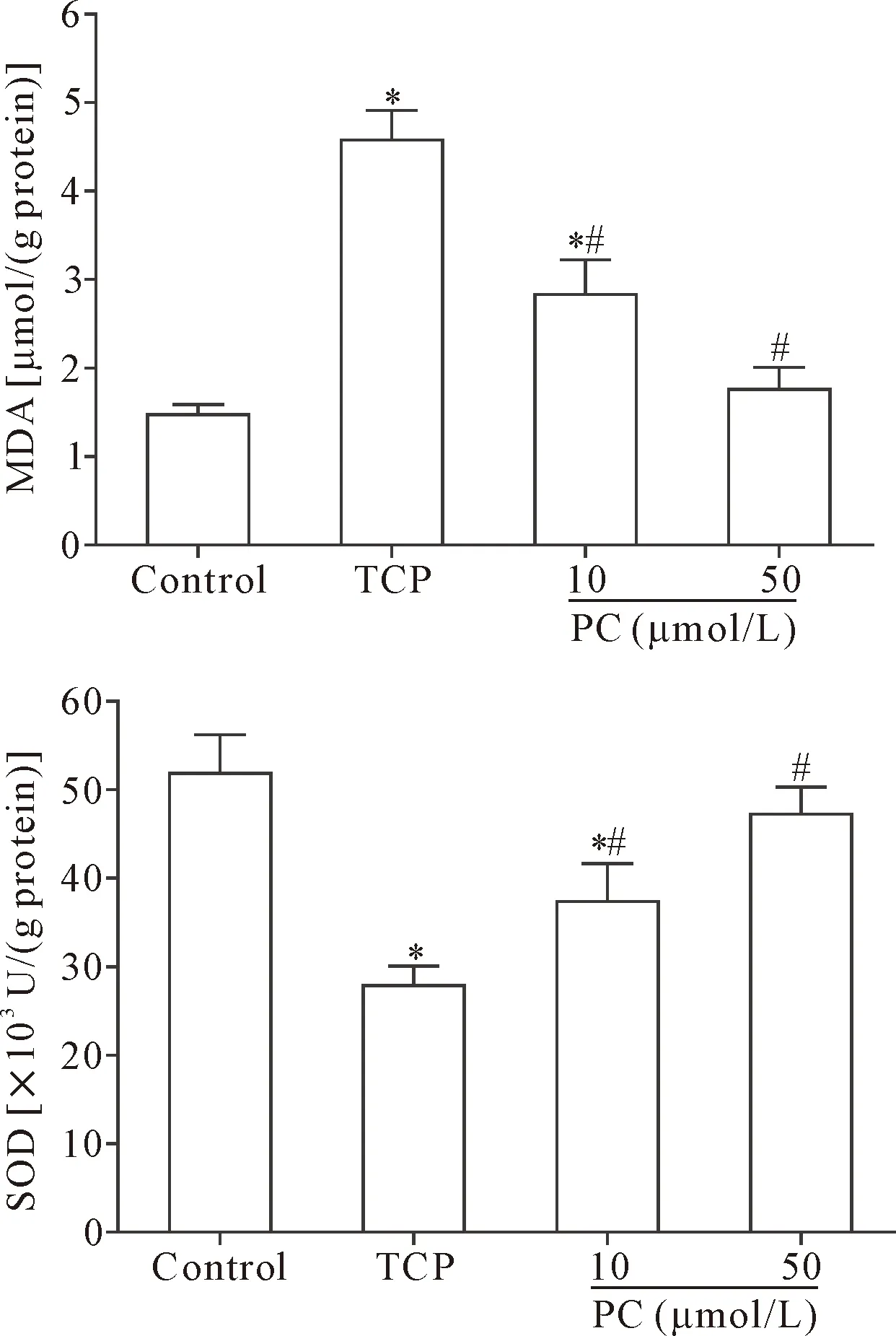
Figure 4.The effect of PC on oxidative stress in MLO-Y4 cells induced by TCP wear particles. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTCP group.
图4 PC对TCP磨损颗粒诱导的MLO-Y4细胞氧化应激的影响
4 PC对TCP磨损颗粒诱导的MLO-Y4细胞炎症小体活化的影响
Western blot检测结果显示,与control组比较,TCP组骨细胞中炎症小体活化,表现为炎症小体成分蛋白NLRP3和ASC表达均明显上调(P<0.05);与TCP组比较,PC组骨细胞中NLRP3和ASC表达显著降低(P<0.05),且高剂量(50 μmol/L)的PC抑制骨细胞中炎症小体活化效果更强,见图5。
5 PC对TCP磨损颗粒诱导的MLO-Y4细胞焦亡的影响
与control组比较,TCP组骨细胞中细胞焦亡标志蛋白cleaved caspase-1和成熟IL-1β的表达明显升高,且上清液中IL-1β水平及LDH释放也显著增加(P<0.05);与TCP组比较,PC剂量依赖性地抑制cleaved caspase-1和IL-1β的激活,且高剂量(50 μmol/L)的PC抑制骨细胞焦亡作用较强,见图6。
讨 论
以往研究和本实验结果显示TCP磨损颗粒可诱导骨细胞MLO-Y4氧化损伤,主要表现为骨细胞活性显著降低、细胞凋亡显著,MDA和ROS水平显著增加,SOD活性明显减少,且抗氧化剂NAC能明显抑制上述骨细胞死亡[6]。原花青素是一种很强的自由基清除剂和脂质过氧化抑制剂,其抗氧化作用远远强于维生素C和维生素E[7-9],目前主要应用于抗氧化、抗炎、抗肿瘤和降血糖等方面的治疗。本研究结果表明原花青素可明显抑制TCP磨损颗粒诱导的MLO-Y4细胞氧化应激反应,减少MDA含量、增加SOD活性,减轻细胞氧化损伤,其机制可能是原花青素结构中的多个酚羟基在体内被氧化释放H+,竞争性与MLO-Y4细胞中自由基及氧化产物结合,保护脂质不被氧化,阻断自由基链式反应,减弱氧化应激反应[12]。
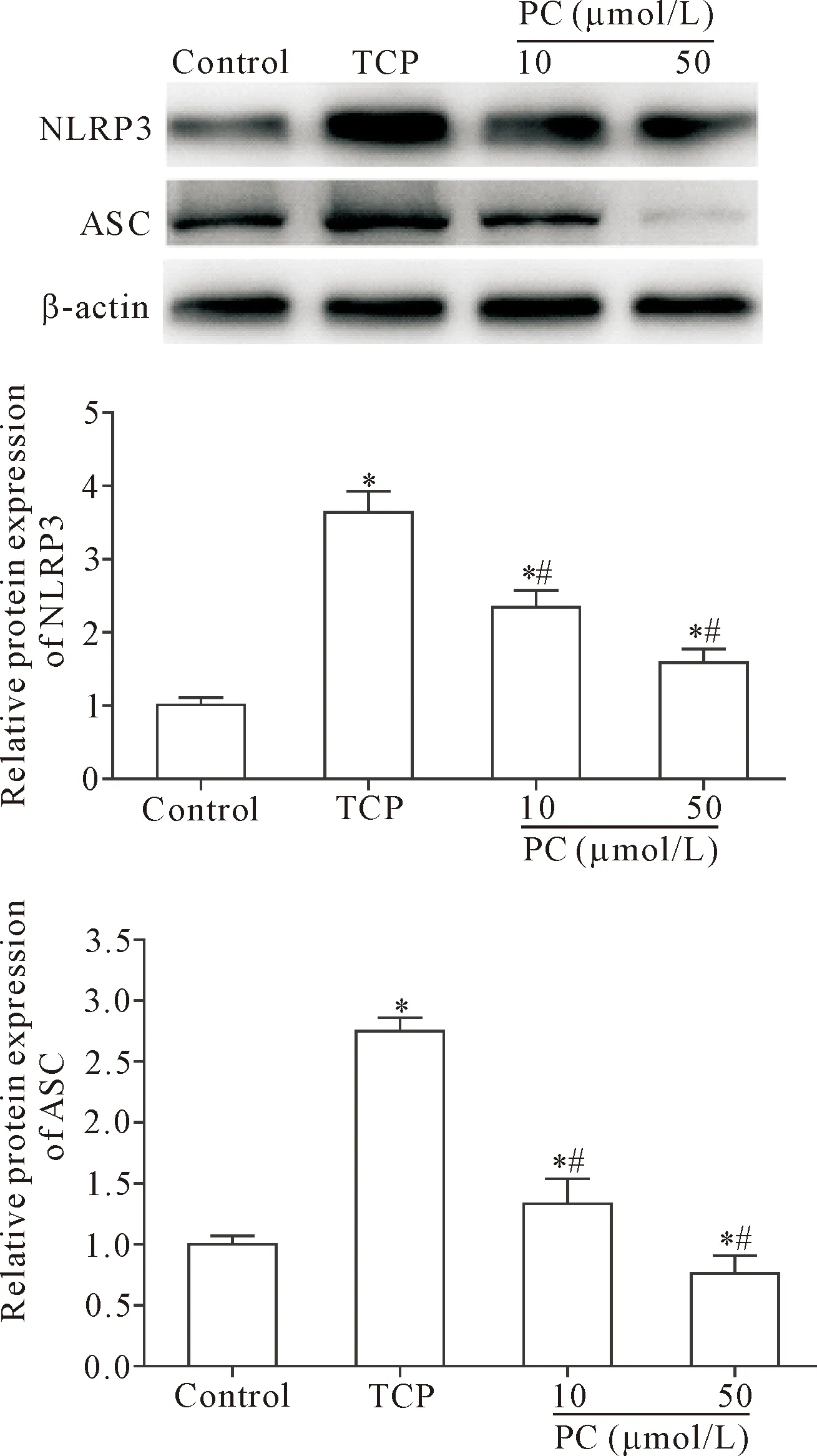
Figure 5.The effect of PC on inflammasome activation in MLO-Y4 cells induced by TCP wear particles. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTCP group.
图5 PC对TCP磨损颗粒诱导的MLO-Y4细胞炎症小体活化的影响
众多研究证实ROS或氧化应激参与NLRP3炎症小体的激活过程。NLRP3炎症小体的激活因子细菌脂多糖可诱导ROS的生成,进一步活化氧化还原依赖的转录因子NF-κB和AP-1并促进IL-1β和IL-18的产生[13]。同时,体内研究结果显示caspase-1激活和IL-1β合成以及细胞焦亡的发生也依赖于ROS产生[14]。NLRP3炎症小体是位于细胞内的一种蛋白复合物,它包括NLRP3、ASC和caspase-1。NLRP3炎症小体被激活后通过接头蛋白ASC,募集半胱天冬氨酸蛋白酶1前体,进而自我催化加工形成cleaved caspase-1;活化的caspase-1能切割 IL-1β前体使其形成成熟的IL-1β并分泌至胞外,诱导细胞焦亡[15-16]。本研究中TCP磨损颗粒诱导MLO-Y4细胞发生氧化损伤后,细胞形态发生收缩、变圆、排列紊乱、细胞膜破裂等现象,与DiPeso等[17]所报道的细胞焦亡性死亡形态基本相似;同时细胞中NLRP3、ASC、cleaved caspase-1等蛋白表达显著上调,下游IL-1β、蛋白表达以及LDH释放水平也明显增加,表明TCP磨损颗粒可诱导MLO-Y4细胞中炎症小体活化和细胞焦亡,这与骨细胞的氧化损伤趋势基本一致。
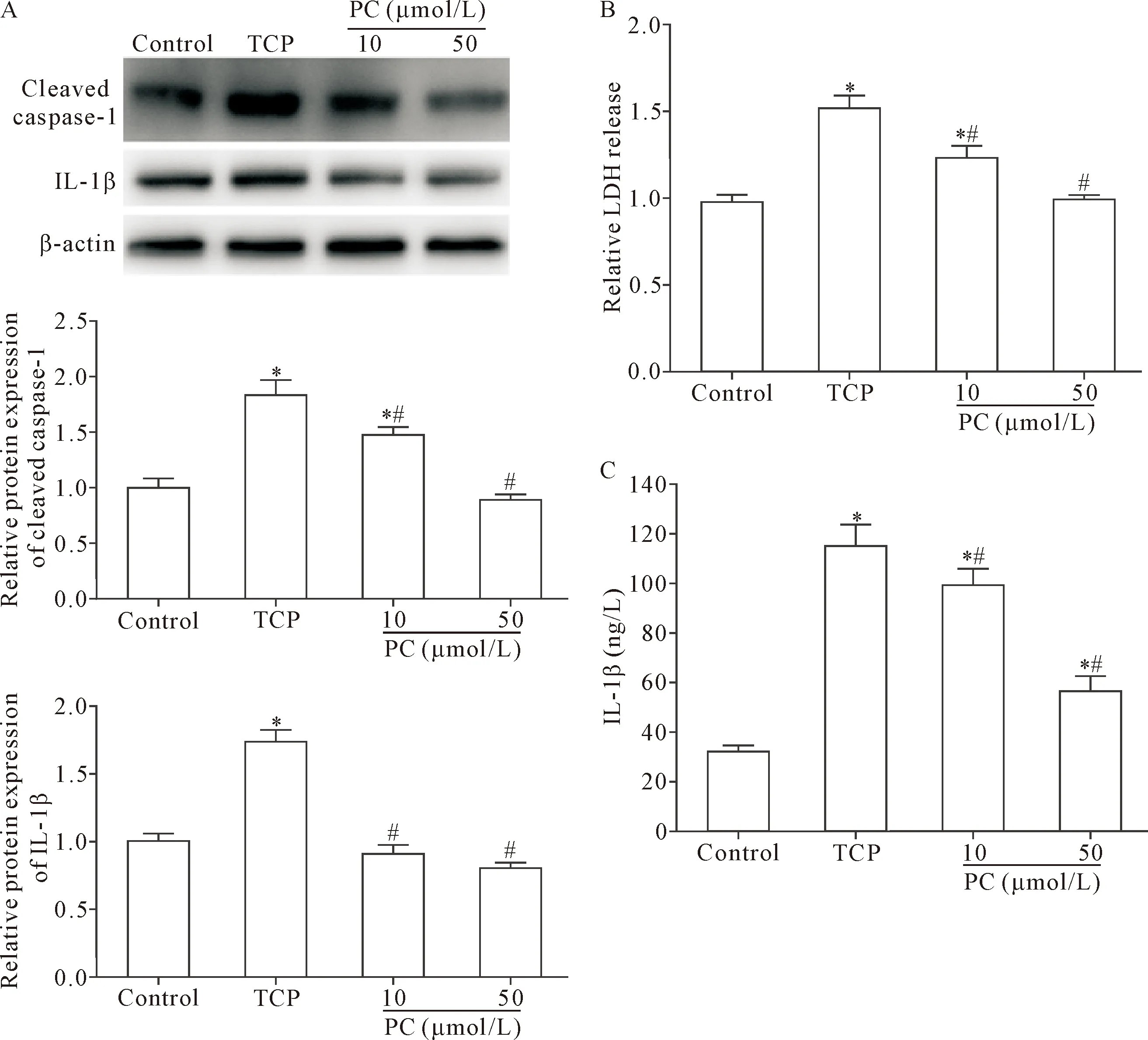
Figure 6.The effect of PC on pyroptosis of MLO-Y4 cells induced by TCP wear particles. A: the protein expression levels of cleaved caspase-1 and IL-1β were detected by Western blot; B: the LDH release was detected by chemical colorimetry; C: the level of IL-1β in the culture media was examined by ELISA. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTCP group.
图6 PC对TCP磨损颗粒诱导的MLO-Y4细胞焦亡的影响
有证据显示ROS的清除剂或抑制剂能阻止NLRP3炎症小体的活化[18-19]。Wang等[20]发现原花青素抑制NLRP3炎症小体的活化与ROS/AP-1 通路被抑制密切相关。另有研究表明原花青素可明显阻止阿尔茨海默病(Alzheimer disease,AD)大鼠脑组织中NLRP3炎症小体活化,减少海马和皮质中促炎症因子IL-1β和IL-6的释放,延缓AD进程[21]。与之类似,本实验结果显示原花青素可明显减弱TCP磨损颗粒诱导的MLO-Y4细胞中NLRP3炎症小体的活化及细胞焦亡的发生,抑制骨细胞损伤。
综上所述,原花青素可通过抑制TCP磨损颗粒诱导的NLRP3炎症小体活化和细胞焦亡而减轻骨细胞氧化损伤。因此,原花青素有望成为防治假体周围骨细胞损伤及骨溶解的一种潜在药物。
