小鼠骨骼肌细胞离体胰岛素抵抗模型的建立和验证*
2019-09-23王博发
罗 维, 艾 磊, 李 显, 王博发, 周 越△
(1北京体育大学运动生理学教研室, 北京 100084; 2南京体育学院运动健康科学系, 江苏 南京 210014;3江苏省体育科学研究所, 江苏 南京 210033)
国际糖尿病联盟数据显示,2017年全球糖尿病患者人数达4.25亿,预计2045年将达6.29亿,每6秒就有1位患者因糖尿病死亡,其中大部分患者为2型糖尿病[1-2]。胰岛素抵抗是2型糖尿病的最主要病理特征,其不仅贯穿于2型糖尿病发生发展的全过程,还是心脑血管疾病、乳腺癌和阿尔兹海默症等疾病的共同病理基础[3-6]。胰岛素抵抗是指单位浓度的胰岛素细胞效应减弱,其实质为胰岛素激活的葡萄糖转运及靶细胞的糖代谢降低,在分子水平是胰岛素信号转导受损的结果[7]。
目前,防治胰岛素抵抗的基础研究仍以动物模型为主,但其缺点是实验周期长,需要投入较大人力和物力[8],而从细胞和分子水平进行深入研究有助于更好地探索胰岛素抵抗发生发展的分子机制,是进行胰岛素抵抗和相关疾病病理机制探索及药物研发的重要途径[9-10]。构建稳定的胰岛素抵抗离体细胞模型有利于直观快捷地探讨胰岛素抵抗的发病机理并进行相关药物筛选[11]。
骨骼肌是胰岛素作用的靶器官,胰岛素刺激下人体80%以上的葡萄糖摄取在骨骼肌中完成[12-13],因此骨骼肌为胰岛素抵抗发生的主要部位。C2C12细胞是由C3H小鼠骨骼肌卫星细胞永生化而来的细胞株,因其形态特性均一,且可无限代培养,是体外研究骨骼肌胰岛素抵抗发病机制和降糖药物作用机制的理想细胞模型[14]。鉴于目前关于建立C2C12细胞胰岛素抵抗模型的研究报道实验条件不一,方法各异,且胰岛素抵抗效果不稳定[15],本课题组在离体胰岛素抵抗模型建立中进行了较长时间的研究,通过采用不同浓度葡萄糖干预C2C12细胞不同时长,实时收集细胞检测其基础和胰岛素刺激下的荧光标记葡萄糖2-NBDG摄取水平及胰岛素信号通路相关蛋白的表达水平,探索高糖刺激与C2C12细胞胰岛素抵抗之间的量效关系,期望构建稳定可重复的离体骨骼肌细胞胰岛素抵抗模型,促进胰岛素抵抗和相关疾病的病理机制探索及相关药物研发与筛选,进而推进胰岛素抵抗等慢性疾病的防治研究。
材 料 和 方 法
1 实验对象及分组
小鼠骨骼肌成肌细胞C2C12购自北京协和细胞库。C2C12细胞传代到足够细胞量后统一冻存,选取同一代细胞作为实验对象。于1 mL无糖分化液中分别溶入7.2 mg和10.8 mg D-葡萄糖(Aladdin,G116307)配制葡萄糖浓度为40 mmol/L和60 mmol/L的分化液,正常分化液中葡萄糖浓度为25 mmol/L。
待C2C12细胞密度达到70%~90%时随机分为对照(control)组、40 mmol/L葡萄糖(40)组和60 mmol/L葡萄糖(60)组,诱导分化,其中,对照组分化液中葡萄糖浓度为25 mmol/L,40组分化液中葡萄糖浓度为40 mmol/L,60组分化液中葡萄糖浓度为60 mmol/L,每组设置48个复孔,分别在诱导分化1、3、5和7 d后收集细胞进行相关检测,收集细胞时每组12个复孔,再于组内随机分为胰岛素组和PBS组,分别加入200 nmol/L胰岛素和等量PBS,继续孵育30 min后收集细胞,检测不同浓度葡萄糖干预不同时长对骨骼肌细胞胰岛素敏感性的影响。
2 主要试剂
无糖DMEM培养基和胎牛血清(fetal bovine serum, FBS,Gibco);马血清(horse serum,HS, HyClone);葡萄糖转运探针2-NBDG(江苏凯基生物技术有限公司);细胞培养用胰岛素(上海碧云天生物技术有限公司);抗葡萄糖转运子4(glucose transporter 4, GLUT4)抗体(Abcam);抗β-actin抗体(北京中山金桥生物技术有限公司)。
3 主要方法
3.1小鼠骨骼肌C2C12细胞的生长与分化培养 C2C12细胞采用细胞生长液(25 mmol/L 葡萄糖、DMEM培养基、10% FBS、青霉素和链霉素各100 mg/L),于5% CO2、37 ℃细胞孵育箱中孵育,依细胞生长状态1~2 d传代1次。实验用细胞以每皿1.0×106个的密度接种于35 mm培养皿或以每孔4×105个的密度接种于24孔培养板,待细胞生长至70%~90%融合度时,按方法1中分组方式随机分为3组,将生长液更换为分化液(DMEM培养基、2% HS、青霉素和链霉素各100 mg/L),诱导分化,隔24 h更换分化液。每天在相差显微镜下观察多核肌管形成并采集图像。
3.22-NBDG法检测不同干预对C2C12细胞基础糖摄取和胰岛素刺激糖摄取的影响 2-脱氧葡萄糖(2-deoxy-D-glucose,2-DG)是天然D-葡萄糖衍生物,通过葡萄糖转运体进入细胞,2-DG第2位氧原子被荧光基团NBD取代形成2-DG的荧光类似物, 即2-NBDG。2-NBDG激发波长为460 nm, 发射波长为540 nm, 能够被荧光酶标仪探测。C2C12细胞接种于24孔培养板,按方法3.1中实验条件处理后,分别用不同浓度葡萄糖干预1、3、5和7 d 后收集细胞进行检测。收集细胞后常温PBS洗1次,每孔加入1 mL含2%牛血清白蛋白的无糖DMEM培养基,孵育3 h后再组内随机分为胰岛素组和PBS组,分别用胰岛素或PBS干预30 min,避光条件下每孔加入3 μL 2-NBDG,孵育30 min,预冷PBS洗2遍,以荧光酶标仪读数并统计相对荧光值。制作2-NBDG浓度和荧光值标准曲线,计算细胞摄取2-NBDG的浓度。
3.3Western blot检测不同干预对GLUT4蛋白表达量的影响 不同浓度葡萄糖处理5 d和7 d后收集细胞,刮下细胞转移至2 mL EP管,4°C离心留沉淀,每管加入裂解液150 μL,混匀,置冰上裂解25 min;取10 μL裂解的蛋白液加入蛋白定性液,分光光度计检测蛋白浓度;剩余蛋白液加入等体积2×loading buffer,100 °C加热10 min,4 °C 离心取上清。Wes-tern blot 蛋白上样量为30 μg,经100 V电压电泳和60 V电压电转后取出NC膜,丽春红预染剪下对应条带,封闭2 h后分别加入对应 I 抗,抗GLUT4 抗体的浓度为1 ∶2 000,抗β-actin抗体的浓度为1∶5 000。孵育过夜,加入 II抗,孵育2 h。X射线曝光胶片显影。显影后的胶片扫描导入Image-Pro Plus 6.0图像分析软件进行灰度分析。
3.4免疫荧光组化检测不同干预对GLUT4蛋白分布的影响 细胞诱导分化5天后,用1 mL 4%多聚甲醛固定细胞30 min,5%羊血清封闭1 h;5%羊血清配制GLUT4抗体,浓度为1 ∶100,孵育过夜,5%羊血清配制山羊抗兔红色II抗,浓度为1 ∶200,孵育2 h;配制DAPI工作液加入细胞培养皿500 mL,避光储存于4 °C。激光共聚焦显微镜采集图像,观察细胞膜上GLUT4的分布情况。
4 统计学处理
运用SPSS 16.0进行数据统计分析。实验数据以均数±标准差(mean±SD)表示,采用Levene检验进行方差齐性检验,多组间比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学显著性。Origin 7.5软件绘制图表。
结 果
1 不同浓度葡萄糖干预不同时长对C2C12细胞形态的影响
在倒置相差显微镜下观察以不同浓度葡萄糖干预的C2C12细胞形态的变化,对照组诱导分化第3天出现汇聚融合现象并有细小肌管形成,第5 天肌管数量明显增加、体积明显变大,第7 天形成大量粗大的肌管(图1中红色箭头标示处);40组诱导分化第5 天开始出现细小肌管,第7 天肌管数量增多;而60组直到第7 天才开始出现细小肌管,同时未见明显增殖。以上形态学结果提示,高糖干预明显抑制C2C12细胞的生长分化,且存在剂量和时间依赖性,60 mmol/L葡萄糖干预5 天肌管明显减少,干预7 天抑制作用进一步加强,见图1。
2 不同浓度葡萄糖干预不同时长对C2C12细胞糖摄取能力的影响
不同浓度葡萄糖干预第1 天,3组细胞2-NBDG基础摄取量无显著差异(P>0.05),且以200 nmol/L胰岛素刺激后,3组细胞2-NBDG摄取量均明显增加(P<0.01);干预3 d后,3组细胞2-NBDG基础摄取量仍无显著差异(P>0.05),但以胰岛素刺激后,对照组2-NBDG摄取量明显增加(P<0.01),40组2-NBDG摄取量也明显增加(P<0.05),而60组2-NBDG摄取量未见明显增加(P>0.05);干预5 d后,3组细胞胰岛素刺激的2-NBDG摄取量变化趋势与第3天基本一致,同时60组细胞2-NBDG基础摄取量显著低于对照组(P<0.01);干预7 d后,3组细胞的2-NBDG基础摄取量和胰岛素刺激的2-NBDG摄取量与第5 天趋势基本一致,见图2。以上葡萄糖摄取结果提示,高糖干预明显降低C2C12细胞基础和胰岛素刺激的糖摄取能力,且存在剂量和时间依赖性,以60 mmol/L葡萄糖干预5 d出现明显抑制,干预7 d抑制效果进一步加强。
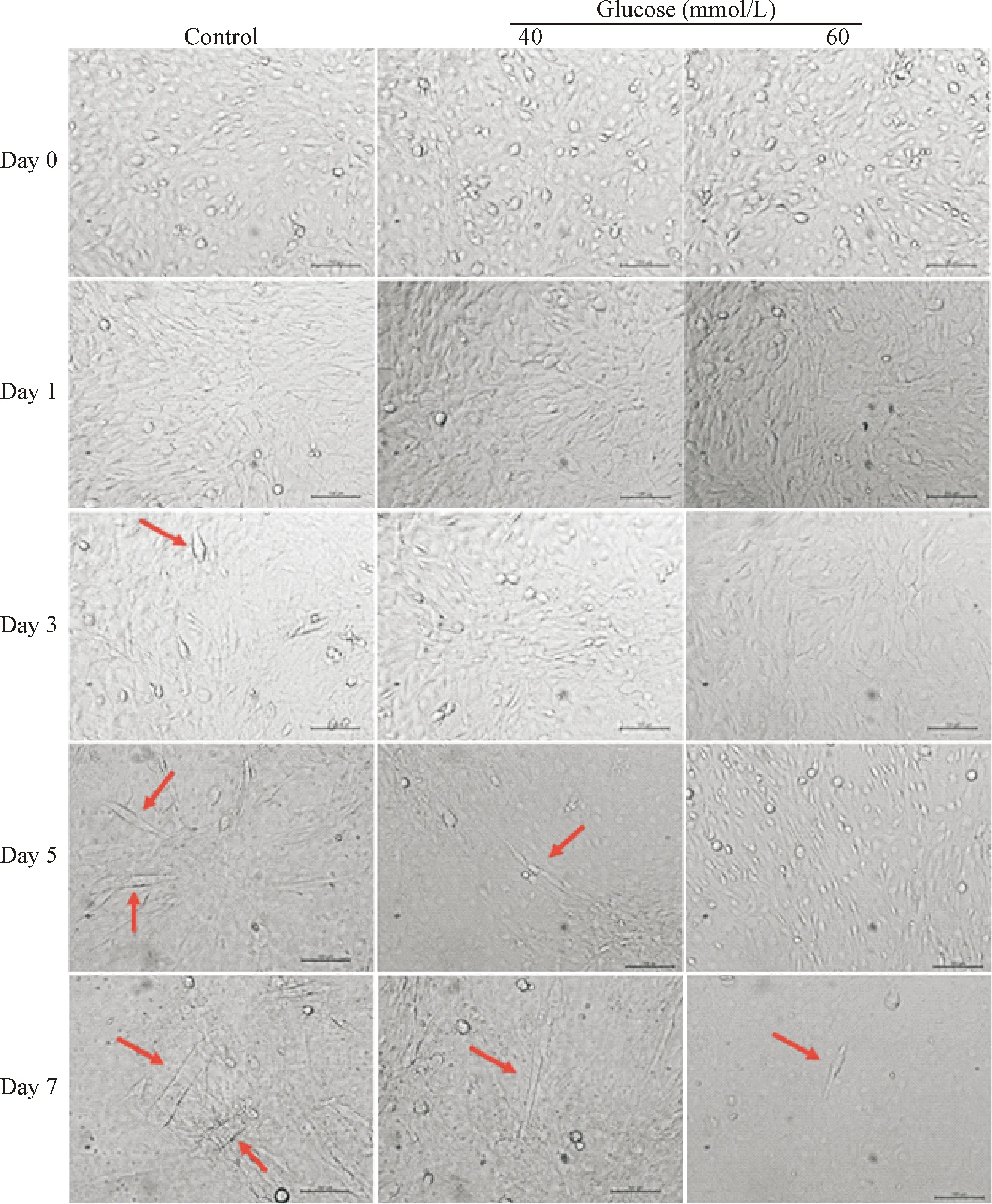
Figure 1.The morphological changes of the C2C12 cells treated with glucose at different concentrations were observed under phase contrast microscope. The scale bar=100 μm.
图1 不同浓度葡萄糖干预不同时长对C2C12细胞形态的影响
3 不同浓度葡萄糖干预不同时长对C2C12细胞 GLUT4蛋白表达的影响
检测不同浓度葡萄糖干预5 d和7 d后细胞基础GLUT4蛋白表达和200 nmol/L胰岛素刺激的GLUT4蛋白表达水平发现,干预5 d和7 d后对照组胰岛素刺激的GLUT4水平均显著高于基础GLUT4水平(P<0.05),而5 d后,60组胰岛素刺激的GLUT4水平与基础GLUT4水平的差异无统计学显著性(P>0.05),7 d后甚至低于基础GLUT4水平。40组在第5天后与60组变化趋势一致,但第7天后,与对照组相比基础GLUT4水平显著降低,胰岛素刺激后显著增加(P<0.01),见图3。以上结果提示,高糖干预明显降低C2C12细胞的基础和胰岛素刺激的GLUT4蛋白表达,且存在剂量和时间依赖性,60 mmol/L葡萄糖干预5 d明显抑制GLUT4的蛋白表达,干预7 d抑制效果进一步加强。
4 不同浓度葡萄糖干预5 d对C2C12细胞膜上 GLUT4蛋白分布的影响
3组细胞进行细胞膜GLUT4免疫荧光染色,随机选取3个14 mm×14 mm视野采集图像,并计算相对荧光水平。40组细胞膜上GLUT4荧光水平低于对照组,但差异无统计学显著性(P>0.05)。60组细胞膜的GLUT4荧光水平显著低于对照组(P<0.01),见图4。以上结果提示高糖干预5 d明显降低C2C12细胞膜 GLUT4表达量,且存在剂量依赖性,以60 mmol/L葡萄糖干预抑制效果最明显,说明60 mmol/L葡萄糖干预不仅导致细胞中GLUT4蛋白表达降低,同时抑制GLUT4蛋白向细胞膜的转运,抑制C2C12细胞葡萄糖的摄取。

Figure 2.The changes of glucose uptake in the C2C12 cells treated with glucose at different concentrations. Mean±SD.n=6.*P<0.05,**P<0.01vsPBS group;##P<0.01vscontrol group.
图2 不同浓度葡萄糖干预不同时长对C2C12细胞葡萄糖摄取能力的影响
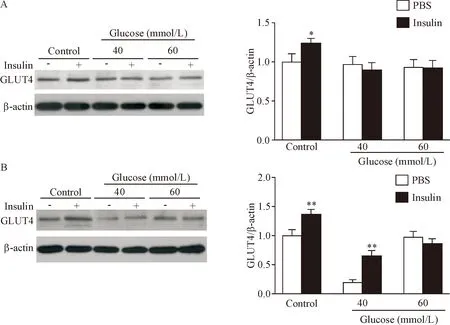
Figure 3.The changes of GLUT4 protein expression in the C2C12 cells treated with glucose at different concentrations for 5 d (A) and 7 d (B) respectively. Mean±SD.n=6.*P<0.05,**P<0.01vsPBS group.
图3 不同浓度葡萄糖干预不同时长对C2C12细胞GLUT4蛋白表达的影响
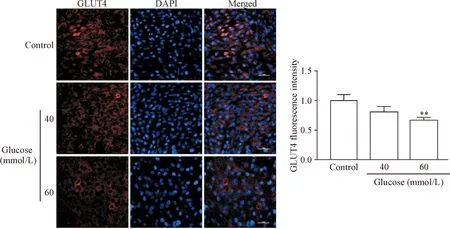
Figure 4.The changes of GLUT4 fluorescence intensity in C2C12 cell membrane treated with glucose at different concentrations for 5 d. The scale bar=50 μm. Mean±SD.n=6.**P<0.01vscontrol group.
图4 不同浓度葡萄糖干预5 d对C2C12细胞膜GLUT4蛋白分布的影响
讨 论
建立离体胰岛素抵抗模型既有利于在细胞和分子水平深入探讨胰岛素抵抗的发生发展机制,又有利于在体外进行胰岛素抵抗防治药物的研发和筛选,骨骼肌是胰岛素抵抗发生的主要部位,因此建立稳定可重复的骨骼肌细胞胰岛素抵抗模型至关重要[16]。虽目前国内外关于C2C12细胞胰岛素抵抗模型的建立已多有研究,主要通过棕榈酸、游离脂肪酸和碳酸镧等进行诱导,但采用的诱导方法、诱导药物的作用浓度及作用时间均有所差异, 尚无法确定一个统一的标准,且胰岛素抵抗效果也不稳定[17]。
本研究尝试以高糖诱导建立胰岛素抵抗模型,一方面与棕榈酸和游离脂肪酸等的间接作用相比,长期高糖是导致胰岛素抵抗和2型糖尿病的直接原因,也是体内胰岛素抵抗和2型糖尿病的主要特征,以高糖干预建立胰岛素抵抗离体模型对于胰岛素抵抗的在体研究具有更好的参考意义[18-19];另一方面本研究通过以不同浓度葡萄糖刺激C2C12细胞并分别在干预1、3、5和7 d后实时收集细胞进行相关检测,建立高糖刺激与C2C12细胞胰岛素抵抗之间的量效关系,以确保该建模方式的稳定性、可信性和可重复性。
胰岛素抵抗实质为胰岛素激活的靶细胞糖代谢降低及葡萄糖转运能力下降,在分子水平是胰岛素信号转导受损的结果[7]。因此,本研究不仅通过测定细胞的葡萄糖摄取量来判断胰岛素抵抗,而且对细胞胰岛素信号通路中关键因子GLUT4表达水平和分布进行分析,同时实时观察细胞形态的变化,以期更加全面的分析和验证胰岛素抵抗模型是否成功建立。
作为新生肌肉的细胞来源,卫星细胞的增殖和分化在骨骼肌质量维持和重塑中发挥关键作用,这对于提高机体胰岛素敏感性尤为重要,反之则进一步加快胰岛素抵抗和2型糖尿病的发展进程[20-21]。本研究中,从形态学上观察到60 mmol/L葡萄糖干预3 d后明显抑制成肌细胞的生长分化,且存在剂量和时间依赖性,随着干预时间延长,对成肌细胞生长分化的抑制更加明显,这将导致细胞葡萄糖摄取能力减弱,加快胰岛素抵抗和糖尿病的发展进程。
为进一步验证不同浓度葡萄糖干预不同时长对成肌细胞糖摄取能力的影响,本研究通过2-NBDG法检测不同干预对成肌细胞基础糖摄取和胰岛素刺激糖摄取的影响。2-NBDG通过葡萄糖转运蛋白进入细胞,检测细胞中荧光强度能较好地反映一定时长内细胞的糖摄取能力,是目前研究离体胰岛素敏感性的常用手段[22]。本研究发现,高糖干预可明显降低C2C12细胞基础和胰岛素刺激的糖摄取能力,且存在剂量和时间依赖性,以60 mmol/L葡萄糖干预5 d出现明显抑制,干预7 d抑制效果进一步加强,说明60 mmol/L葡萄糖干预5 d后导致细胞葡萄糖摄取能力和胰岛素敏感性显著下降,产生胰岛素抵抗。
作为胰岛素信号通路的最终效应蛋白,GLUT4对于维持机体葡萄糖稳态具有关键作用,是研究胰岛素抵抗的重要靶点,胰岛素抵抗发生时GLUT4的激活明显减少[23]。由于在本研究的形态学和糖摄取能力检测中,60 mmol/L葡萄糖干预成肌细胞5 d后产生明显胰岛素抵抗现象,因此我们检测了不同浓度葡萄糖干预第5 天和第7 天的基础和胰岛素刺激的GLUT4蛋白表达水平,发现60 mmol/L葡萄糖干预成肌细胞5和7 d后,胰岛素刺激均无法使细胞的GLUT4激活增加,即出现胰岛素信号转导通路受损,尤其是7 d后,基础GLUT4水平也显著低于正常细胞,说明60 mmol/L葡萄糖干预成肌细胞5 d后导致胰岛素信号转导通路受损,到第7 天后,受损程度进一步加深。
GLUT4属于跨膜蛋白,只有在细胞外膜上才能转运葡萄糖进入细胞[24],因此本研究进一步检测了不同浓度葡萄糖干预5 d后细胞膜上GLUT4蛋白的分布,结果发现60 mmol/L葡萄糖干预成肌细胞5 d后不仅导致GLUT4蛋白表达下降,同时抑制GLUT4从胞浆转运到细胞外膜,导致细胞膜上GLUT4的分布减少和对胰岛素敏感性降低。以上研究中,40 mmol/L葡萄糖也一定程度抑制成肌细胞增殖分化,导致成肌细胞葡萄糖摄取能力和GLUT4激活水平下降,但效果不如60 mmol/L葡萄糖明显和稳定。
综上所述,本研究通过高糖刺激能成功构建较为稳定的小鼠骨骼肌细胞离体胰岛素抵抗模型,以60 mmol/L葡萄糖干预5 d产生胰岛素抵抗,通过形态学观察并检测基础和胰岛素刺激的葡萄糖摄取能力以及GLUT4蛋白表达与分布能较好地评价骨骼肌细胞离体胰岛素抵抗水平。
