SIRT1通过调节FOXO1/RAB7信号通路促进低氧诱导的胰腺癌细胞自噬*
2019-09-23江建新孙诚谊
田 舍, 江建新, 喻 超, 李 琳, 孙诚谊△
(1贵州医科大学, 2贵州医科大学肝胆胰脾重点实验室, 贵州 贵阳 550001;3武汉大学人民医院, 湖北省人民医院, 湖北 武汉 430000)
胰腺癌在世界肿瘤排名中为第7位,是恶性程度较高的实体肿瘤之一,发生隐匿、发展迅速,明确诊断时往往已经是进展期,5年生存率低于5%[1-2];随着前沿科技不断运用于临床,针对胰腺癌患者的系统治疗方案不断改善,但是临床治疗效果并没有明显提高,约40%的新诊断胰腺癌患者均发现有不同程度的转移,丧失了最佳手术时间,只能采取姑息性治疗[3-4]。全球的学者们从胰腺肿瘤生物学特性及其发生的分子生物学机制发生、发展的分子靶点为突破口,为寻找治疗胰腺肿瘤的分子治疗靶点。
哺乳动物沉默信息调节因子2(silent information regulator 2,Sir2)最早在酵母菌中被发现,后来逐渐发现在自然界生物中广泛的表达。Sir2作为组蛋白去乙酰化酶类,通过调控下游结合蛋白的去乙酰化水平来参与细胞内多个重要信号通路,如能量代谢、脂类代谢和胰岛素分泌等。Sir2家族中研究最多的是SIRT1;目前为止的研究中发现多个重要信号通路的枢纽蛋白与SIRT1相互作用;更多的研究指出SIRT1在肿瘤代谢和营养调节中有着极其重要的作用;现在的证据显示肿瘤细胞中经过上调SIRT1的表达及活性来提高胞内NAD+数量来应对肿瘤的生存和增殖。
本研究中,我们将SIRT1小干扰 RNA(small interfering RNA,siRNA)和过表达质粒分别转染到胰腺癌Panc-1细胞中,敲减和过表达SIRT1基因,研究其对于胰腺癌细胞自噬能力的影响,并分析 SIRT1对FOXO1/RAB7信号通路的调控作用,初步探讨相关分子机制,为寻找胰腺癌治疗相关的分子靶点提供理论依据。
材 料 和 方 法
1 细胞和试剂
人胰腺癌细胞株Panc-1由武汉华中科技大学同济医学院胆胰实验室惠赠。高糖DMEM培养基与胎牛血清购自Gibco;RNAiMAX转染试剂购自Invitrogen;LC3双标腺病毒购自汉恒生物科技(上海)有限公司;SIRT1siRNA(si-SIRT1)设计及构建由广州锐博公司完成;鼠抗人SIRT1抗体及兔抗人p62、FOXO1和RAB7抗体购Cell Signaling Technology;鼠抗人GAPDH和histone H3抗体、辣根过氧化物酶标记的II抗及高灵敏度化学发光检测试剂盒购自武汉博士德生物工程有限公司;细胞裂解液、细胞核蛋白与细胞浆蛋白抽提试剂盒、BCA蛋白浓度测定试剂盒和DAPI染料购自北京碧云天生物技术有限公司;Protein A/G 琼脂糖珠购自Santa Cruz。pFlag-FOXO1和 pHA-SIRT1质粒由本实验室构建。
2 主要方法
2.1细胞培养及转染 人胰腺癌细胞株Panc-1用含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM培养基培养。每隔24 h换液1次,待细胞密度为80%时,常规进行消化传代。细胞培养分2组:对照组细胞于37 °C、5% CO2、95%空气在恒温培养箱中常规培养;实验组细胞于37 °C、5% CO2、94% N2、1% O2三气培养箱中进行低氧培养12 h。选取对数生长期的细胞接种于6孔板,调整细胞密度为每孔1×105个,利用RNAiMAX试剂进行转染,严格按照试剂盒说明书操作。
2.2总细胞蛋白的提取 常规消化离心收集细胞,用碧云天RIPA裂解液(强)提取总蛋白。
2.3胞核蛋白的提取 将Panc-1细胞接种到 60 mm 细胞培养皿中, 分为 pHA-SIRT1组和 si-SIRT1组,按上述分组转染相应质粒和siRNA至Panc-1细胞, 培养48 h 后,收集细胞并加入细胞浆蛋白抽提试剂, 放置冰上裂解 10 min,4 ℃、12 000×g离心 10 min 后吸弃上清液,加入细胞核蛋白抽提试剂。每隔1~2 min高速剧烈振荡15~30 s,共30 min。4 ℃ (12 000~16 000)×g离心10 min,上清即为所需胞核蛋白。
2.4Western blot法检测目的蛋白的表达 半干法电泳转移至PVDF膜,10%脱脂奶粉封闭2 h。依次加入特异性 I 抗和辣根过氧化物酶标记的羊抗鼠IgG、羊抗兔IgG,加入ECL化学发光液,于Bio-Rad凝胶成像仪中进行显影。根据曝光结果进行定性分析,以上实验重复3次。
2.5免疫共沉淀实验 常规收集细胞后裂解细胞,加入1 μg小鼠抗SIRT1单克隆抗体,4 °C旋转混合2 h,加入20 μL蛋白A,继续混合过夜,离心后吸弃上清,裂解液洗涤3次后加入5 μL 5× Tricine SDS-PAGE上样缓冲液,煮沸5 min,离心后立即电泳。
2.6细胞免疫荧光检测 (1)将低氧培养的Panc-1细胞用4 ℃、含4%多聚甲醛的磷酸缓冲液(phosphate buffer,PB)固定,加入鼠抗SIRT1(1 ∶1 000)抗体4 ℃孵育过夜。磷酸盐缓冲液(phosphate-buffered saline,PBS)漂洗后加入羊抗鼠Cy3荧光 II 抗,室温下避光孵育 2 h。漂洗后用荧光封片剂(0.01 mol/L PBS 和甘油1 ∶1)封片,于激光共聚焦显微镜下观察拍照。(2)通过感染mRFP-GFP-LC3 (Ad-tf-LC3)腺病毒,并定量mRFP-GFP-LC3荧光点,实现对自噬体的检测。定量单个细胞荧光斑的表达;计算50个细胞的荧光斑,再计算平均每个转染细胞的荧光斑数量。
3 统计学方法
用SPSS 23.0统计学软件进行统计分析,实验结果采用均数±标准差(mean±SD)表示。多组间的均值比较用单因素方差分析法;SIRT1敲减或过表达组与对照组之间的比较采用独立样本t检验; SIRT1与FOXO1/RAB7信号通路关键因子的相关性分析采用 Pearson直线相关分析法。以P<0.05为差异有统计学意义。
结 果
1 SIRT1在低氧诱导的自噬胰腺癌Panc-1核内的表达情况
免疫荧光显示,相比对照组0 h,SIRT1在低氧诱导的胰腺癌Panc-1细胞核内表达明显增加,见图1A。Western blot 检测显示,SIRT1在Panc-1细胞核中随低氧时间增加总体呈现逐渐表达增加的趋势(P<0.05),见图1B。

Figure 1.The expression of SIRT1 in pancreatic cancer cell nucleus induced by hypoxia. A: immunofluorescence staining; B: Wes-tern blot. Mean±SD.n=3.*P<0.05vs0 h group.
图1 SIRT1在低氧诱导的胰腺癌细胞核中的表达情况
2 敲减或过表达SIRT1对低氧诱导的胰腺癌Panc-1细胞自噬的影响
Western blot 法检测SIRT1敲减和过表达效果,见图2。敲减SIRT1后胰腺癌Panc-1细胞自噬相关蛋白LC3-II的表达增多,且p62降解受到抑制(P<0.05);而当SIRT1过表达时,LC3-II表达变化的差异无统计学显著性(P>0.05),但是p62的降解受到明显抑制(P<0.05),见图3。同时通过荧光显微镜观测双色荧光标记的LC3蛋白在低氧诱导的胰腺癌细胞中的表达情况,下调SIRT1后自噬溶酶体(红色荧光点)数量明显增加(P<0.05),而自噬小体(黄色荧光点)变化的差异无统计学显著性(P>0.05),见图4。
3 敲减或过表达SIRT1对FOXO1/RAB7信号通路的影响
Western blot 检测显示,过表达SIRT1后,FOXO1/RAB7信号通路蛋白的表达水平明显升高(P<0.05); 敲减SIRT1的表达能够显著降低FOXO1/RAB7信号通路蛋白的表达水平(P<0.05),抑制FOXO1/RAB7信号通路,见图5。
4 生物信息学分析SIRT1与FOXO1的相关性
通过GEPIA网站进行SIRT1与其它蛋白的关联性分析,结果显示SIRT1与FOXO1显著相关(P<0.05),提示 SIRT1与自噬信号通路可能存在密切关系,见图6。
5 胰腺癌细胞中SIRT1与FOXO1蛋白存在相互作用
在胰腺癌Panc-1细胞中共转染 pHA-SIRT1和pFlag-FOXO1质粒,通过蛋白免疫共沉淀实验检测SIRT1与FOXO1蛋白之间的相互作用情况,结果显示Panc-1细胞中SIRT1与FOXO1存在相互作用,见图7。

Figure 2.The over-expression and knock-down ofSIRT1expression at protein levels in the Panc-1 cells were determined by Western blot. Mean±SD.n=3.*P<0.05vssi-NC group;#P<0.05vspHA-SIRT1 group.
图2 Western blot检测胰腺癌Panc-1细胞敲减或过表达SIRT1的效果
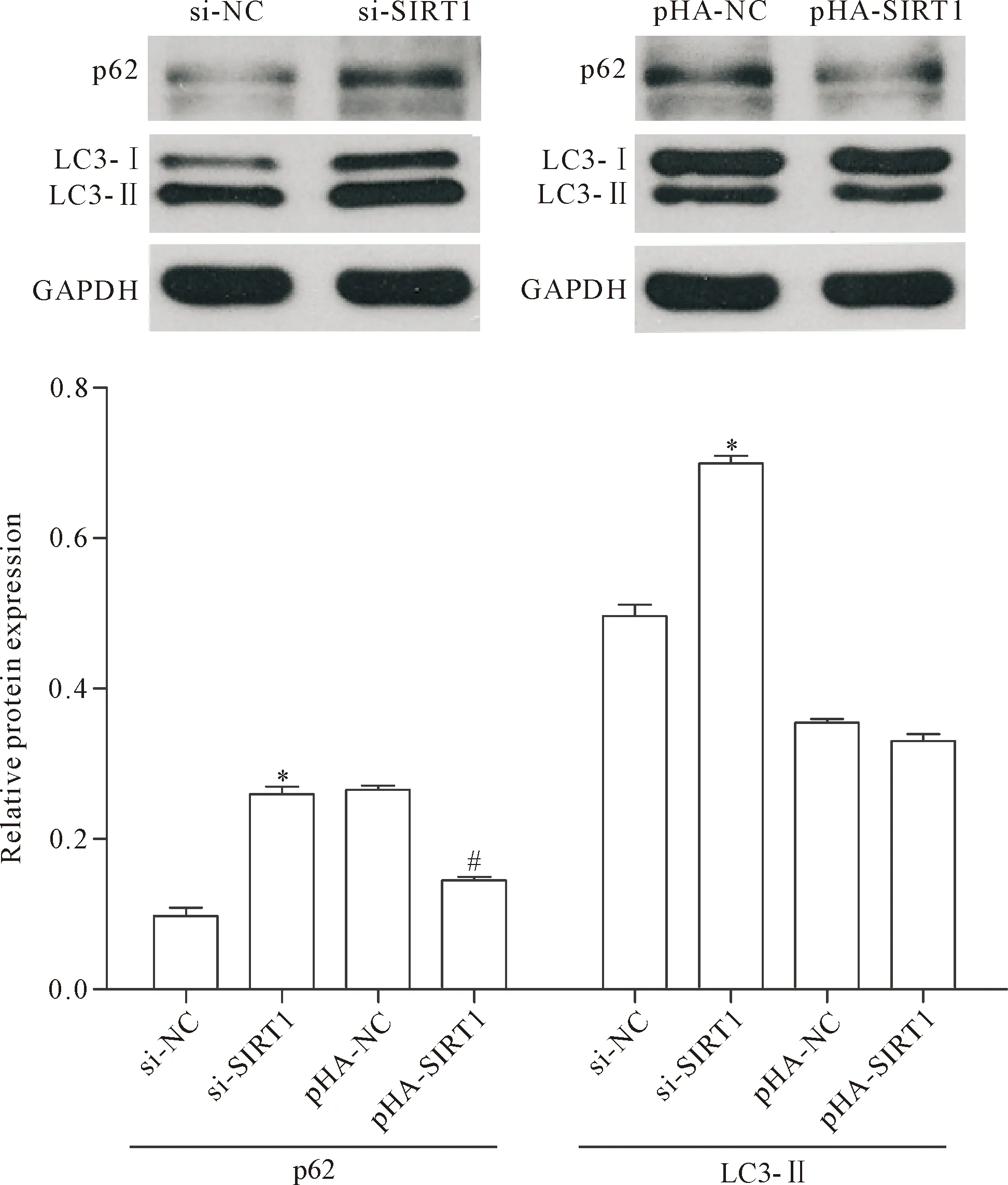
Figure 3.The effects ofSIRT1over-expression and knock-down on the autophagy in the Panc-1 cells.Mean±SD.n=3.*P<0.05vssi-NC group;#P<0.05vspHA-SIRT1 group.
图3 敲减或过表达SIRT1对于胰腺癌Panc-1细胞自噬的影响

Figure 4.The effect ofSIRT1expression knock-down on autolysosome production in the Panc-1 cells. Mean±SD.n=3.*P<0.05vssi-NC group.
图4 敲减SIRT1的表达对于自噬溶酶体生成的影响
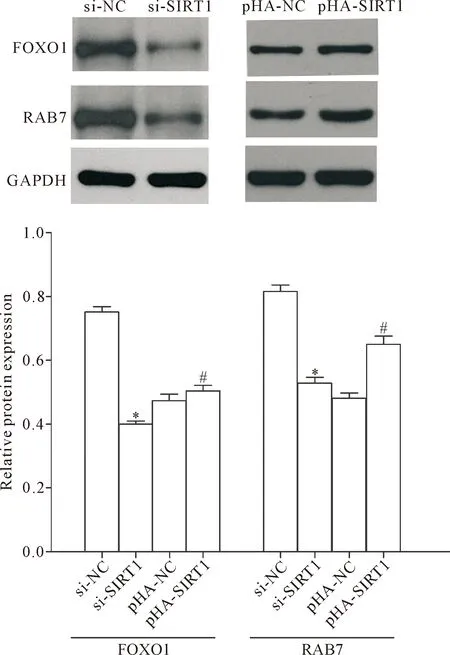
Figure 5.The effects of SIRT1 expression levels on the protein expression of FOXO1/RAB7 signaling pathway-related molecules. Mean±SD.n=3.*P<0.05vssi-NC group;#P<0.05vspHA-NC group.
图5 SIRT1表达水平对FOXO1/RAB7信号通路相关蛋白表达的影响
讨 论
肿瘤缺氧微环境是人类恶性实体肿瘤的基本特征之一,肿瘤缺氧与其恶性生物学行为密切相关[5]。
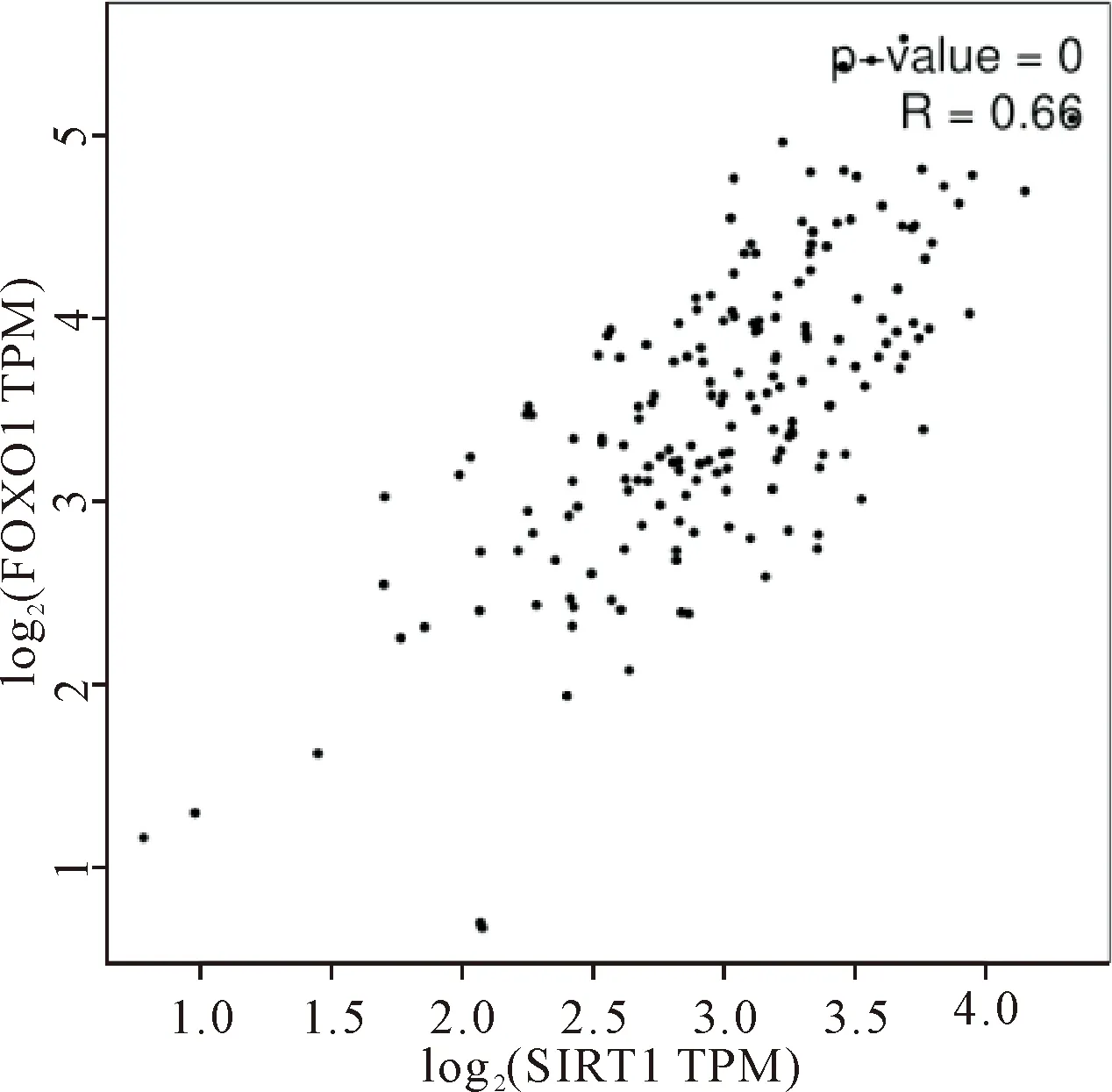
Figure 6.The correlations between SIRT1 and FOXO1 were analyzed in GEPIA database.
图6 生物信息学分析SIRT1与FOXO1信号通路关键因子的相关性
人体的大部分组织中,氧浓度在3~5%之间,当氧浓度处于3%以下即视为低氧环境[6]。临床研究中通过18F-FAZA辅助PET图像证实胰腺癌缺氧分数在5~50%之间[7],瘤体内呈低氧气张力,表明胰腺癌处于低氧环境,具有缺血缺氧的病理生理特点。缺氧与胰腺癌的发展进程及恶性生物学特性密切相关[8-9]。SIRT1是Sir2家族中的成员之一。SIRT1作为一种重要的能量调控蛋白,连接着细胞代谢和核染色质;作为NAD+依赖型去乙酰化酶,通过调控组蛋白、转录因子和转录辅助因子,从而参与到细胞衰老、凋亡、DNA损伤修复和自噬等生理活动中[10]。叉头框蛋白转录因子家族中O亚家族中的FOXO1在人体心脏细胞、脂肪细胞、肝脏细胞和脑神经中有着大量的表达。研究表明,SIRT1-FOXO家族信号通路对衰老、肥胖、肿瘤及血管应激损伤有着重要的影响[11]。SIRT1对肿瘤细胞的调控具有双重意义,特别是SIRT1通过多个信号通路影响肿瘤细胞的侵袭、转移和生存[12]。

Figure 7.SIRT1 interacted with FOXO1 at the protein level in the Panc-1 cells determined by co-immunoprecipita-tion.
图7 胰腺癌细胞中SIRT1与FOXO1蛋白存在相互作用
细胞在氧化应激状态时,FOXO1被激活,FOXO1与Atg7和E1蛋白结合,进而影响肿瘤细胞的自噬[13]。此外,非折叠蛋白反应(unfolded protein response,UPR)转录因子XBP-1u可促进FOXO1的降解。但Ying 等[14]的研究表明,FOXO1的降解受到抑制可过度激活自噬,降低肿瘤细胞活性。
我们通过共聚焦荧光显微镜及Western blot实验发现SIRT1随着胰腺癌细胞自噬的进程,逐渐在细胞核内表达增加。当通过转染手段抑制细胞内SIRT1的表达时,Panc-1细胞出现自噬受到抑制的表现。并且从LC3双色荧光标记蛋白的结果可以发现,SIRT1通过FOXO1/RAB7信号通路,调控胞内自噬小体及溶酶体的结合,使得自噬溶酶体大量在胞内堆积,降解困难。同时通过生物信息学及免疫共沉淀证实SIRT1通过结合FOXO1,并调控FOXO1的去乙酰化程度进而调节胰腺癌细胞自噬。
综上所述,低氧环境能够引起SIRT1的入核,通过FOXO1/RAB7调控胰腺肿瘤细胞自噬。通过下调SIRT1的表达可以在低氧条件下抑制胰腺肿瘤细胞的自噬,其机制可能与调节FOXO1的乙酰化/去乙酰化有关,但此信号通路具体作用机制还不甚清楚,需要进一步的研究,并且该基因可能是除常规治疗方法外的新的基因靶点。
