中华绒螯蟹肝胰腺坏死症病理学诊断及两种病原的检测
2019-09-23刘力硕杨宗英杨先乐
刘力硕,杨宗英,胡 鲲,杨先乐
(1.上海海洋大学国家水生动物病原库,上海 201306;2.上海海洋大学水产科学国家级实验教学示范中心,上海 201306;3.上海海洋大学农业部淡水水产种质资源重点实验室,上海 201306;4.南昌市农业科学院,南昌 330038)
中华绒螯蟹(Eriocheirsinensis)养殖业是我国水产养殖的支柱产业之一。近年来,江苏省中华绒螯蟹养殖产业飞速发展,2014年江苏省河蟹总产值达40亿美元[1],然而养殖迅猛发展的同时病害问题也愈演愈烈,2015年和2016年江苏省兴化市暴发了中华绒螯蟹肝胰腺坏死症,俗称“水瘪子”,造成总产量损失达40%~50%[2],2017年虽呈现稍缓态势,但仍威胁着我国河蟹产业的健康发展。早在2001年,东太湖已发现类似疾病[3],但一直未得到足够的关注。目前尚未有学者详细描述该病各典型症状的变化过程,对完整病程中各阶段的划分也存在不足,该病的病原仍存在争论,主要集中于微孢子虫[2]、白斑综合征病毒(WSSV)[4]和非生物因素[3,5~6]。为探究以上问题,实验在江苏省兴化市采集80只该病病蟹,从中选取处于不同患病阶段共12只,进行组织病理学研究和微孢子虫、WSSV两种病原的检测,系统地阐述了该病各典型症状的变化过程,并创新地依据肝小管病变程度,将完整病程划分为4个时期,最后对病原检测结果进行讨论分析,为中华绒螯蟹肝胰腺坏死症提供临床诊断和预防的依据。
1 材料与方法
1.1 实验材料
2018年4-6月,于江苏省泰州市兴化市采集患中华绒螯蟹肝胰腺坏死综合征病蟹共80只(50~100 g),为全面了解该病各时期的病理变化,挑选处于该病各阶段且具有所处阶段典型症状的病蟹,共12只(1~12号),分别采集这12只病蟹的肝胰腺、肌肉和鳃组织于波恩氏液中固定24 h后转入70%乙醇中于4 ℃下保存,用于制作组织病理切片,同时采集肝胰腺和肌肉组织于-80 ℃下保存,用于病原检测实验。
1.2 实验方法
病蟹活体剖检观察:活体解剖病蟹(1~12号),观察体表及各内脏器官的病变情况,与健康蟹进行比较,以确定该病的主要病变规律和病变器官,采集图片并做出临床解剖诊断。
组织病理学切片制备和观察:将所保存的组织用锐利手术刀修整为长5 mm宽2 mm高1 mm左右的组织块,经过体积分数70%~100%的乙醇逐级脱水、二甲苯透明、石蜡包埋、切片机切片(厚度5 μm)、H.E.染色、中性树胶封片制成组织病理切片,在奥林巴斯高级摄像显微镜(BX51/DP72)下观察拍照。
巢式PCR检测WSSV:利用巢式PCR技术检测病蟹肝胰腺和肌肉组织中的WSSV。PCR引物序列参照文献[7],PCR反应程序参照文献[8]。PCR产物在1.5%的琼脂凝胶上进行电泳,在BIO-RAD凝胶成像系统中观察拍照。
常规PCR检测微孢子虫:利用常规PCR技术检测病蟹肝胰腺和肌肉组织。PCR引物序列及PCR反应程序参照文献[2]。PCR产物在1.5%的琼脂凝胶上进行电泳,在BIO-RAD凝胶成像系统中观察拍照。
2 结果
2.1 病蟹剖检观察的临床症状
肝胰腺症状表现:与健康河蟹肝胰腺(图版Ⅰ-1)对比,发现1~3号病蟹肝胰腺明显增生、肿大(图版Ⅱ-1),同时,腺体因体积增大,出现向泄殖腔拓张的症状(图版Ⅱ-2、3);4~6号病蟹肝胰腺出现黄色与白色肝小管交错的症状(图版Ⅱ-4~6);7~9号病蟹肝胰腺出现肝小管全部白化的症状(图版Ⅱ-7~9);10~12号病蟹肝胰腺出现严重萎缩、粘液增多、浑浊、半透明、粥样的特征(图版Ⅱ-10~12)。
鳃部症状表现:6、12号病蟹鳃部变黑(图版Ⅱ-6、12);1、5、9、10号病蟹鳃部颜色变暗(图版I-1、5、9、10)。
副肢症状表现:副肢均无力,甲壳变薄、脆,易被外力(如:手指按压)造成形变。
综上所述,肉眼可见的肝胰腺白化、萎缩,鳃丝颜色变深,副肢无力、变软,腹腔积水为该病的临床症状。
2.2 病蟹的组织病理变化
2.2.1 肝胰腺组织病理变化
与健康河蟹肝胰腺组织切片(图版Ⅰ-2)对比,发现12只病蟹的肝小管上皮细胞均有不同程度的病变及损伤,体现出该病病程中不同阶段的病理特征。1~3号病蟹的肝小管上皮细胞大量增生,病变为区别于健康肝小管单层上皮细胞的多层上皮细胞(图版Ⅲ-1~3);4~6号病蟹肝胰腺中的部分肝小管空泡化,与正常肝小管交错分布(图版Ⅲ-4~6),4号病蟹空泡化的肝小管上皮细胞轻度溶解(图版Ⅲ-4);7~9号病蟹的全部肝小管均重度空泡化(图版Ⅲ-7~9);10~12号病蟹的全部肝小管上皮细胞均严重溶解(图版Ⅲ-10~12)。肝胰腺组织在该病发展过程中的不同阶段体现出规律的病理变化特征,其病变症状对该病诊断起最重要作用。
2.2.2 鳃组织病理变化
与健康河蟹鳃组织切片(图版Ⅰ-3)对比,发现12只病蟹的鳃组织细胞结构完整,仅局部鳃弓和个别鳃小叶发生病变,1~3以及6号病蟹鳃弓和鳃小叶不同程度充血(图版Ⅳ-1~3、6)。1、2、5、6号病蟹嗜酸性粒细胞有不同程度的浸润(图版Ⅳ-1、2、5、6)。4~10以及12号病蟹鳃部多处不同程度水肿,其中9号病蟹鳃小叶上皮细胞融合(图版Ⅳ-4~10、12)。鳃部并未呈现出规律性的病理变化,病理症状种类各异,个体差异性较大,多与其生长水体的水质情况差异性有关,如:理化因子含量、浑浊度、pH等,亦可能因患病个体抵抗力下降,继而被病毒、真菌、细菌、寄生虫等侵染所致。
2.2.3 肌肉组织病理变化
与健康河蟹肌肉组织切片(图版Ⅰ-2)对比,发现随着12只病蟹肝胰腺病变的加剧,肌肉组织也呈现出愈发严重的萎缩(图版Ⅴ-1~12),同时个别部位出现嗜碱性粒细胞浸润的病理症状(图版Ⅴ-1、6、9),最终病蟹肌肉严重萎缩部位被结缔组织的增生所取代(图版Ⅳ-10~12)。
2.3 病蟹肝胰腺中微孢子虫和WSSV的PCR结果
微孢子虫检测的扩增片段预期大小为931 bp,白斑综合征病毒(WSSV)检测的扩增片段预期大小为982 bp,阳性目标条带均出现在1 000 bp分子标准的下方。
12只病蟹肝胰腺和肌肉组织中微孢子虫的检测结果显示,4~7号病蟹肝胰腺组织检测呈阳性(图1-A),肌肉组织检测全部呈阴性(图1-B),统计(表1)显示,4只病蟹肝胰腺检测结果呈阳性,肌肉检测结果全部呈阴性。

图1 肝胰腺和肌肉组织寄生微孢子虫的PCR检测结果Fig.1 Results detected by conventional PCR of hepatopancreas and muscle parasitized by microsporidian M:DL2000分子质量标准;A:肝胰腺组织中微孢子虫检测;B:肌肉组织中微孢子虫的检测。

样品肝胰腺肌肉样 品肝胰腺肌肉1--7+-2--8--3--9--4+-10--5+-11--6+-12--
注:+ 为阳性结果;- 为阴性结果。
12只病蟹肝胰腺和肌肉组织WSSV检测结果显示,仅12号呈阴性(图2-A),肌肉组织检测中仅3、12号呈阴性(图2-B)。统计(表2)显示,11只病蟹肝胰腺检测呈阳性,10只病蟹肌肉检测呈阳性。

图2 肝胰腺和肌肉组织中WSSV的PCR检测结果Fig.2 Results detected by conventional PCR of hepatopancreas and muscle infected by WSSV M:DL2000分子标准;P:阳性对照;N:阴性对照;A:病蟹肝胰腺组织中WSSV检测;B:病蟹肌肉组织中WSSV的检测

样 品肝胰腺肌肉样 品肝胰腺肌肉1++7++2++8++3+-9++4++10++5++11++6++12--
注:+ 为阳性结果;- 为阴性结果。
3 讨论
3.1 中华绒螯蟹肝胰腺坏死症症状及产生过程
实验结果以2个病理特征诊断中华绒螯蟹肝胰腺坏死症:(1)肝胰腺的肝小管出现上皮细胞增生、黄白肝、白化、粥样化症状之一。(2)副肢软化、肌肉萎缩、局部白浊。
目前,杨宗英等[9]已对肝胰腺颜色变化机理进行了充分的阐释,本研究则重点针对肝胰腺自肥大到坏死萎缩、肌肉萎缩和腹腔积水等典型症状的变化过程及其关联进行描述。首先肝胰腺作为该病完整周期中的主要病变器官,呈现出先增生、功能增强而后器官衰竭、坏死、萎缩的变化特点,推测这种病理变化是由于致病因子导致肝胰腺机能负担增加,作为反应,肝胰腺在病理条件下发生肥大、肝小管上皮细胞增生,器官功能增强,但储备力却相对降低,属于典型的代偿性肥大[10],当肝胰腺的机能负担超过其代偿限度时,造成器官功能不全,肝小管上皮细胞空泡增多、坏死、溶解,肝胰腺逐步衰竭,无法储存营养物质,同时病蟹食欲减弱、食物摄入量严重不足,机体通过分解肌肉组织以补充能量供应,最终造成肝胰腺和副肢肌肉严重萎缩,由于中华绒螯蟹的循环系统属开管系统,导致腹腔内大量血液堆积以填充肝胰腺萎缩的空间,因此出现腹腔积液的症状。
3.2 中华绒螯蟹肝胰腺坏死症的四个发展阶段及命名
目前,已有学者依据肝胰腺颜色变化将该病划分为浅黄、浅粉、乳白和灰白四个阶段[11],但这种依靠肝胰腺颜色划分发病阶段的方法存在以下三点不足:第一,未包含肝胰腺增生这一发病阶段;第二,肝小管的白化并不同步,是逐个白化,存在黄、白肝小管交错的时期,依据肝胰腺颜色进行划分则无法体现这一阶段特点;第三,肝胰腺呈现浅粉、乳白色时,肝小管已完全白化,应当属于同一发病阶段。结合病蟹剖检观察及组织病理观察结果,发现可根据肝小管病变特点,将中华绒螯蟹肝胰腺坏死症的完整病程划分为以下四个时期。
Ⅰ期:肝胰腺增生期,此阶段病蟹临床解剖表现为肝胰腺肿大,颜色正常,因腺体体积增大而向泄殖腔拓张(图版Ⅱ-2、3)。组织病理显示,肝小管上皮细胞有明显的增生现象,即出现多层上皮细胞,区别于健康的单层柱状上皮细胞;此时期副肢肌肉萎缩较轻。
Ⅱ期:部分肝小管白化期,此阶段为Ⅰ期和Ⅲ期之间的过渡期,病蟹临床解剖表现为增生期肝小管与白化期肝小管交错分布。组织病理显示,Ⅰ期和Ⅲ期肝小管交错分布;此时期副肢肌肉轻度萎缩。
Ⅲ期:肝小管完全白化期,此阶段病蟹临床解剖表现为肝胰腺彻底白化或白中透着微黄,肉眼观察为纯白色或淡粉色,但腺体还未发生严重萎缩现象;组织病理显示,肝小管柱状上皮细胞的细胞质严重空泡化,空泡占比65%以上;此时期副肢肌肉萎缩较重。
Ⅳ期:肝胰腺坏死期,此阶段病蟹临床解剖表现为病蟹肝胰腺明显萎缩,肝小管粘连、呈粥样的半透明糊状;组织病理显示,肝小管上皮细胞出现崩解、自溶的现象,柱状上皮细胞结构不完整,但肝小管管壁并未破损;此时期副肢肌肉萎缩严重。
3.3 中华绒螯蟹肝胰腺坏死症致病因子的分析
实验结果显示,仅有33.3%的病蟹肝胰腺中检测出微孢子虫,因此,微孢子虫作为中华绒螯蟹肝胰腺坏死症病原的可能性较小。WSSV在病蟹肝胰腺和肌肉组织中的检出率为91.7%和83.3%,但WSSV为高毒性病毒,有研究表明,健康中华绒螯蟹经过人工感染WSSV 96 h后的存活率不足20%[12],同时实际生产中发生白斑综合症的河蟹养殖池塘存在大量病蟹死亡的现象,与肝胰腺坏死症死亡率低的特点不符,同时肝胰腺坏死综合征病蟹虽感染白斑综合征病毒却未引发相应症状,推测是由于病蟹体内的WSSV浓度较低,未达到引起疾病症状产生的最低病毒浓度,故认为病蟹作为WSSV携带者的可能性较大,而WSSV作为肝胰腺坏死症致病因子的可能性较小。
依据采集病蟹样品期间的流行病学调查发现,发病池塘在当年4月底杀虫作业时,均存在严重的阿维菌素滥用情况,用量超使用说明剂量5~10倍,5月中旬即出现处于肝胰腺坏死病早期的个体,结合该病早期具有肝胰腺代偿性肥大症状,不排除有毒素致病的可能性,有研究表明[13],阿维菌素亚致死暴露下,河蟹肝胰腺中乳酸脱氢酶(LDH)和乙酰胆碱酯酶(AChE)活性显著降低,谷胱甘肽S-转移酶(GSTs)活性呈现先显著提高而后逐步降低的趋势,其中LDH参与有氧氧化和糖类代谢,并发挥重要作用[14],其活性的改变会造成糖类代谢异常,抑制机体供能,进一步造成器官损伤,在一定程度上更敏感地反映脏器的功能状况[15],AChE的活性与冲动传导、神经细胞的能量代谢等重要生理过程有关[16],GSTs是一种参与机体解毒的酶,通过提高谷胱甘肽(GSH)合成,增强机体清除脂质过氧化物自由基的能力。这项研究显示健康河蟹在阿维菌素诱导下,肝胰腺排毒功能先增强后衰弱、营养代谢功能持续衰退的特点,与中华绒螯蟹肝胰腺坏死症初期肝胰腺代偿性肥大,后期器官衰竭的特点具有相似性,同时也为该病的进一步研究提供了思路,因此,实验结果更加倾向于支持非生物因素作为该病致病因子的观点,但仍需对四个病理时期肝胰腺中LDH、AChE和GSTs三种酶作进一步研究,同时也需要采用实际生产中药物滥用剂量,对健康中华绒螯蟹进行中长期持续诱导的实验加以验证。
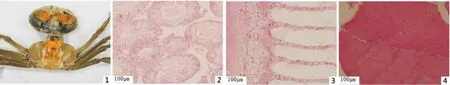
图版Ⅰ 健康中华绒螯蟹
Plate.Ⅰ Healthy ChineseE.sinensis
1.健康河蟹解剖图;2.健康河蟹肝胰腺组织石蜡切片;3.健康河蟹鳃组织石蜡切片;4.健康河蟹肌肉组织石蜡切片。

图版Ⅱ 病蟹解剖图
Plate.Ⅱ Anatomical drawning of sick crabs 1.1号病蟹 肝胰腺肿大、增生(H);2.2号病蟹 肝胰腺肿大,腺体有向泄殖腔拓张的趋势(E);
3.3号病蟹 肝胰腺严重肿大,出现腺体向泄殖腔拓张的症状(E);4~5.4、5号病蟹 部分肝小管白化(W),黄、白肝小管交错;6.6号病蟹 少量肝小管白化(W),鳃丝严重变黑(B);7~9.7~9号病蟹 肝小管全部白化(W);
10.10号病蟹 肝胰腺粥样病变、重度萎缩(A),少量腹水(as);11.11号病蟹 肝胰腺粥样病变、重度萎缩
(A);12.12号病蟹 肝胰腺粥样病变、严重萎缩(A),腹水较多(as),鳃丝变黑(B)。

图版Ⅲ 病蟹肝胰腺组织病理
Plate.Ⅲ Histopathology of hepatopancreas in sick crabs
1~3.1~3号病蟹 肝小管上皮细胞增生(H);4.4号病蟹 白化肝小管空泡化(V),细胞溶解(D),未白化的肝小管,上皮细胞增生(H);5~6.5、6号病蟹 白化肝小管空泡化(V),肝小管上皮细胞少量增生
(H);7~9.7~9号病蟹 肝小管上皮细胞空泡化严重(V);10~12.10~12号病蟹 肝小管上皮细胞溶解(D)。
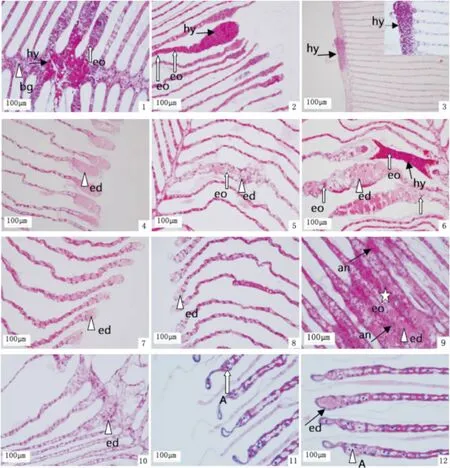
图版Ⅳ 病蟹鳃组织病理
Plate.Ⅳ Histopathology of gill in sick crabs
1.1号病蟹 鳃丝、鳃弓充血(hy),嗜酸性粒细胞(eo)和嗜碱性粒细胞(bg)浸润;2.2号病蟹 鳃小叶尖端充血(hy),嗜酸性粒细胞浸润(eo);3.3号病蟹 鳃弓充血(hy);4.4号病蟹 鳃小叶尖端水肿(ed);5.5号病蟹 鳃小叶水肿(ed),嗜酸性粒细胞浸润(eo);6.6号病蟹 鳃小叶充血(hy)、水肿(ed),嗜酸性粒细胞浸润(eo);7~8.7、8号病蟹 鳃小叶轻微水肿
(ed);9.9号病蟹 鳃小叶严重水肿(ed)、上皮细胞融合(an)、嗜酸性粒细胞浸润(eo);10.10号病蟹 鳃弓水肿(ed);
11.11号病蟹 鳃小叶尖部萎缩(A);12.12号病蟹 鳃小叶尖部萎缩(A)、水肿(ed)。

图版V 病蟹肌肉组织病理
Plate.V Histopathology of muscle in sick crabs
1.1号病蟹 肌肉萎缩较轻(A),嗜碱性粒细胞浸润(bg);2~5.2~5号病蟹 肌肉萎缩较轻(A);6.6号病蟹 肌肉轻度萎缩(A),嗜碱性粒细胞浸润(bg);7~8.7、8号病蟹 肌肉重度萎缩(A);9.9号病蟹 肌肉萎缩较轻(A)、
嗜碱性粒细胞浸润(bg);10~12.10~12号病蟹 肌肉重度萎缩(A),结缔组织增多(S)。
